
Перекристаллизация
Цель работы: произвести очистку соли хлорида натрия её перекристаллизацией из своего насыщенного раствора, рассчитать выход продукта.
Оборудование и реактивы: аналитические весы, набор разновесов, колба, мерная колба на 50 мл., стеклянный стаканчик, фильтровальная бумага, дистиллированная вода, хлорид натрия NaCl.
Теоретическая часть:
Метод очистки вещества перекристаллизацией из раствора состоит в том, что исходное вещество растворяется в растворителе, а затем в системе создаётся пересыщение путём выпаривания из него некоторой части растворителя. При этом большая часть растворённого вещества выделяется в виде кристаллов, а основное количество примесей остаётся в растворе.
Практическая часть:
Проверили весы на работоспособность по принятой технологии;
Рассчитали массу соли, необходимую для получения насыщенного раствора хлорида натрия NaCl. В справочнике, выданном нам дежурным инженером растворимость хлорида натрия NaCl при 50ºС составила 39,2 г на 100 г растворителя. Поэтому для получения насыщенного раствора на 50 г растворителя было взято 19,6 грамм соли;
На левую чашу аналитических весов положили бумажку (на которой в дальнейшем будем взвешивать вещество). Масса бумажки меньше 1 грамма, поэтому нам пришлось вращать лимбы. Большой (внешний) лимб оказался на делении 2, а малый (внутренний) оказался на делении 60. Тем самым масса бумажки оказалась равна 0,260 гр.;
Взвесили необходимую массу NaCl (19,6 грамм). Для этого по очереди на правую чашу весов поставили гирьки массами 10 гр., 5 гр., 2 гр., 2 гр.. Большой лимб оказался на делении 8 (так как 19,6 + 0,260 = 19,86 (гр.)), а малый в прежнем положении;
Соль NaCl растворили в 50 мл дистиллированной воды, и поставили стеклянный стаканчик с приготовленным раствором на песчаную баню;
После того, как из стаканчика жидкость упарилась на половину, мы произвели фильтрование раствора. Для этого приготовили обычный фильтр из фильтровальной бумаги и по принятой технологии произвели эту операцию.
Полученный осадок высушили, и измерили его массу на весах. На правой чашке весов по очереди оказались гирьки массами: 5 гр., 2 гр., 1 гр., большой лимб на делении 4, а маленький на делении 10, при этом стрелка отклонилась от среднего деления на 4 деления. Следовательно масса очищенной соли NaCl оказалась равна 8,4104 – 0,140 = 8,2704 (грамм);
По окончанию каждого взвешивания весы приводили в нерабочее состояние, плавным поворотом арретира;
Рассчитали выход продукта:
![]() =
42 %
=
42 %
Вывод:
Перекристаллизация соли NaCl из её насыщенного раствора путём упаривания этого раствора произведена успешно. Преподаватель одобрил все произведённые операции. Выход продукта составил 42%, что является приемлемым значением при выполнении такого опыта.
Определение плотности вещества
Цель работы: определить плотность вещества – 30% раствора хлорида бария пикнометрическим и ареометрическим методом.
Оборудование и реактивы: аналитические весы, набор разновесов, мерный цилиндр, ареометр, пикнометр, шприц, дистиллированная вода, 30% раствор хлорида бария BaCl2.
![]()
Теоретическая часть:
Плотность показывает какая масса вещества содержится в единице объёма. Для определения плотности жидкостей применяются различные методы: ареометрический и пикнометрический.
А
рис.
2
П
рис.
3![]()
![]() , где m1-
масса пустого пикнометра, m2-
масса пикнометра с водой, m3-
масса пикнометра с исследуемой жидкостью.
, где m1-
масса пустого пикнометра, m2-
масса пикнометра с водой, m3-
масса пикнометра с исследуемой жидкостью.
Практическая часть:
Проверили весы на работоспособность по принятой технологии;
Взвесили пустой пикнометр. Масса пикнометра составила 7,8033 грамм;
С помощью шприца ввели в пикнометр дистиллированную воду и взвесили этот пикнометр на аналитических весах. Масса пикнометра составила 18,4020 грамм;
В пустой пикнометр ввели с помощью шприца раствор хлорида бария (II) BaCl2 и взвесили этот пикнометр на аналитических весах. Масса пикнометра составила 20,669 грамм;
Рассчитали плотность жидкости по формуле:
=
![]() (гр/см3);
(гр/см3);
Затем мы налили в мерный цилиндр раствор хлорида бария (II) BaCl2 и опустили в него ареометр. Результат оказался равным 1,2156 (гр/см3);
Значит плотность раствор хлорида бария (II) BaCl2 составляет
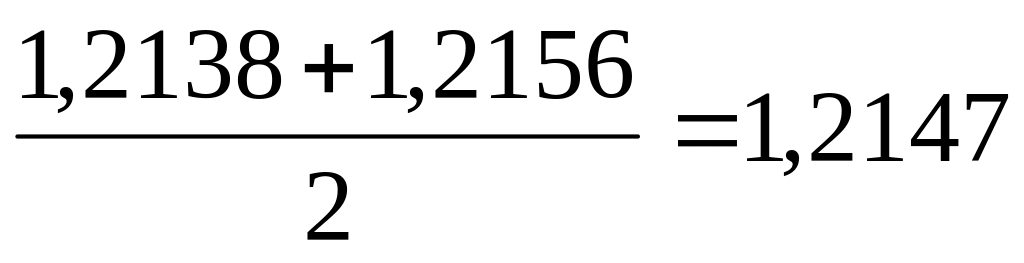 (гр/см3).
(гр/см3).
Вывод:
Определена плотность раствора хлорида бария (II) BaCl2, которая составила 1,2147 (гр/см3) . Результат полученный у дежурного инженера в препараторской оказался одинаковым с тем, что получили в ходе проведения работы.
