
- •Питання до іспиту.........................................................................................196
- •Термінологічний словник.............................................................................203
- •Тематика лекційного курсу з біохімії спорту
- •Тематика лабораторних занять
- •Критерії оцінювання знань і вмінь студентів
- •Лабораторне заняття №1 Сучасні біохімічні методи досліджень в спорті. Якісні реакції на білки цитоплазми м'язових клітин. Біуретова реакція
- •Практична частина Якісні реакції на білки цитоплазми м'язових клітин. Біуретова реакція
- •Лабораторне заняття № 2 Хімічний склад м'язів і хімізм м'язового скорочення. Будова скорочувальних білків
- •Теоретична частина
- •Характеристика типів м'язових волокон у людини
- •Хімічний склад м'язів. Методи отримання і виявлення окремих хімічних компонентів м'язової тканини.
- •Лабораторне заняття № 3 Вивчення механізмів анаеробного ресинтезу атф при фізичній роботі. Визначення вмісту молочної кислоти ензиматичним методом
- •Визначення вмісту молочної кислоти в крові ензиматичним методом
- •Лабораторне заняття № 4
- •Теоретична частина
- •Практична частина
- •Лабораторне заняття № 5
- •Практична частина Визначення гемоглобіну в крові уніфікованим гемоглобінціанідним методом
- •Лабораторне заняття № 6 Детоксикаційні системи, їх роль в забезпеченні фізичної діяльності. Методика кількісного визначення сечовини крові
- •Практична частина. Визначення сечовини в сироватці крові за кольоровою реакцією з діацетилмонооксимом
- •Лабораторне заняття №7 Біохімічні основи нейроендокринної регуляції обміну речовин при заняттях спортом. Визначення адреналіну в сечі
- •Практична частина
- •Біохімія і біоенергетика м'язового скорочення
- •Лабораторна робота № 9
- •Завдання №1. Визначення активності креатинкінази в сироватці крові кінетичним методом
- •Завдання №2. Визначення тригліцеридів в сироватці крові за кольоровою реакцією з ацетилацетоном
- •Лабораторне заняття № 10 Динаміка біохімічних змін при стомленні. Визначення активності лактатдегідрогенази в сироватці крові за реакцією з 2,4-динітрофенілгідразином
- •Теоретична частина
- •Практична частина Визначення активності лактатдегідрогенази (к.Ф.1.1.1.27) в сироватці крові за реакцією з 2,4-динітрофенілгідразином (метод Севела, Товарек)
- •Теоретична частина
- •Практична частина
- •Практична частина
- •Лабораторне заняття №13 Біохімічні основи раціонального харчування спортсменів. Визначення загального холестерину крові ферментативним методом
- •Теоретична частина
- •Практична частина Завдання №1. Визначення загального холестерину в сироватці крові за реакцією Ліберман-Бурхард (метод Ілька)
- •Лабораторне заняття №14 Вплив біологічно активних речовин на працездатність спортсменів. Визначення метаболітів перекисного гемолізу еритроцитів
- •Природні анаболіки і антикатаболічні засоби
- •Енергодаючі засоби
- •Природні стимулятори і антидепресанти
- •Засоби, що сприяють збільшенню м'язового об'єму
- •Практична частина Завдання №1. Визначення перекисного гемолізу еритроцитів
- •Лабораторне заняття №15 Біохімічний контроль в спорті. Кількісне визначення глюкози до і після навантаження глюкооксидазним методом
- •Одноразова проба з цукровим навантаженням полягає в наступному. Вранці натщесерце у досліджуваного беруть кров з пальця і визначають в ній вміст глюкози.
- •Семінарське заняття № 16
- •Взаємозв'язок біохімічних процесів в організмі при фізичних навантаженнях
- •Список використаних скорочень
- •Термінологічний словник
- •Додаток а
- •Навчально-методичний посібник
Лабораторне заняття № 2 Хімічний склад м'язів і хімізм м'язового скорочення. Будова скорочувальних білків
Мета роботи: ознайомитися з хімічним складом м'язової тканини і вивчити хімічні процеси, які супроводжують м'язове скорочення. Ознайомитися з методами виділення міофібрилярних білків.
Питання для самопідготовки:
1. Дайте характеристику будови і складу м'язової тканини.
2. Опишіть саркомер як скорочувальну одиниця м'язового волокна.
3. Які особливості будови і властивостей актину і міозину?
4. Що розуміють під АТФ-азною активністю міозину?
5. Яку роль відіграють тропоміозин і тропонін в м'язовому скороченні?
6. Охарактеризуйте механохімію м'язового скорочення. Як відбувається утворення актоміозину?
7. Яку роль відіграє АТФ в скороченні і розслабленні м'язового волокна?
8. Охарактеризуйте іонний склад цитоплазми м'язової клітини.
Теоретична частина
На м'язові тканини в нашому організмі припадає від 30% до 40% маси тіла. У людей, які займаються силовими видами спорту, і особливо культуристів, м'язова тканина може складати до 70% маси тіла.
Скорочувальна функція м'язів забезпечує рух тіла, підтримку пози в просторі, дихання, кровообіг, переміщення їжі і дітородіння.
Загальний хімічний склад м'язової тканини. У м'язовій тканині людини міститься 72-80% води і 20-28% сухого залишку, 17-22% якого складає білок, усе інше – небілкова частина сухого залишку, яка включає глікоген, ліпіди, креатинфосфат, АТФ, молочну кислоту, мінеральні речовини. Білки розподіляються на саркоплазматичні (складають 35%), міофібрилярні (близько 45%) і білки строми (сполучні тканини) – 20%. Саркоплазматичні білки – це ферменти гліколізу, ліпідного обміну, окиснювального фосфорилювання і нітрогенного обміну. До міофібрилярних білків відносяться скорочувальні білки, міозин, актин, тропоміозин, тропонін. Білки строми представлені колагеном і еластином.
М'язи — одна з чотирьох найбільш важливих тканин в організмі серед таких, як нервова, сполучна і епітеліальна. Існує три типи м'язів: серцевий м'яз (міокард); гладенька мускулатура, локалізована в стінках кровоносних судин, дихальних шляхах, кишечнику, матці і сечовому міхурі і скелетна (поперечно-смугаста) мускулатура.
Серцевий м'яз складається з багатьох окремих клітин – кардіоміоцитів неправильної циліндричної форми довжиною 100-150 мкм і діаметром 10-20 мкм. Кожний кардіоміоцит має 1-2 овальних подовжених ядра, які лежать в центрі і оточені міофібрилами, розташованими по периферії строго прямолінійно. Ці клітини сполучені між собою за допомогою спеціальних контактів – вставних дисків, які на повздовжньому розрізі мають вид сходинок. За допомогою дисків кардіоміоцити не тільки сполучені між собою як єдиний м'яз, але і проводять нервовий імпульс, який швидко розповсюджується від клітини до клітини, синхронізуючи скорочення кардіоміоцитів всього м'яза. Кардіоміоцити багаті на великі мітохондрії з добре розвиненими кристами. Мітохондрії розташовуються групами між міофібрилами. По периферії клітини і між мітохондріями знаходиться безліч частинок глікогену і елементів гладенького ендоплазматичного ретикулуму. Сарколема кардіоміцитів має безліч мікропіноцитозних пухирців. Між міофібрилами кардіоміоцитів немає чітких меж. Серцевий м'яз за середній час життя людини встигає здійснити близько трьох мільярдів циклів скорочення і розслаблення.
У клітинах цього типу скорочення запускається підвищенням концентрації Са2+ в цитозолі (так само як і в клітинах скелетних м'язів), проте іони Са2+ діють не через тропонін–тропоміозиновий комплекс, а безпосередньо взаємодіючи з молекулою міозину. Серцевий м'яз працює в певному ритмі, чергуючи скорочення (систола) близько 0,4 сек. і розслаблення (діастола) близько 0,6 сек. Міокард не підвладний волі людини і частота серцевих скорочень (ЧСС) регулюється симпатичною, парасимпатичною нервовою системами і гормонально.
Гладенькі м'язи присутні у всіх внутрішніх органах: шкірі, судинах, травній системі і матці. Як і міокард, гладенькі м'язи контролюються симпатичною і парасимпатичною нервовою системами, а також цілим рядом гормонів в залежності від органу, де вони розташовані. Гладенькі м'язи не підпорядковані волі людини.
Клітини гладенької мускулатури пристосовані до повільного тривалого скорочення і здатні підтримувати напругу тривалий час. Вони в 5-10 разів менше гідролізують АТФ, ніж вимагалося б, для виконання такого ж завдання клітинами скелетних м'язів.
Скелетні м'язи забезпечують рух нашого тіла і підтримку пози. Вони відокремлені від сполучної тканини (фасції) мембранами. Сполучна тканина проникає і в порожнину самого м'яза, зменшуючись при цьому по товщині, у зв'язку з чим відбувається розділення м'яза на все більш і більш дрібніші компартменти. Найменшими з них є пучки, які включають велику кількість м'язових волокон, прикріплених один до одного сполучною тканиною. Сарколему м'язових клітин покривають колагенові волокна, які на кінцях м'язових клітин перетворюються на сухожилля, якими і прикріплюються до колагенової мембрани кісток скелета.
Клітини м'язової тканини представлені довгими багатоядерними волокнами до 30 см завдовжки і діаметром від 10 до 100 мікрон. М'язові клітини не здатні до ділення і чисельність їх може збільшуватися тільки за рахунок сплячих, закладених з ембріонального періоду клітин, – сателітів. Як і будь-яка клітина нашого організму, м'язова клітина оточена мембраною – сарколемою, яка здатна здійснювати трансмембранний транспорт: пасивний транспорт або дифузію, і активний транспорт або виборчий (за участю АТФ і ферментів). Від сарколеми відходить серія мембранних вп'ячувань, які отримали назву поперечних трубочок (Т-трубочок). Т-трубочки відходять від сарколеми всередину клітини.
Передача нервового імпульса на м'язову клітину відбувається наступним чином. В синапсі аксон переривається, і передача імпульса відбувається шляхом дифузії ацетилхоліну із синаптичних пухирців в синаптичну щілину (рис. 7).

Рис. 7. Будова синапсу: 1 — аксон; 2 — мікротрубочки; 3 — мітохондрії; 4 — синаптичні пухирці; 5 — лемоцити; 6 — пресинаптична мембрана; 7 — синаптична щілина; 8 — постсинаптична мембрана; 9 — рецептор ацетилхоліну; 10 — ацетилхолінестераза.
Далі молекули ацетилхоліну дифундують до постсинаптичної мембрани і з'вязуються із специфічним білком-рецептором. Зміна конформації білка-рецептора призводить до зміни іонної проникності постсинаптичної мембрани. При цьому сам рецептор має пору для іонів або конформаційна зміна рецептора передається компонентам іонного каналу, збільшуючи проникність мембрани для іонів Nа+. Медіатор в синаптичній щілині швидко інактивується ферментом ацетилхолінестеразою. Після цього синапс готовий до передачі наступного імпульсу.
Внутрішній об'єм м'язової клітини заповнений саркоплазмою (цитоплазмою м'язової клітини), яка є в'язкою рідиною. До її складу входять вода, ліпіди і білки. У ній і розташовані органели клітини.
Клітинне ядро складається з оболонки, ядерного соку, ядерця і хроматину. Функціональна роль ядерної оболонки полягає у відособленні генетичного матеріалу (хромосом) від цитоплазми. Хроматин є інтерфазною формою існування хромосом клітини і представлений нуклеопротеїдним комплексом, який складається з молекул ДНК і білків. У ядрі клітини людини довжина всіх молекул ДНК в повному розтягнутому вигляді склала б приблизно 2 метри (близько 5 млрд нуклеотидних пар). Для збереження функціонування такої кількості генетичної інформації при діленні клітини існує 5 рівнів спіралізації (упаковки) нуклеопротеїдного комплексу.
Лізосоми – органели клітин розміром 0,2-0,8 мкм. Мають одиночну мембрану. Вони містять різноманітні ферменти, такі як РНК-аза і кисла ДНК-аза (розщеплюють нуклеїнові кислоти), фосфопротеїдфосфотаза (розщеплює фосфопротеїди і пірофосфати), катепсин і колагеназа (розщеплюють білки) і α- глюкозидаза (розщеплює полісахариди).
Мітохондрії – органели двохмембранного типу будови. Всі речовини, які поступають в мітохондрії, повинні спочатку проникнути крізь гладеньку зовнішню, відносно пористу мембрану, а потім і крізь внутрішню, яка служить бар'єром, що обмежує проникливість. Внутрішня мембрана є істинною функціональною мембраною мітохондрій, яка містить вельми складно організовану систему білків, які беруть участь в окиснювальних процесах, що продукують енергію. Внутрішня мембрана мітохондрій утворює численні, обернені всередину складки, або кристи, що дозволяє створити максимальну площу поверхні, на якій протікають реакції енергетичного обміну. Сумарна площа поверхні, що створюється цими складками мембрани в клітинах печінки людини, в середньому складає величину, що перевищує 10 тис. км2.
Мітохондрії мають повну систему синтезу білків, тобто мають свою специфічну ДНК, мітохондріальну РНК, рібосоми і ферменти в мітохондріальному матриксі.
Основною функцією мітохондрій є окиснювальне фосфорилювання, в результаті якого клітина отримує енергію, необхідну для здійснення життєвих процесів, і накопичує її у формі АТФ. Мітохондрії також здійснюють синтез специфічних білків, стероїдних гормонів і деяких амінокислот (наприклад, глутамінової).
Ендоплазматична сітка (ЕПС) або ретикулум є сіткою трубочок і цистерн, які пронизують цитоплазму і зливаються в деяких місцях з ядром і апаратом Гольджі.
Ендоплазматичний ретикулум виконує різноманітні функції, такі як:
синтез білка;
забезпечує активний транспорт різних сполук у внутрішньомембранній фазі;
синтез мембранних ліпідів (гладка ЕПМ);
транспорт і накопичення іонів в клітині;
синтез попередників стероїдних гормонів і інших специфічних сполук;
служить резервуаром іонів кальцію, вивільнення якого при нервовому імпульсі призводить до скорочення міофібрил.
Однією з важливих складових м'язової клітини є внутрішньоклітинний дихальний пігмент міоглобін, завдяки якому створюється запас кисню. Він обумовлює червоний колір саркоплазми.
Скорочувальні білки міозин і актин входять до складу ниткоподібних міофібрил товщиною 1-3 мкм. З'єднуючись один з одним, вони розташовуються від одного кінця м'язової клітини до іншого. Їх кількість в клітині може коливатися від 500 до 2500, що складає основну частину м'язової клітини (більше половини сухої ваги). Міофібрили оточені складнішою структурою – саркоплазматичним ретикулумом (СР).
П
 ід
мікроскопом м'язова тканина має поперечну
покресленість у вигляді світлих і темних
ділянок (рис. 8). Вона складається з
саркомерів
- найменших одиниць м'язового волокна,
здатних до скорочення. Від довжини
саркомеру
залежать сила і швидкість м'язового
скорочення. До складу
саркомеру
входять два типи
філаментів:
тонкі –
актинові
і товсті
– міозинові.
Темні смуги А, представлені
міозиновими
філаментами,
змінюються світлими дисками, посередині
А - диска є світліша смуга, яка має назву
зона Н, в ній
товсті філаменти
не перекриваються тонкими.
Н-зону видно тільки в розслабленому
стані м'язового волокна. З обох
боків
саркомер обмежений дисками
Z. Z-лінія – це білковий шар у формі диска,
до якого прикріплені
тонкі
філаменти,
тобто
актинові нитки. Вони тягнуться через
диск 1 і частково проникають в диск А.
ід
мікроскопом м'язова тканина має поперечну
покресленість у вигляді світлих і темних
ділянок (рис. 8). Вона складається з
саркомерів
- найменших одиниць м'язового волокна,
здатних до скорочення. Від довжини
саркомеру
залежать сила і швидкість м'язового
скорочення. До складу
саркомеру
входять два типи
філаментів:
тонкі –
актинові
і товсті
– міозинові.
Темні смуги А, представлені
міозиновими
філаментами,
змінюються світлими дисками, посередині
А - диска є світліша смуга, яка має назву
зона Н, в ній
товсті філаменти
не перекриваються тонкими.
Н-зону видно тільки в розслабленому
стані м'язового волокна. З обох
боків
саркомер обмежений дисками
Z. Z-лінія – це білковий шар у формі диска,
до якого прикріплені
тонкі
філаменти,
тобто
актинові нитки. Вони тягнуться через
диск 1 і частково проникають в диск А.
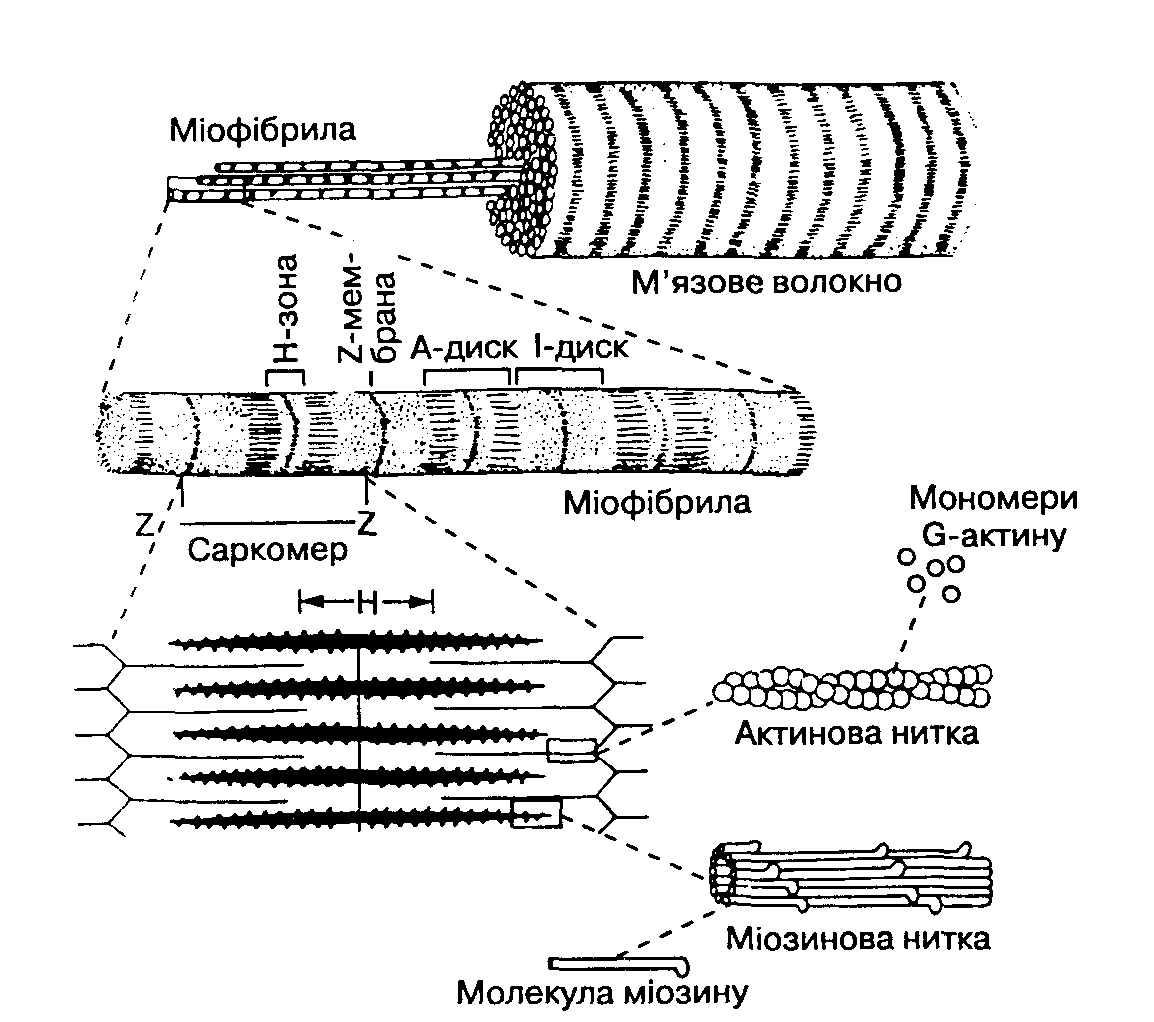

Рис. 8. Поперечно-смугаста мускулатура. Схема будови саркомеру.
М-лінія знаходиться посередині зони Н, а S-лінія виглядає дещо темніше із-за тонких ниток, які сполучають разом примикаючі товсті філаменти.
Поперечні зрізи міофібрили (у місці, де тонкі і товсті філаменти перекриваються) показують, що тонкі нитки розташовуються навколо товстого філаменту по кутах шестигранника таким чином, що кожна тонка нитка займає симетричне положення між трьома товстими нитками, а кожна товста нитка симетрично оточена шістьма тонкими (рис. 9, Г). На молекулярному рівні тонкі філаменти включають білки – актин, тропоміозин і тропонін І, С, Т.
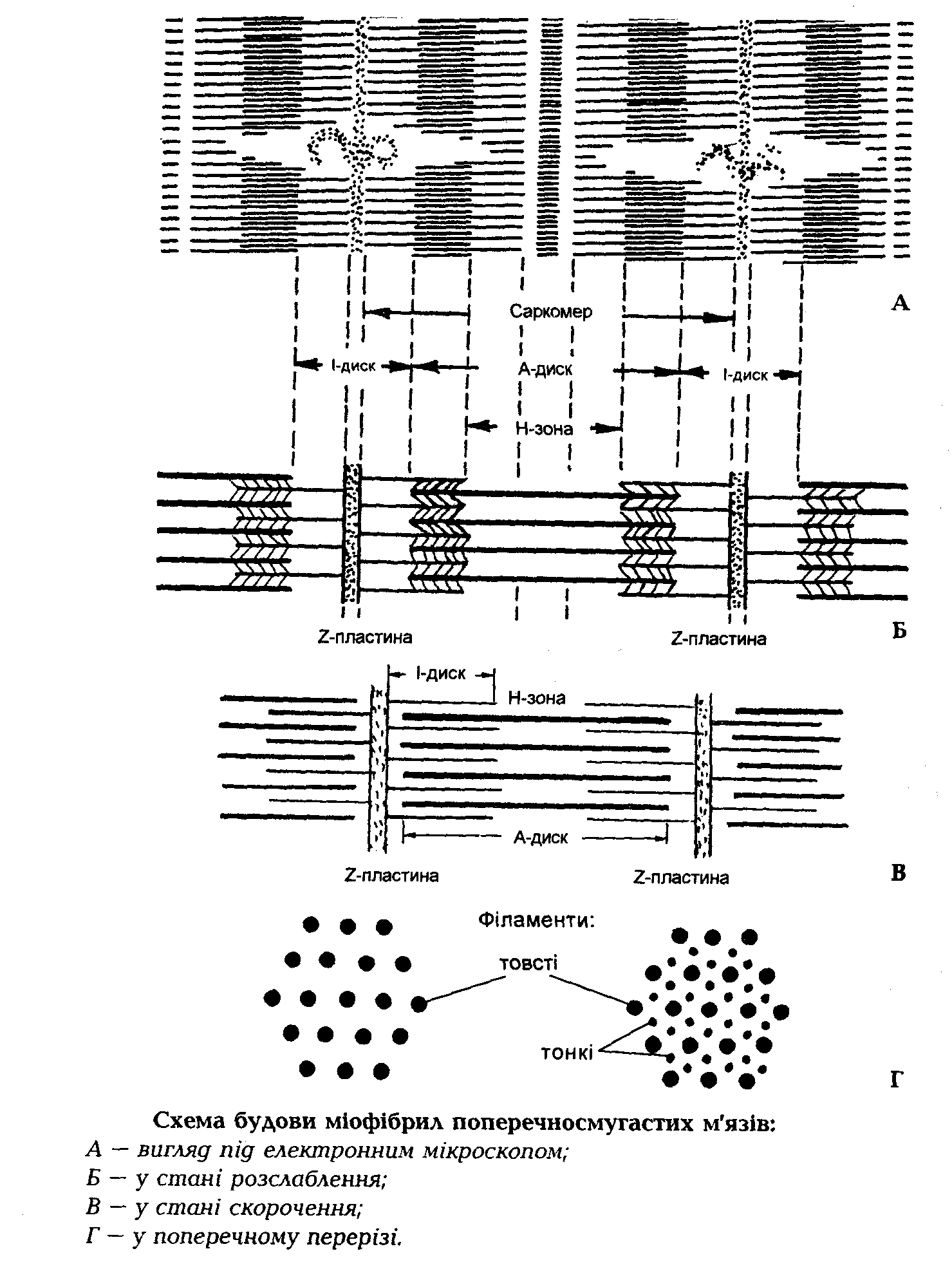
Рис. 9. Схема будови міофібрил поперечно-смугастих м'язів.
По своїй будові міозин – складний білок з четвертинною структурою. Має молекулярну масу 470000 Да. До складу міозину входять 6 субодиниць, дві фібрилярної і чотири глобулярної структури. У саркомері молекули міозину сполучені хвостиками в джгути по 300 штук і утворюють товсті нитки – філаменти. Лінія з'єднання хвостів міозину називається лінією М. Глобулярні ділянки міозину мають ферментативні властивості і у присутності активатору - іонів кальцію здатні розщеплювати АТФ до АДФ, отримуючи енергію, необхідну для руху тонких ниток філаментів.
Тонкі нитки складаються з трьох білкових молекул. Найвисокомолекулярнішим з них є актин з молекулярною масою 42000 Да. Він побудований у вигляді подвійної спіралі, яка сполучена одним кінцем з іншою молекулою актину в зоні S-лінії, а іншим вільним кінцем переміщається впродовж міозину при м'язовому скороченні.
Тропоміозин – білок, який складається з двох поліпептидних ниток і обмотує подвійну спіралеподібну молекулу актину, перешкоджаючи мимовільному ковзанню (своєрідний замок).
Третій білок в цьому комплексі – тропонін, який є четвертинним білком, складається з трьох субодиниць ТнТ, ТнІ, ТнС. Ці субодиниці забезпечують його зв'язок з актином і тропоміозином, а фрагмент ТнС має ферментативну активність, і за наявності іонів кальцію може звільняти актин від тропоміозину, а, отже, дозволяє рухатися актину впродовж міозину. Рух актинових ниток є результатом взаємодії чотирьох білків міофібрил – міозину, актину, тропоміозину і тропоніну.
Скорочення саркомеру супроводжується гідролізом АТФ і активується іонами Са2+. АТФазні центри головок міозину мають високу спорідненість до молекул АТФ. В присутності іонів Са2+ на мономерах актинової нитки відкриваються центри зв'язування міозинових голівок. До цього призводить приєднання Са2+ до тропоніну. Іони Са2+ викликають просторові зміни всієї системи тропонін-тропоміозин-актин, які ведуть до приєднання міозинових голівок до найближчого з мономерів актину.
Приєднання голівки до актину активує АТФазний центр. АТФ гідролізується, що призводить до зміни конформації міозину. Внаслідок напруги, яка виникає, голівка міозину нахиляється до М-лінії, підтягуючи також в цьому напрямку прикріплену до неї актинову нитку. Звільнений АТФазний центр приєднує нову молекулу АТФ, що призводить до вивільнення міозинової голівки від актину. Голівка повертається у висхідне положення, і тепер може приєднатися до іншого мономіру актину.
Сотні міозинових голівок кожної міозинової нитки працюють одночасно (але не синхронно), втягуючи актинову нитку. Граничне скорочення м'язу розвивається в соті долі секунди (порядку 0,02 с). Сила скорочення залежить від кількості міозинових голівок, включених до роботи.
Процес скорочення і розслаблення м'язового волокна включає шість стадій (рис. 10).
Саркоплазмати-чний
ретику-лум
+ Іони
кальцію
Нервове
збудження
Саркоплазма-тичний
ретикулум
Іони
кальцію
 +
+
Активація
актину
Іони
кальцію
Актин-Тропоміозин-Тропонін
Ак-тин
Тропонін/Іони
кальцію

 +
+
Утворен-ня
спайок
міозин+АТФ
Іони
каль-цію
Міозин+
АДФ+
фосфор-на
к-та+ Актин
Міозин+АДФ+
фосфорна к-та
Ак-тин


 + +
+ +
ЕНЕРГІЯ
Рис. 10. Стадії
скорочення і розслаблення м’язового
волокна.
Розвиток
напруги
Актин+
Міозин+АДФ+Фосфорна
к-та
Актин+
Міозин
АДФ+Фосфорна к-та +
+
Розрив
спайок
Актин+Міозин
АТФ
Міозин+АТФ
Актин+
Тропоміозин+
Тропонін +
+
+ +
Розслаблення
Са2+
Сарко-плазма-тичний
рети-кулум+
іони
кальцію
Саркоплаз-мати-чний
рети-кулум

 + + + + +
+ + + + +
Скелетна мускулатура включає три типи м'язових волокон, переважання якого-небудь з них в м'язі залежить від виконуваної функції. Ці типи м'язових волокон відрізняються скорочувальними, метаболічними і морфологічними властивостями. До них відносяться:
волокна, які скорочуються повільно, (червоні) – Тип І;
волокна, які швидко скорочуються (білі) – Тип IІа, Тип ІІб.
Розглянемо основні характеристики цих типів м'язових волокон (табл. 3).
Таблиця 3.
