
- •Питання до іспиту.........................................................................................196
- •Термінологічний словник.............................................................................203
- •Тематика лекційного курсу з біохімії спорту
- •Тематика лабораторних занять
- •Критерії оцінювання знань і вмінь студентів
- •Лабораторне заняття №1 Сучасні біохімічні методи досліджень в спорті. Якісні реакції на білки цитоплазми м'язових клітин. Біуретова реакція
- •Практична частина Якісні реакції на білки цитоплазми м'язових клітин. Біуретова реакція
- •Лабораторне заняття № 2 Хімічний склад м'язів і хімізм м'язового скорочення. Будова скорочувальних білків
- •Теоретична частина
- •Характеристика типів м'язових волокон у людини
- •Хімічний склад м'язів. Методи отримання і виявлення окремих хімічних компонентів м'язової тканини.
- •Лабораторне заняття № 3 Вивчення механізмів анаеробного ресинтезу атф при фізичній роботі. Визначення вмісту молочної кислоти ензиматичним методом
- •Визначення вмісту молочної кислоти в крові ензиматичним методом
- •Лабораторне заняття № 4
- •Теоретична частина
- •Практична частина
- •Лабораторне заняття № 5
- •Практична частина Визначення гемоглобіну в крові уніфікованим гемоглобінціанідним методом
- •Лабораторне заняття № 6 Детоксикаційні системи, їх роль в забезпеченні фізичної діяльності. Методика кількісного визначення сечовини крові
- •Практична частина. Визначення сечовини в сироватці крові за кольоровою реакцією з діацетилмонооксимом
- •Лабораторне заняття №7 Біохімічні основи нейроендокринної регуляції обміну речовин при заняттях спортом. Визначення адреналіну в сечі
- •Практична частина
- •Біохімія і біоенергетика м'язового скорочення
- •Лабораторна робота № 9
- •Завдання №1. Визначення активності креатинкінази в сироватці крові кінетичним методом
- •Завдання №2. Визначення тригліцеридів в сироватці крові за кольоровою реакцією з ацетилацетоном
- •Лабораторне заняття № 10 Динаміка біохімічних змін при стомленні. Визначення активності лактатдегідрогенази в сироватці крові за реакцією з 2,4-динітрофенілгідразином
- •Теоретична частина
- •Практична частина Визначення активності лактатдегідрогенази (к.Ф.1.1.1.27) в сироватці крові за реакцією з 2,4-динітрофенілгідразином (метод Севела, Товарек)
- •Теоретична частина
- •Практична частина
- •Практична частина
- •Лабораторне заняття №13 Біохімічні основи раціонального харчування спортсменів. Визначення загального холестерину крові ферментативним методом
- •Теоретична частина
- •Практична частина Завдання №1. Визначення загального холестерину в сироватці крові за реакцією Ліберман-Бурхард (метод Ілька)
- •Лабораторне заняття №14 Вплив біологічно активних речовин на працездатність спортсменів. Визначення метаболітів перекисного гемолізу еритроцитів
- •Природні анаболіки і антикатаболічні засоби
- •Енергодаючі засоби
- •Природні стимулятори і антидепресанти
- •Засоби, що сприяють збільшенню м'язового об'єму
- •Практична частина Завдання №1. Визначення перекисного гемолізу еритроцитів
- •Лабораторне заняття №15 Біохімічний контроль в спорті. Кількісне визначення глюкози до і після навантаження глюкооксидазним методом
- •Одноразова проба з цукровим навантаженням полягає в наступному. Вранці натщесерце у досліджуваного беруть кров з пальця і визначають в ній вміст глюкози.
- •Семінарське заняття № 16
- •Взаємозв'язок біохімічних процесів в організмі при фізичних навантаженнях
- •Список використаних скорочень
- •Термінологічний словник
- •Додаток а
- •Навчально-методичний посібник
Лабораторне заняття №1 Сучасні біохімічні методи досліджень в спорті. Якісні реакції на білки цитоплазми м'язових клітин. Біуретова реакція
Мета роботи: Ознайомитися з сучасними методами лабораторних біохімічних досліджень, які дозволяють визначити органічні і неорганічні речовини організму людини. Навчитися визначати екстрактні речовини небілкової і білкової природи в м'язовій тканині.
Питання для самопідготовки:
1. Розкрийте значення електрохімічних методів для аналізу білкових компонентів організму.
2. Наведіть відомі Вам види хроматографії і їх застосування для діагностики біологічно активних речовин і допінгів в крові і сечі спортсменів.
3. Вкажіть імуноферментні методи, які використовуються для аналізу функціонального стану спортсмена.
4. Охарактеризуйте біохімічні функції білків в м'язовій тканині.
5. Дайте стислу характеристику методів якісного і кількісного аналізу білка.
6. Опишіть хімічний склад м'язової тканини.
ТЕОРЕТИЧНА ЧАСТИНА.
В основі наших фізичних можливостей лежать біохімічні процеси в м'язовій тканині, пов'язані з енергозабезпеченням механізму м'язового скорочення, в якому беруть участь серцево-судинна (СС), дихальна, видільна, буферна і інші системи нашого організму. Отже, збалансованість всіх біохімічних процесів в організмі визначає здоров'я людини. Саме тому такий важливий контроль за змінами біохімічних показників під впливом фізичних навантажень.
Методи дослідження, які використовуються в біохімії, умовно можна розділити на точні лабораторні і експрес-методи.
Експрес-методи дозволяють швидко проводити біохімічні дослідження крові, сечі і інших біологічних рідин за допомогою спеціальних хімічних наборів-тестів без використання складної апаратури. Ці методи широко застосовуються в спортивній практиці і медицині.
Лабораторні методи включають багато фізичних і хімічних методів дослідження, які вимагають наявності складних приладів, таких як електрофотоколориметр, спектрофотометр, флюориметр, газовий і спектральний аналізатори, ультрацентрифуги і ін., а також лабораторних умов для проведення експерименту.
До основних лабораторних методів належать:
• якісний і кількісний аналіз складу тканин, крові, сечі, слини, повітря, яке видихається, і інших об'єктів дослідження за допомогою різних методологічних підходів;
• електрофорез, який дозволяє розділити речовини на фракції за допомогою електричного струму в спеціальних апаратах для електрофорезу;
• хроматографія, яка дозволяє за допомогою сорбентів розділяти речовини з різною молекулярною масою і рухливістю: зразки наносяться на спеціальні сорбенти в хроматографічних колонках, а потім елюіюються (змиваються) буфером; елюати збирають в пробірки і досліджують.
• рентгеноструктурний і спектральний аналізи, які дозволяють визначити зміну структури молекули речовин при різних процесах, наприклад під впливом анаболіків;
• ауторадіографія (метод мічених атомів), дозволяє визначити особливості обміну речовин в організмі за допомогою радіоактивних ізотопів вуглецю (14С), фосфору (32Р), сірки (35S), кальцію (45Ca), йоду (131J) і інш.;
• імунологічний метод, який дозволяє визначити дуже незначні зміни кількості речовини, наприклад, при прихованій фазі стомлення (перетренованості, дії фізичних навантажень), а також при виникненні захворювань, викликаних збудниками інфекційних хвороб або алергенами;
• цитобіофізичний метод, який дозволяє визначити енергетичний стан людини і його біологічний вік за біоелектричними властивостями ядер клітин епітелію.
В залежності від властивостей досліджуваної системи, які застосовуються в аналізі, різні методи дослідження підрозділяють на: оптичні, електрохімічні, електрофоретичні, хроматографічні і кінетичні. У роботі клінічних лабораторій переважно використовуються оптичні методи аналізу і значно рідше — усі інші. Таким чином, детальніше ми зупинимося на викладі основ оптичних методів аналізу.
Отже, до оптичних методів відносяться: фотометрія, рефрактометрія, поляриметрія.
ФОТОМЕТРІЯ
Фотометричні методи оптичного аналізу, у свою чергу, прийнято підрозділяти на дві групи: абсорбційну фотометрію і емісійну фотометрію (рис.2).
АБСОРБЦІЙНА ФОТОМЕТРІЯ (лат. absorbcio — поглинання) — це метод аналізу, який заснований на вимірюванні ступеня ослаблення монохроматичного світлового потоку в результаті виборчого поглинання світла розчиненою речовиною.
Теоретичним обгрунтуванням абсорбційної фотометрії служить закон Ламберта-Бера, який також називають основним законом фотометрії. Закон формулюється таким чином: "Логарифм відношення інтенсивності світлового потоку, який входить в розчин, до інтенсивності світлового потоку, який виходить з розчину, прямо пропорційний концентрації речовини і товщині поглинаючого шару". Математично цей закон виражається формулою:
![]()
де І0 — вхідний світловий потік;
І — світловий потік, що виходить;
ε — коефіцієнт поглинання, величина постійна для розчинів даної речовини при проходженні світла з певною довжиною хвилі;
В — товщина шару;
С — концентрація речовини.
![]() — називається
оптичною щільністю розчину, або
екстинкцією.
— називається
оптичною щільністю розчину, або
екстинкцією.
Скорочено позначається буквою Е. Тоді Е=ε·В·С. Тобто, оптична щільність розчину визначається як добуток величини концентрації речовини в розчині на товщину поглинаючого шару розчину. Оскільки в умовах конкретної методики вимірювання екстинкції досліджуваних розчинів завжди виконується в оптичних кюветах із визначеною товщиною робочого шару, то в правій частині вказаного рівняння, окрім постійної величини Е, постійною є також величина В. Таким чином, εВ = К (константа).
І в спрощеному вигляді рівняння можна представити як:
![]()
Т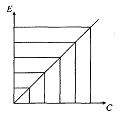 обто,
"оптична щільність розчинів, за інших
рівних умов, прямо пропорційна концентрації
речовини".
обто,
"оптична щільність розчинів, за інших
рівних умов, прямо пропорційна концентрації
речовини".
З
Рис. 1. Графічне
зображення закону Ламберта-Бера
Це має важливий практичний наслідок, оскільки за допомогою системи координат можна виконувати розрахунки концентрації досліджуваної речовини в розчині за результатом вимірювання екстинкції даного розчину. Закон Ламберта-Бера практично втілюється в калібрувальних графіках, побудова яких виконується при експлуатації будь-яких типів фотометрії.
Спектрофотометрія відноситься до методів абсорбційної фотометрії. При спектрофотометрії, або в більш загальному сенсі — колориметрії (лат. Color — колір), вимірюють інтенсивність забарвлення розчину речовини, яка аналізується, відносно інтенсивності забарвлення еталонного розчину з точно відомою концентрацією, і досліджувані розчини повинні бути обов'язково прозорі. У фотоелектроколориметрах отримують лише відносно монохроматичний промінь світла за допомогою світлофільтрів, тому чутливість їх невелика. Спектрофотометри володіють набагато більшою роздільною здатністю і чутливістю, оскільки замість світлофільтрів в них використовуються дифракційні решітки і тригранні призми для виокремлення строго монохроматичного променя світла. Це є важливою умовою для повного дотримання основного закону фотометрії.
ЕМІСІЙНА ФОТОМЕТРІЯ (лат. emisio — випромінювання) — це метод аналізу, який заснований на вимірюванні енергії, яка випромінюється речовиною в результаті переходу до енергетично збудженого стану. Атоми і молекули здатні поглинати енергію, яка поступає до них ззовні. Це викликає новий енергетичний стан речовини – збуджений. Такий стан пов'язаний з внутрішньоатомними переходами електронів з енергетично стійких орбіталей на інші, більш енергоємні. З припиненням дії зовнішнього агента, електрони повертаються на початкові орбіталі, випромінюючи при цьому надмірний квант енергії. Але цей енергетичний сплеск відображає вже особливості структури випромінюючої молекули. За характером спектрів випускання визначають речовину, що знаходиться в досліджуваному розчині, а за інтенсивністю смуг спектру – концентрацію цієї речовини. До методів емісійної фотометрії відносять: флюориметрію і полум'яну фотометрію (рис. 2).
Фотометрія

Абсорбційнафотометрія
Емісійна фотометрія



Спектрофо-тометрія
Нефело-метрія
Флюори-метрія
Полум’яна
фотометрія


Власне нефелометрія
Турбідиметрія
Рис. 2. Схема фотометричних методів
оптичного фізико-хімічного аналізу [12].
Флюориметрія. Заснована на ефекті флюоресценції, який виникає в результаті енергетичного збудження досліджуваної речовини під впливом жорсткого короткохвильового опромінювання (ультрафіолетові промені). Флюориметричні дослідження виконують на апаратах — флюориметрах. Метод за своєю чутливістю значно перевищує колориметричні методи.
Полум'яна фотометрія. При полум'яній фотометрії електрони досліджуваної речовини поглинають енергію полум'я газового пальника. Це викликає в них стан збудження. При поверненні на вихідні орбіталі, іони металів випромінюють кванти енергії і таким чином забарвлюють полум'я пальника в різний колір відповідно до характерних для них спектрів випускання. Для того, щоб виділити випромінювання окремих іонів, застосовують спеціальні світлофільтри, після чого проводять всі необхідні вимірювання. Полум'яну фотометрію застосовують в основному для визначення концентрації іонів калію і натрію. Для збудження цих іонів достатньо енергії низькотемпературного полум'я згорання метану в повітрі. Істотним недоліком методу є складність в забезпеченні умов безпечної експлуатації газового устаткування, яке використовується при полум'яній фотометрії. В сучасному лабораторному устаткуванні на зміну полум'яній фотометрії приходять безгазові методи досліджень концентрації електролітів. Наприклад, іоноселективні, потенціометричні методи.
Устаткування для проведення сучасних біохімічних
досліджень і основні правила його використання
ПРАВИЛА ПРОВЕДЕННЯ ФОТОМЕТРІЇ І РОЗРАХУНОК РЕЗУЛЬТАТІВ ДОСЛІДЖЕНЬ. У роботі з фотометричною апаратурою будь-якого типу слід суворо дотримуватися умов вимірювань, які рекомендуються методикою дослідження. Таких умов, як правило, три: товщина робочого шару фотометричної кювети, довжина світлової хвилі і спосіб розрахунку результатів досліджень.
Колориметр фотоелектричний концентраційний КФК-2. Призначений для вимірювань в діапазоні довжини хвиль від 315 до 980 нм, які виділяються за допомогою 11 світлофільтрів. Межі вимірювання оптичної щільності від "0" до "2,0". Відносна похибка вимірювань є мінімальною при значенні оптичної щільності 0,4. Джерело випромінювання — галогенова лампа. Прилад укомплектований набором фотометричних кювет.
Колориметр фотоелектричний концентраційний КФК-2МП. Призначення і основні технічні характеристики аналогічні приведеним для КФК-2. Особливістю конструкції даного приладу є мікропроцесорна система (МПС), яка розширює його експлуатаційні можливості. На передній панелі МПС розташовані клавіатура, цифрове табло і 2 сигнальних світлодіоди. Клавіатура складається з 24 клавіш, призначених для оперативного управління фотометрією. Зовнішній вигляд приладу представлений на рис. 3.

 1
1
.
2
3
4
5
6






Рис. 3. Колориметр фотоелектричний концентраційний КФК-2: 1 – шкала вимірювань; 2 – кришка робочої камери, 3 – важіль управління столиком утримувача кювет; 4 – світловий індикатор, 5 – ручка перемикача світлофільтрів; 6 – ручки управління чутливістю світлоприймача.
Тепер розглянемо правила експлуатації спектрофотометрів.
Спектрофотометр СФ-46 призначається для вимірювання коефіцієнта пропускання і оптичної щільності рідких і твердих середовищ в спектральній області від 186 до 1100 нм. Діапазон вимірювання оптичної щільності від 0 до 2,0. Головними елементами пристрою спектрофотометра є:
1) джерело світла — дейтерієва лампа для роботи в області спектру від 186 до 350 нм і лампа розжарювання для роботи в області спектру від 340 до 1100 нм.
2) диспергуюча призма з кварцового скла для отримання монохроматичного променя світла.
3) світлоприймач, який складається з двох фотоелементів, — сурм'яно-цезієвого, який застосовується для вимірювань в області спектру від 186 до 650 нм, і кисневоцезієвого, який забезпечує вимірювання в межах від 600 до 1100 нм. Електросхема апарату розрахована на живлення від електромережі з напругою 220 В. Зовнішній вигляд спектрофотометра представлений на рис. 4.

Рис. 4. Спектрофотометр СФ-46.
рН-МЕТРІЯ. Умовним позначенням рН виражають водневий показник, який є негативним десятковим логарифмом концентрації водневих іонів. Концентрацією водневих іонів визначається активна реакція середовища — кисла, лужна або нейтральна. В якості показника нейтральної реакції середовища прийнятий рН хімічно чистої води, в якій концентрація водневих іонів рівна концентрації гідроксильних іонів. Це обумовлено характером дисоціації молекул води. Встановлено, що в 1 л води на кожний вид іонів окремо [Н+] і [ОН-] припадає по 1·10-7 моль/іонів [12].
Якщо рН = 7 – нейтральна реакція середовища, то рН > 7 позначатиме лужну реакцію, оскільки концентрація водневих іонів в цьому випадку менша, а рН < 7 відповідатиме кислій реакції у зв'язку з переважанням концентрації водневих іонів над іонами гідроксилу. З математичної характеристики величини рН виходить, що зміна рН на одиницю відповідає зміні концентрації водневих іонів в 10 разів.
Визначення рН середовища має важливе практичне значення, по-перше, як один з показників гомеостазу — постійності внутрішнього середовища організму. По-друге, рН має значення при виконанні біохімічного аналізу цілого ряду компонентів живого організму. Наприклад, ферментів, біологічна активність яких безпосередньо залежить від величини рН.
Найточнішим методом визначення величини рН є метод потенціометрії, в основі якого є вимірювання електрорушійної сили елементу. Він складається з електроду порівняння (каломельного, хлорсрібного, водневого) з відомим потенціалом і вимірювального електроду (скляного), потенціал якого визначається концентрацією водневих іонів в досліджуваному середовищі.
УНІВЕРСАЛЬНИЙ ІОНОМЕР рН-340. Призначений для вимірювання концентрації іонів водню (рН) і інших одно- і двовалентних іонів у водних розчинах з відповідними іонселективними електродами. Може застосовуватися для вимірювання окисно-відновних потенціалів в розчинах. У клінічних лабораторіях прилад, головним чином, використовується для вимірювання рН.
Діапазон вимірювання рН від "0" до "14". Межа основної похибки, що припускається при вимірюванні рН, складає ±0,05. Межі температурної компенсації приладу від 0 до 100° С.
Принцип роботи іономеру заснований на методі потенціометра вимірювання рН.
Іономер складається з перетворювача і системи електродів (рис. 3). На лицьовій стороні перетворювача розташовуються органи оперативного управління і показуючий прилад. На шкалі показуючого приладу є наступні цифрові позначення:
"0÷14" для вимірювання в широкому діапазоні і "0÷5" для вимірювання рН у вузьких діапазонах, окрему оцифровку має діапазон "0÷4". Для встановлення температури вимірюваного розчину є оцифровка "0÷100".
До органів оперативного управління відносяться: тумблер "Мережа", ручки змінних резисторів "Калібрування" і "Крутизна", "рХ" і "Температура розчину"; кнопки вибору роду роботи "Аніони/Катіони (+/-)", "рХ" і "Т"; кнопки вибору діапазону вимірювання: "0÷14", "0÷4", "4÷9", "9÷14"; коректор показуючого приладу.
Система електродів складається з вимірювального і допоміжного електродів. Фіксується в штативі, який складається з основи і вертикального стрижня. На стрижні встановлюються два кронштейни — один для утримувача електродів і термокомпенсатора, другий — рухомий, із столиком для ємності з вимірюваним розчином. Зовнішній вигляд приладу зображений на рис. 5.

Рис. 5. Універсальний іономер рН-340.
АВТОМАТИЧНІ АНАЛІЗАТОРИ рН/іономери. Сучасні рН-метри й іономери, апарати нового покоління, мають нові конструктивні рішення — оснащені мікропроцесорною технікою, автоматичне калібрування, автоматичне розпізнавання стабільного показника з цифровою індикацією на рідкокристалічному дисплеї (рис. 6).

Рис. 6. OMNI Modular System
Стаціонарний прилад OMNI Modular System оснащений мікропроцесорною технікою, яка забезпечує діалоговий режим роботи з користувачем, зберігає в пам'яті параметри калібрування, попереджає про операторські помилки. Має режим автоматичної температурної корекції. При комплектації відповідними іонселективними електродами дозволяє виконувати визначення у водних розчинах і біологічних рідинах вмісту іонів Na+, К+, Са2+ і парціальний тиск кисню і вуглекислого газу (PO2, РСО2), а потім розрахувати показники кислотно-основного стану.
