
- •Вопрос 1. Место биологии в системе медицинского образования.
- •Вопрос 2. Диалектико-материалистическое определение сущности жизни. Качественные особенности обмена веществ.
- •Вопрос 3. История биологических мировоззрений. Выдающиеся ученые-биологи, внесшие вклад в развитие медицинской науки.
- •Вопрос 4. Клеточная теория. Ее естественнонаучное и мировоззренческое значение.
- •Вопрос 5. Гетеротрофная ассимиляция.
- •Вопрос 6. Физико-химические свойства живого. Паранекроз.
- •Вопрос 7. Клеточный цикл. Его периодизация.
- •Вопрос 8. Гаметогенез.
- •Вопрос 9. Строение и функции хромосом.
- •Вопрос 10. Биологическая сущность диссимиляции.
- •13. Биохимическая сущность фотосинтеза и космическая роль зелёных растений (к.А.Тимирязев)
- •14. Общность и различия фотосинтеза и дыхания
- •Вопрос 27
- •Вопрос 28
14. Общность и различия фотосинтеза и дыхания
Фотосинтез - процесс образования органических веществ из неорганических в зеленых частях растений, на свету.
А дыхание - это процесс расщепления веществ из кислорода.
-
Сходства
Различия
1.Фотосинтез в световой фазе и дыхание идут с образованием АТФ.
2.Аналогичные переносчики водорода.
3.Процессы идут в органоидах‚ имеющих двумембранную структуру.
Фотосинтез
1.Источником энергии при образовании АТФ является свет.
2.Энергия АТФ идет на синтез органических веществ.
3.Поглощается СО2 и выделяется в атмосферу О2.
Дыхание
1.Источником энергии при синтезе АТФ служат органические вещества.
2.Энергия АТФ обеспечивает жизнедеятельность клетки и дает тепло.
3.Поглощается О2 и выделяется в атмосферу СО2
15)Химические превращения веществ в организме являются частью сложнейшего процесса, называемого обменом веществ. Из окружающей среды человек получав питательные вещества, воду, минеральные соли и витамины. В окружающую среду он выделяет углекислый газ, некоторое количество влаги, минеральных солей, рганических веществ. В процессе обмена веществ человек получает энергию, аккумулированную в продуктах животного и растительного происхождения, и отдает тепловую энергию в окружающее пространство. Так постоянно происходит обмен веществ и энергии с окружающей средой, посредством которого человек включается в общий круговорот веществ в природе. Обмен веществами между организмом и окружающей средой — необходимое условие существования живых организмов. Усвоение, накопление веществ и энергии называется ассимиляцией. В ходе ассимиляции питательных и других веществ образуются белки, жиры, гликоген, строятся новые клетки. Образовавшиеся в процессе ассимиляции вещества подвергаются сложным химическим изменениям и при этом высвобождается энергия. Этот процесс называется диссимиляцией. Химические реакции, высвобождающие энергию, осуществляются в митохондриях клеток. Процессы ассимиляции и диссимиляции не только протекают одновременно. Энергия, необходимая для переваривания пищи, переноса питательных веществ и их накопления (ассимиляции), образуется в результате диссимиляции. Значит, ассимиляция зависит от диссимиляции и тесно связана с ней. Ассимиляция и диссимиляция — единый процесс, протекающий постоянно в клетках и во всем организм процесс обмена веществ и энергии. Обмен веществ с окружающей средой является не только условием существования организмов, но и их основным, отличительным свойством. Ф. Энгельс писал: «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка» Процессы обмена веществ полностью подчиняются закону сохранения массы и энергии. Специально постав ленные с этой целью исследования показали, что количество энергии, образованной в организме, равно запасу потенциальной энергии, полученной вместе с пищей. Вес поступающих в организм и выделяющихся из него веществ одинаков. Но необходимо учитывать прибавку или потерю веса. 16). Гетеротрофная ассимиляция. А) Фазы ассимиляции: 1)Поглощение и переваривание питательных веществ. 2)Транспорт веществ в клетку. Поступление веществ происходит через мембрану. 3)Синтез веществ в клетке. Белки будучи ферментами контролируют синтез углеводов, липидов и самих себя.
17) Диссимиляция (энергетический обмен) у гетеротрофных (аэробных) организмов складывается из трех этапов:
1. подготовительного, который проходит в желудочно-кишечном тракте или в клетке под действием ферментов лизосом. Во время этого этапа происходит распад всех биополимеров до мономеров: белки распадаются сначала до пептидов, затем - до аминокислот; жиры — до глицерина и жирных кислот; углеводы — до моносахаридов (до глюкозы и ее изомеров).
2. бескислородного (или анаэробного), который проходит в матриксе цитоплазмы. Этот этап называют гликолизом. Под действием ферментов глюкоза расщепляется до двух молекул ПВК. При этом выделяется 4 атома Н, которые акцептируются веществом под названием НАД+ (никотинамид-аденин-динуклеотид). При этом НАД+ восстанавливается в НАД*Н (эта запасенная энергия в дальнейшем будет использоваться для синтеза АТФ). В результате образуется 2 молекулы АТФ.
3. кислородного, который проходит в митохондриях. Две молекулы ПВК поступают на ферментативный кольцевой «конвейер», который называют циклом Кребса или циклом трикарбоновых кислот. Все ферменты этого цикла находятся в митохондриях. В результате образуются 36 молекул АТФ.
18) Гликолиз — путь ферментативного расщепления глюкозы — является общим практически для всех живых организмов процессом. У аэробов он предшествует собственно клеточному дыханию, у анаэробов завершается брожением. Сам по себе гликолиз является полностью анаэробным процессом и для осуществления не требует присутствия кислорода.
Первый его этап протекает с расходом энергии 2 молекул АТФ и включает в себя расщепление молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся субстратным фосфорилированием, то есть присоединением к молекуле остатка фосфорной кислоты и формированием в ней макроэргической связи, после которого остаток переносится на АДФ с образованием АТФ. Таким образом, уравнение гликолиза имеет следующий вид:
Глюкоза + 2НАД+ + 4АДФ + 2АТФ + 2Фн = 2ПВК + 2НАД∙Н + 2 АДФ + 4АТФ + 2H2O + 4Н+.
Сократив АТФ и АДФ из левой и правой частей уравнения реакции, получим:
Глюкоза + 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ + 2H2O + 4Н+.
Тканевое(клеточное) дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов, в ходе которых происходит окисление углеводов, липидов и аминокислот до углекислого газа и воды. Высвобожденная энергия запасается в химических связях макроэргических соединений (АТФ и др.) и может быть использована по мере необходимости. Входит в группу процессов катаболизма. О физиологических процессах транспортировки к клеткам многоклеточных организмов кислорода и удалению от них углекислого газа.
19
Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры иуглеводы. Процесс окислительного фосфорилирования проходит на кристах митохондрий.
Однако чаще всего в качестве субстрата используются углеводы. Так, клетки головного мозга не способны использовать для питания никакой другой субстрат, кроме углеводов.
Предварительно сложные углеводы расщепляются до простых, вплоть до образования глюкозы. Глюкоза является универсальным субстратом в процессе клеточного дыхания. Окисление глюкозы подразделяется на 3 этапа:
гликолиз;
окислительное декарбоксилирование и цикл Кребса;
окислительное фосфорилирование.
При этом гликолиз является общей фазой для аэробного и анаэробного дыхания.
Работа АТФ-синтазы
Процесс окислительного фосфорилирования осуществляется пятым комплексом дыхательной цепи митохондрий — Протонная АТФ-синтаза, состоящая из 9 субъединиц 5 типов:
3 субъединицы (γ,δ,ε) способствуют целостности АТФ-синтазы
β субъединица является основной функциональной единицей. Она имеет 3 конформации:
L-конформация — присоединяет АДФ и Фосфат (поступают в митохондрию из цитоплазмы с помощью специальных переносчиков)
Т-конформация — к АДФ присоединяется фосфат и образуется АТФ
О-конформация — АТФ отщепляется от β-субъединицы и переходит на α-субъединицу.
Для того, чтобы субъединица изменила конформацию необходим протон водорода, так как конформация меняется 3 раза необходимо 3 протона водорода. Протоны перекачиваются из межмембранного пространства митохондрии под действием электрохимического потенциала.
α-субъединица транспортирует АТФ к мембранному переносчику, который «выбрасывает» АТФ в цитоплазму. Взамен из цитоплазмы этот же переносчик транспортирует АДФ. На внутренней мембране митохондрий также находится переносчик Фосфата из цитоплазмы в митохондрию, но для его работы необходим протон водорода. Такие переносчики называются транслоказами.
Суммарный выход
Для синтеза 1 молекулы АТФ необходимо 3 протона.
Ингибиторы окислительного фосфорилирования[
Ингибиторы блокируют V комплекс:
Олигомицин — блокируют протонные каналы АТФ-синтазы.
Атрактилозид, циклофиллин — блокируют транслоказы.
Разобщители окислительного фосфорилирования
Разобщители — липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс(его протонный канал). Разобщители:
Естественные — продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов.
Искусственные — динитрофенол, эфир, производные витамина К, анестетики.
Свободная энергия (общая работа, изотермическая полезная работа) - это энергия, способная производить работу. Для обозначения свободной энергии пользуются символом G в честь физика XIX века Дж. Уиларда Гиббса, введшего это понятие. Чаще всего под свободной энергией понимают свободную энергию Гиббса, хотя есть еще понятие свободной энергии Гельмгольца, обозначаемой символом A. В области биологии и физической химии более применима свободная энергия Гиббса. По определению
G = H -TS, где H - энтальпия системы, S - ее энтропия, T - температура. Приращение свободной энергии при постоянной температуре
ΔG = ΔH - TΔS.
В биологических системах обычно постоянны и давление, и объем, так что ΔH = ΔE, где E - внутренняя энергия системы. Определенная таким образом свободная энергия является функцией, которую можно использовать для вычислений в биологических системах при постоянной температуре и постоянном давлении, поскольку в этих условиях она обладает свойством потенциала. Общее правило для таких систем таково: Если ΔG равно отрицательной величине, то реакция может протекать самопроизвольно; Если ΔG равно положительной величине, то реакция не может протекать самопроизвольно; Если ΔG равно нулю, то система находится в равновесии и не может ни приобретать, ни терять свободную энергию.
Для процесса образования химической связи очевидно, что чем прочнее данная связь, другими словами, чем большим изменением свободной энергии сопровождается ее образование, тем большее число атомов в системе находится в связанном состоянии. Это выражается количественно в следующем виде:
ΔG = -RT ln Keq, где R - универсальная газовая постоянная, T - абсолютная температура, Keq - константа равновесия, ln Keq - логарифм константы равновесия по основанию e (e ≈2,718)
Лихорадка — это терморегуляторное повышение температуры тела, которое представляет собой организованный и координированный ответ организма на болезнь или иное повреждение. При лихорадке сохраняется терморегуляция, а установочная точка температурного гомеостаза смещена на более высокий уровень и поэтому нормальная температура воспринимается гипоталямусом как «холод», а повышенная — как «нормальная».
Гипертермия — повышение температуры тела вследствие нарушения терморегуляции без перестройки температурного гомеостаза (например — перегревание).Регуляция температуры тела, в основном, осуществляется центром терморегуляции, который находится в преоптической области передней части гипоталямуса около дна третьего желудочка. Центр терморегуляции состоит из термочувствительной области (термостат), термоустановочной области (установочная точка) и двух эффекторных областей (теплопродукции и теплоотдачи). Термостат (отдел мозга) регистрирует температуру артериальной крови, протекающей через мозг, получает импульсы с периферических областей (кожи, тканей, спинного мозга) и в итоге определяет среднюю температуру «ядра». Эти данные термостат передает на установочную точку (конгломерат нейронов), которая и определяет температуру тела через центры теплопродукции или теплоотдачи. Если температура тела ниже желаемой, то установочная точка активизирует центр теплопродукции и подавляет центр теплоотдачи.
У человека температура тела в обычных условиях поддерживается на уровне 37°С.+1,5°С. Верхняя летальная температура внутренних органов, крови и мозга равна +43°С., а нижняя +23°С. Температура тела максимально падает к 3 часам ночи, затем постепенно возрастает к 17-18 часам. Циркадный ритм отсутствует у новорожденных и детей раннего возраста. Колебания температуры крови и внутренних органов на +2-2,5°С. от нормального уровня вызывают нарушения физиологических функций детского организма. Причины лихорадки:
1 .Инфекционные заболевания бактериальной, вирусной, микоплазменной, хламидийной, паразитарной, грибковой этиологии.
2.Заболевания центральной нервной системы — перинатальные поражения ЦНС, кровоизлияние, опухоль, травма, отек мозга, дефекты развития. 3.Эндокринные и нейроэндокринные заболевания — феохромоцитома, гипертиреоз.
Функциональные нарушения высшей нервной деятельности — нервно- психические расстройства, эмоциональное напряжение, воздействие гипноза.
Интраабдоминальные заболевания — кишечная непроходимость, инвагинация, аппендицит, перитонит, панкреатит, холецистит, гепатит.
Диффузные болезни соединительной ткани, аллергические и заболевания крови.
Метаболические заболевания.
Причины гипертермии: тепловой, солнечный удар, чрезмерная физическая активность, чрезмерное укутывание, отравление атропином, ожоги, укусы змеи.
Типы лихорадки:
интермиттирующая — febris intermittens (температура нормализуется один или несколько раз в день),
ремиттирующая — febris remittens (температура колеблется, но не возвращается к норме),
постоянная — febris continua (температура постоянно увеличена с небольшими колебаниями),
возвратная — febris reccurens (безлихорадочные периоды длительностью один и более дней между приступами лихорадки).
По степени повышения температуры тела выделяют:
субфебрильная — до 38,0°С.,
умеренная фебрильная -38,1°-39,0°С.,
высокая фебрильная — 39,1°С. и выше,
гиперпирексическая — выше 41,0°С.
В зависимости от продолжительности лихорадочного периода различают:
эфемерная — от нескольких часов до нескольких дней,
острая — до 15 дней,
подострая — до 45 дней,
хроническая — свыше 45 дней.
«Розовая» лихорадка — теплоотдача соответствует теплопродукции, поведение и самочувствие ребенка не страдают, кожный покров гиперемирован, потоотделение умеренное, одышка незначительная, сердечные сокращения учащены на 10 ударов на каждый градус повышения температуры, конечности теплые.
«Бледная» лихорадка — теплоотдача из-за существенного нарушения периферического кровообращения неадекватна теплопродукции, гиперкатехоламинемия приводит к централизации кровообращения, проявляющееся бледностью кожного покрова, его сухостью и мраморностью; конечности на ощупь холодные, тахикардия, систолическое артериальное давление повышается, разница между подмышечной и ректальной температуры до 1,0 град. С и выше, самочувствие ребенка страдает — озноб, возбуждение, судорожная готовность и судороги.
Биологическое значение лихорадки: возрастает естественная
реактивность организма, увеличивается фагоцитарная активность клеток крови, синтез интерферона, антителообразование; подавляется размножение многих микроорганизмов (кокков, вирусов и др.). Лихорадка неблагоприятно влияет на метаболические процессы (увеличивает скорость основного обмена, потребность в кислороде, калориях, жидкости), на сердце и легкие, на ЦНС (бред, дезориентация, галлюцинации), вызывает церебральную вазоконстрикцию и снижение мозгового кровотока, угнетает моторику желудка.
20
Митохо́ндрия (от mitos — нить и [chovbros — зёрнышко, крупинка) — двумембранная гранулярная или нитевидная органелла толщиной около 0,5 мкм. Характерна для большинства эукариотических клеток как автотрофов(фотосинтезирующие растения), так и гетеротрофов (грибы, животные). Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии в синтезе молекул АТФ, который происходит за счёт движения электрона по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так,одноклеточные зелёные водоросли (эвглена, хлорелла, политомелла) и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют.
Содержание
Происхождение митохондрий
Основная статья: Симбиогенез
В соответствии с теорией симбиогенеза, митохондрии появились в результате захвата примитивными клетками (прокариотами) бактерий. Клетки, которые не могли сами использовать кислород для генерации энергии, имели серьёзные ограничения в возможностях развития;бактерии же (прогеноты) могли это делать. В процессе развития таких отношений прогеноты передали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру теперь уже эукариот.[1] Вот почему современные митохондрии больше не являются самостоятельными организмами. Хотя их геном кодирует компоненты собственной системы синтеза белка, многие ферменты и белки, необходимые для их функционирования, кодируются хромосомами, синтезируются в клетке и только потом транспортируются в органеллы.
Митохондрии в клетке
Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. Число митохондрий в клетке непостоянно. Их особенно много в клетках, в которых потребность в кислороде велика. По своему строению они представляют собой цилиндрические органеллы, встречающиеся в эукариотической клетке в количестве от нескольких сот до 1—2 тысяч и занимающие 10—20 % её внутреннего объёма. Сильно варьируют так же размеры (от 1 до 70 мкм) и форма митохондрий. При этом ширина этих органелл относительно постоянна (0,5—1 мкм). Способны изменять форму. В зависимости от того, в каких участках клетки в каждый конкретный момент происходит повышенное потребление энергии, митохондрии способны перемещаться по цитоплазме в зоны наибольшего энергопотребления, используя для движения структуры цитоскелета эукариотической клетки.
Альтернативой множеству разрозненных небольших митохондрий, функционирующих независимо друг от друга и снабжающих АТФ небольшие участки цитоплазмы, является существование длинных и разветвлённых митохондрий, каждая из которых может энергетически обеспечивать отдалённые друг от друга участки клетки (например, у одноклеточных зелёных водорослей Chlorella). Вариантом такой протяжённой системы может также являться упорядоченное пространственное объединение множества митохондрий (хондриом или митохондрион), обеспечивающее их кооперативную работу и встречающееся как у одноклеточных, так и у многоклеточных организмов. Особенно сложно этот тип хондриома устроен в скелетных мышцах млекопитающих, где группы гигантских разветвлённых митохондрий связаны друг с другом с помощью межмитохондриальных контактов (ММК). Последние образованы плотно прилегающими друг к другу наружными митохондриальными мембранами, в результате чего межмембранное пространство в этой зоне имеет повышеннуюэлектронную плотность. Особенно обильно ММК представлены в клетках сердечных мышц, где они связывают множественные отдельные митохондрии в согласованную работающую кооперативную систему.
Структура митохондрий
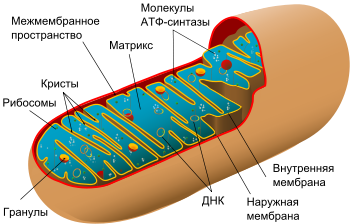
![]()
Схема строения митохондрии
Наружная мембрана
Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментамидыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс[править | править исходный текст]
Матрикс — ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата, жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
Митохондриальная ДНК
Основная статья: Митохондриальная ДНК
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондриального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть транспортных РНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ТАТ вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны ТСТ и ТСС, обычно кодирующие аргинин, являются стоп-кодонами, а кодон АСТ, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то, по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четырекодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70S-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
Митохондриальные белки[править | править исходный текст]
Количество транслируемых с митохондриальной мРНК белков, формирующих субъединицы крупных ферментных комплексов, ограничено. Значительная часть белков кодируется в ядре и синтезируется на цитоплазматических 80S-рибосомах. В частности, так образуются некоторые белки — переносчики электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также факторы, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. При этом подобные белки на своём N-конце имеют особые сигнальные пептиды, размер которых варьирует от 12 до 80 аминокислотных остатков. Данные участки формируют амфифильные завитки, обеспечивают специфический контакт белков со связывающими доменами митохондриальных распознающих рецепторов, локализованных на наружной мембране. До наружной мембраны митохондрии данные белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны в местах их контактов поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения, которые подхватывают пересекающий мембраны белок, способствуют его втягиванию в митохондрию, а также контролируют процесс правильного сворачивания полипептидной цепи. Большинство шаперонов обладает АТФазной активностью, в результате чего как транспорт белков в митохондрию, так и образование их функционально активных форм являются энергозависимыми процессами.
Функции митохондрий и энергообразование
Основной функцией митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента (англ.)русск. протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН;
Перенос электронов с НАДН на кислород по дыхательной цепи;
Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно так же жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацетил-СоА-производных.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие укорочение углеводородной цепи на два атома углерода, которые в дальнейшем превращаются в СО2. Этот процесс обеспечивает образование одной молекулы ГТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
Большой олигомерный фермент, катализирующий перенос электронов;
Небелковые органические (простетические) группы, принимающие и высвобождающие электроны;
Белки, обеспечивающие движение электронов.
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13 кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего из 16-26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (Фл — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (QH2).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде особого вида — электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (bc1). Последний представляет собой димер из субъединиц b и c1 с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в серных ячейках, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию восстановления убихинола до убихинона с передачей электронов на атом железа второй молекулы переносчика (находящегося в межмембранном пространстве цитохрома c). Отщепляющиеся при этом от убихинола два протона водородаосвобождаются в межмембранное пространство, продолжая формирование электрохимического градиента. Наконец, ещё два протона водорода переносятся в межмембранное пространство митохондрии за счёт энергии электронов, проходящих по простетических группам комплекса III.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
АТФ-синтаза
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F0, а другой обеспечивает их выход в матрикс митохондрии;
Кольцо из субъединиц c, каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H+ из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с, обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с.
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
Митохондрии и наследственность
Митохондриальные заболевания
ДНК митохондрий наследуются почти исключительно по материнской линии. Каждая митохондрия имеет несколько участков нуклеотидов в ДНК, идентичных во всех митохондриях (то есть в клетке много копий митохондриальных ДНК), что очень важно для митохондрий, неспособных восстанавливать ДНК от повреждений (наблюдается высокая частота мутаций). Мутации в митохондриальной ДНК являются причиной целого ряда наследственных заболеваний человека.
21) Организм как открытая саморегулирующаяся система. Жизнедеятельность организма как открытой системы обеспечивается различными процессами, образующими три потока: поток информации; поток вещества; поток энергии. Поток информации особенно развит у птиц и млекопитающих, в т.ч. и человека, а у остальных животных не столь важен, потому основополагающими факторами являются именно обмен веществом и энергией. Обмен в-вом и энергией делят на два различных, но взаимодополняющих процесса: анаболизм (ассимиляция, пластический обмен) и катаболизм (диссимиляция, энергитический обмен). Итак, организм является открытой системой, т.к. обменивается с окружающей средой веществом и энергией. Другим важным свойством живого организма является саморегуляция. Постоянство внутренней среды организма (т.е. постоянство количества и соотношения вещества) называется гомеостазом. Поддержание этого постоянства называется гомеокинезом.
22) Гомеостаз и гомеокинез. Гомеостаз - способность живых организмов сохранять относительное динамическое постоянство состава и свойств внутренней среды и устойчивость основных физиологических функций в условиях изменяющейся внешней среды. Основой гомеостаза является свойство живого организма реагировать на изменение среды и, если необходимо, противостоять ему. Существует несколько способов, которыми гомеостаз воздействует на системы органов и организм в целом. Это может быть воздействие с помощью гормонов, нервной системы, выделительных или нейро-гуморальных систем организма. Изменение гомеостаза может происходить под влиянием каких-либо внешних факторов, а также иметь эндогенное происхождение: интенсификация процессов метаболизма стремится изменить параметры гомеостаза. Процесс изменения функций организма, направленный на восстановление гомеостаза, называется гомеокинезом. Причём каждому организму присущи свои индивидуальные возможности гомеокинеза, а соответственно - гомеостаза, а значит, от них (возможностей) зависит продолжительность жизни. Необходимо также упомянуть такое понятие, как гомеостатические константы. Это параметры организма, которые находятся на относительно постоянном уровне; эта относительность ограничена "коридором". К примеру, pH крови человека в среднем - 7,4. Но коридором для параметра pH будет 7-7,8. При длительном нахождении на пороге коридора, а также при резком выходе (даже непродолжительном) за его пределы возможны пагубные последствия для организма.
23)Нукдеиновая кислота представляет собой гигантскую полимерную молекулу, построенную из многочисленных повторяющихся мономерных звеньев, называемых нуклеотидами. Нуклеотид состоит из азотистого основания, сахара и остатка фосфорной кислоты. Углеводным компонентом РНК является рибоза, а ДНК — дезоксирибоза. Азотистые основания представляют собой производные одного из двух классов соединений — пуринового или пиримидинового ряда (рис. IV.З). В нуклеиновых кислотах присутствуют два производных пурина — аденин (обозначаемый А) и гуанин (Г) и три производных пиримидина — цитозин (Ц), тимин (Т) и урацил (У). В состав ДНК входят аденин, гуанин, цитозин и тимин. В структуре РНК тимин заменен другим пиримидином — урацилом.
24)Молекулу ДИК, в большинстве случаев, образуют две полису клеотидные цепи, закрученные одна относительно другой в двойную правовитковую спираль таким образом, что остатки фосфорной кислоты и дезоксирибозы располагаются снаружи, а азотистые основания — внутри спирали. Эту модель строения ДНК впервые предложили в 1953 г. американский биохимик Д. Уотсон и английский биофизик и генетик Ф. Крик. Еще в 1951 г. американский биохимик Э. Чаргафф установил, что в ДНК различного происхождения содержится равное число молей аденина и тимина, а также гуанина и цитозина. Он сформулировал правило, согласно которому в молекуле двуспиральной ДНК сумма пуриновых оснований равна сумме пиримидиновых. Это позволило Д. Уотсону и Ф. Крику предположить, что в одной цепи ДНК записан план построения ее второй цепи. При этом азотистые основания обеих цепей связываются между собой водородными связями. Азотистые основания образуют пары в точном соответствии с правилом Э. Чаргаффа: аденин связывается с тимином двумя водородными связями, а гуанин с цитозином — тремя. Это свойство получило название комплементарности азотистых оснований (лат. complementum" — дополнение). Аденин комплементарен тимину, а гуанин — цитозину. Полинуклеотидные цепи ДНК антипараллельны. Установлены параметры двойной спирали ДНК. Ее диаметр составляет 2 нм, а длина одного витка одной нити ДНК — 3,4 нм. Число нуклеотидов в одном витке одной нити спирали равно 10.
