
- •1.2. Основные этапы развития лекарствоведения
- •1.3. Краткая история отечественного лекарствоведения
- •1.4. Методы исследования, применяемые в фармакологии
- •1.5. Пути получения новых лекарственных веществ
- •2. Общая фармакология
- •2.1. Пути введения лекарственных веществ в организм
- •2.2. Фармакокинетика
- •2.2.1. Резорбция лекарственных веществ
- •2.2.2. Распределение лекарственных веществ в организме
- •2.2.3. Биотрансформация лекарственных веществ
- •2.2.4. Пути выведения лекарственных веществ из организма
- •2.3. Фармакодинамика и факторы, влияющие на нее
- •2.3.1. Влияние химической структуры лекарственного вещества на его фармакодинамику
- •2.3.2. Доза и принципы дозирования
- •2.3.3. Лекарственная форма и ее значение в проявлении фармакодинамики
- •2.3.5. Фармакодинамические эффекты при одновременном введении двух и более лекарственных веществ
- •2.3.6. Отрицательные фармакодинамические эффекты при повторных введениях лекарственных веществ
- •2.3.7. Виды действия лекарственных веществ
- •2.4. Механизм действия лекарственных веществ
- •2.5. Положительное и отрицательное действие лекарственных веществ
- •2.6. Взаимосвязь между фармакодинамическим и фармакотерапевтическим комплексом эффектов лекарственных веществ
- •2.7. Общие принципы лечения при отравлении лекарственными веществами
- •2.8. Классификация лекарственных веществ
2.2.2. Распределение лекарственных веществ в организме
После резорбции лекарственное вещество разносится в различные ткани и органы током крови.
Все лекарственные вещества в организме животных распределяются неравномерно. Под неравномерным распределением понимается разная концентрация лекарственного вещества в 1 г (1 мл) органа или биологической жидкости. Кроме того, достижение лекарственным веществом концентрации, обеспечивающей выраженные изменения в метаболизме и функции, происходит разновременно в различных органах и тканях.
Неравномерность распределения и разновременность наступления фармакодинамических эффектов в органах и системах объясняются:
наличием гистогематических барьеров на пути проникновения фармакологических веществ в особо ответственные органы и системы;
существованием комплементарности между структурой молекул лекарственных веществ и макромолекулами (рецепторами) биологических мембран (плазматических, органоидных) и цитозоли;
детерминантой [от лат. determinans (determinantis) — определяющий] биологических мембран по дифференцированной резорбции лекарственных средств;
наличием существенных различий в морфофункционном состоянии и уровне кровоснабжения органов и других факторов.
Существование гематоэнцефалического барьера между кровью
и центральной нервной системой, плацентарного — между плацентой и кровью матери, офтальмического — между сосудистой оболочкой и внутриглазной жидкостью и тестикулярного — между эпителием и кровью, а также между секреторным эпителием цилиарной мышцы и внутриглазной жидкостью делает невозможным проникновение в эти системы ряда фармакологических веществ в негативно действующих концентрациях, тогда как большинство из лекарств преодолевает эти барьеры в небольших количествах. Однако с повышением концентрации лекарственного вещества в крови степень проникновения его через гистогематические барьеры увеличивается. Проникновение химиотерапевтических веществ резко повышается при развитии воспалительных процессов по ходу гистогематических барьеров.
Например, бензилпенициллин проходит через гистогематические барьеры в небольших количествах, а потому его концентрация в центральной нервной системе очень часто не выявляется широко применяемыми в настоящее время микробиологическими методами, т. е. бензилпенициллин находится в концентрациях, не обеспечивающих подавление жизнедеятельности даже чувствительных штаммов микробов. В отличие от гематоэнцефалического пенициллины и тетрациклины хорошо проникают через плацентарный и тестикулярный барьеры. При наличии воспалительных процессов в гематоэнцефалическом барьере и повышении концентрации в крови бензилпенициллина за счет увеличения доз концентрация его в нервной ткани значительно возрастает, что увеличивает силу непосредственного действия на нейроны. Аналогичным образом изменяется функционирование и других гистогематических барьеров.
Многие лекарственные вещества очень плохо проникают через серозные оболочки в синовиальные полости: суставные, сухожильные влагалища и бурсы, тогда как в перитониальную, плевральную, перикардиальную диффундируют лучше.
Слизистая оболочка желудочно-кишечного тракта в отношении некоторых лекарственных веществ имеет феномен селективности. Так, аминогликозиды всасываются плохо, а тетрациклины—хорошо. Из группы сульфаниламидов сульгин и фталазол плохо всасываются, а большинство соединений из этой группы — хорошо.
В очагах острого воспаления концентрация антибиотиков выше нормы, что объясняется усилением кровоснабжения в зоне воспаления с одновременной экссудацией.
При некоторых патологических состояниях существующие в норме барьеры ослабляются в результате формирования патологических барьеров за счет разроста соединительной ткани вокруг очагов воспаления, особенно некротической направленности, и Уменьшения васкуляризации патологически измененных участков тканей.
Существенную роль в неравномерном распределении лекарственных веществ играют степень кровоснабжения и интенсивность метаболизма. Чем выше уровень кровообеспечения органа, тем больше лекарственного вещества поступает с кровью, однако и степень биотрансформации в таких органах тоже выше.
Важным фактором в распределении лекарственных веществ является образование комплексов белок + молекула лекарственного вещества. Такие комплексы в большинстве своем образуются в крови, межклеточных пространствах, а также в цитоплазме, иногда в ядре. Образование комплексов фармакологическое вещество — белок у некоторых лекарственных веществ достигает 80— 90 % поступившего в кровь количества лекарства. Особенно широко этот процесс выражен у химиотерапевтических веществ (сульфаниламиды, антибиотики и др.).
Из белковых фракций крови в большей степени склонны к образованию комплексов альбумины и в меньшей — гамма-глобулины и миоглобин.
Образование комплексов ухудшает транспортировку лекарственных веществ к клеткам органов и тканей, а также трансмембранный перенос, и одновременно этот процесс лишает присоединившиеся молекулы фармакологической активности.
Как правило, связывание молекул фармакологических веществ с белками на любом уровне — процесс обратимый. После диссоциаций комплекса высвобождающиеся молекулы лекарственных веществ и белки обретают свою биологическую активность. Некоторые комплексы существуют продолжительное время, исчисляемое месяцами.
Связывание лекарственных веществ с белками уменьшает терапевтический эффект, замедляет их выведение из организма, а также их участие в процессах биотрансформации, поскольку в этих трех процессах могут участвовать только свободные молекулы.
Таким образом, лекарственные вещества во внутренней среде организма и тканях могут находиться в свободном состоянии, в комплексе с белками и в измененном в химическом отношении состоянии.
Биологические мембраны осуществляют дифференцированную диффузию (от лат. diffusio — растекание, распространение) лекарственных веществ, поэтому через каналы цитоплазматической мембраны при обычной диффузии и активном транспорте в цитоплазму проникают фармакологические вещества с размером молекулы в пределах 0,4 нм, более крупные молекулы через цито-плазматические каналы не проходят, а поэтому и образованные комплексы усиливают неравномерное распределение лекарственных веществ.
К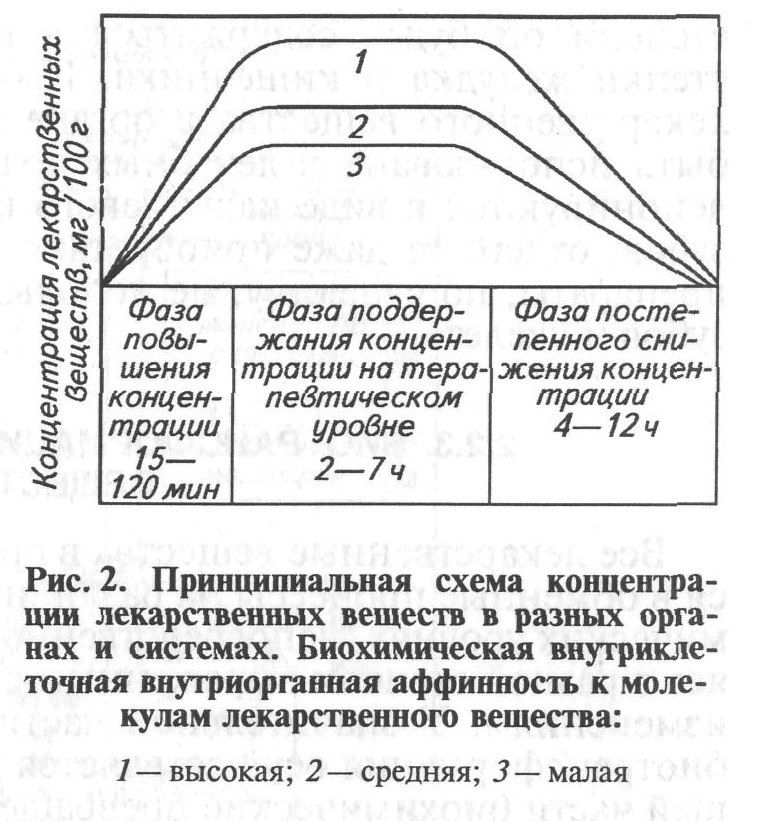 омплементарность
(от лат. complementum
— дополнение) лекарственных веществ
или наибольшее сходство в структуре
молекул лекарственного вещества с
внутриклеточными макромолекулами
(рецепторами) обеспечивает
наибольшую концентрацию
лекарственного вещества в определенном
органе или системе и наименьшую его
концентрацию
в других органах и системах,
где комплементарность между рецепторами
и лигандами выражена в меньшей степени,
что в итоге и определяет соответственно
наибольшие и наименьшие изменения
во внутриклеточном метаболизме и
неизбежно в специфических функциях
органа или системы.
омплементарность
(от лат. complementum
— дополнение) лекарственных веществ
или наибольшее сходство в структуре
молекул лекарственного вещества с
внутриклеточными макромолекулами
(рецепторами) обеспечивает
наибольшую концентрацию
лекарственного вещества в определенном
органе или системе и наименьшую его
концентрацию
в других органах и системах,
где комплементарность между рецепторами
и лигандами выражена в меньшей степени,
что в итоге и определяет соответственно
наибольшие и наименьшие изменения
во внутриклеточном метаболизме и
неизбежно в специфических функциях
органа или системы.
Комплементарность лекарственных веществ определяется размером и внутримолекулярной структурой молекул лекарственного вещества и внутримолекулярной структурой внутриклеточных макромолекул (рецепторов), а также межмолекулярными электромагнитными силами взаимодействия.
На рис. 2 схематически изображен закономерный характер развития фармакокинетики. По уровню концентрации лекарственного вещества в тканях и органах весь период фармакокинетики можно разделить на три фазы: быстрого нарастания концентрации,- поддержания концентрации на максимальном уровне и постепенного снижения уровня лекарственного вещества в организме в целом.
Первая фаза характеризуется быстрой резорбцией и нарастанием концентрации лекарственного вещества во всех органах с достижением максимального уровня в зависимости от пути введения в среднем через 15—120 мин после введения. Вторая фаза, следующая за первой, характеризуется поддержанием концентрации лекарственного вещества в максимальных пределах. Эта фаза длится в среднем 2—7 ч (максимально 6—7сут). Заключительной фазой является эффект постепенного снижения концентрации лекарственных веществ. Средняя продолжительность этого периода равна 4—12 ч (максимально до 12 сут).
Например, кофеин в наибольшем количестве концентрируется в коре головного мозга, в меньшей степени — в сердечной мышце и в еще меньшей — в скелетной мускулатуре и почках. Эфир в наибольшей концентрации накапливается в тканях, богатых липидами (ЦНС, подкожный жир, внутренний жир), а в меньшей степени он будет содержаться в продолговатом мозге, мышце стенки желудка и кишечника. Избирательность сосредоточения лекарственного вещества в органе или системе не всегда может быть использована в лечебных целях. Например, тетрациклины депонируются в виде кальциевого комплекса в костях и дентине зубов, отчего те даже приобретают желтоватый цвет, однако эти препараты, по существу, не используются для лечения патологии зубов и скелета.
