
- •Раздел 6. Титриметрические методы
- •Классификация титриметрических методов по типам химических реакций
- •6.1. Лабораторная работа № 1 Определение средней молекулярной массы смеси жирных кислот мыла
- •6.2. Лабораторная работа № 2 Определение содержания ацетатных групп в поливинилацетате
- •6.3. Лабораторная работа № 3 Определение кислотности хлебобулочных изделий
- •Кислотность различных групп хлебов и хлебобулочных изделий
- •6.4. Лабораторная работа № 4 Определение числа омыления жиров и масел
- •6.5. Лабораторная работа № 5 Определение содержания формальдегида в формалине
- •6.6 Лабораторная работа № 6 Определение содержания витамина рр в драже и таблетках
- •6.7. Лабораторная работа № 7 Определение содержания витамина с в драже и таблетках
- •Суточная потребность в витамине с и витаминные препараты
- •6.8. Лабораторная работа № 8 Определение показателей окислительной порчи жиров и масел
- •Данные для определения массы анализируемой пробы при определении
- •6.9. Лабораторная работа № 9 Определение содержания общего сахара в карамели
- •6.10. Лабораторная работа № 10 Определение окисляемости воды
- •6.11. Лабораторная работа № 11 Определение массовой доли редуцирующих сахаров в сахарной свекле по Бертрану
- •6.12. Лабораторная работа № 12 Определение общей жесткости воды
- •6.13. Лабораторная работа № 13 Определение кальция и магния в молоке
- •6.14. Вопросы для самостоятельной работы
6.12. Лабораторная работа № 12 Определение общей жесткости воды
Общая жесткость воды обусловлена суммарным содержанием гидрокарбонатов, сульфатов и хлоридов магния и кальция (ммоль/дм3). Различают временную и постоянную жесткость воды. Временная (гидрокарбонатная) жесткость обусловлена присутствием в воде легкорастворимых гидрокарбонатов магния и кальция и устраняется при кипячении:
![]()
Постоянную (некарбонатную) жесткость воды вызывают сульфаты и хлориды магния и кальция. Сумма постоянной и гидрокарбонатной жесткости составляет общую жесткость воды.
В зависимости от концентрации солей кальция и магния различают воду мягкую (общая жесткость < 2 ммоль/дм3), средней жесткости (2–10 ммоль/дм3) и жесткую (> 10 ммоль/дм3). Применение жесткой воды приводит к образованию накипи в котлах и отопительных приборах, в такой воде не развариваются овощи.
Жесткость питьевой воды не должна превышать 7,0 ммоль/дм3 [32].
1 Метод измерений
В основе определения находится реакция взаимодействия комплексона III (Трилона Б, ЭДТА) с солями магния и калия при рН 9,3–9,5 в результате которого образуются устойчивые комплексные ионы MgR2- или CaR2-. 1 см3 0,05 моль/дм3 раствора комплексона III соответствует 0,05 ммоль Mg2+ и Ca2+.
2 Средства измерений
Весы лабораторные 2-го класса точности с наибольшим пределом взвешивания 210 г;
Бюретка вместимостью 25 см3;
Колба мерная вместимостью 1 дм3;
Пипетки вместимостью 5 и 50 см3;
Цилиндр мерный вместимостью 10 см3.
3 Вспомогательные устройства
Баня водяная;
Колба коническая вместимостью 250 см3:
Стакан химический вместимостью 200–250 см3.
4 Материалы, реактивы и растворы
Аммонийный буферный раствор с рН 9,3. Смешивают равные объемы (по 100 см3) растворов хлорида аммония и аммиака с концентрацией 20% (масс.). Смесь разбавляют дистиллированной водой до метки в мерной колбе на 1 дм3;
Вода дистиллированная;
Бумага фильтровальная;
Индикаторная смесь мурексида с NaCl или KCl. 0,25 мурексида растирают в фарфоровой ступке с 1,25 г хлорида натрия (или калия) до получения однородно окрашенной смеси;
Индикаторная смесь эриохромового черного Т с NaCl (или KCl). 0,25 г индикатора растирают в фарфоровой ступке с 12,5 г хлорида натрия или калия до получения однородно окрашенной смеси;
Кальция карбонат (CaCO3), ч.д.а.;
Кальция хлорид (CaCl2), раствор – 0,05 моль/дм3. 5±0,001 г карбоната кальция помещают в химический стакан, добавляют по каплям 5–9 см3 соляной кислоты до прекращения бурного выделения CO2. В стакан помещают 100–150 см3 дистиллированной воды и нагревают до кипения на водяной бане. После охлаждения под струей водопроводной воды прозрачный раствор количественно переносят в мерную колбу, стакан ополаскивают водой, промывные воды помещают в ту же колбу, доводят объем до метки дистиллированной водой и перемешивают;
Кислота соляная (HCl), плотность 1,19 г/см3;
Комплексон III (C10H18O10N2Na2), двуводный кристаллогидрат, раствор – 0,05 моль/дм3. 18,612 г препарата (M (C10H18O10N2Na2) = 372,24 г/моль) помещают в мерную колбу вместимостью 1 дм3, растворяют в дистиллированной воде, доводят водой до метки и перемешивают. Раствор хранят в полиэтиленовом или стеклянном парафинированном сосуде.
Для установления молярной концентрации раствора комплексона III к 10,0 см3 0,05 моль/дм3 раствора CaCl2 добавляют 95 см3 воды, 5 см3 раствора NaOH и титруют раствором комплексона III в присутствии 0,04 г индикатора (мурексид) до перехода розовой окраски в сиреневую.
Молярную концентрацию раствора комплексона III вычисляют по формуле:
![]() ,
,
где V1 – объем раствора соли кальция, см3; с – концентрация стандартного раствора соли кальция, моль/дм3; V – объем раствора комплексона III, см3.
Препараты комплексона III не гигроскопичны и характеризуются достаточно высокой чистотой, поэтому приготовление раствора по точной навеске обеспечивает получение стандартного раствора;
Натрия гидроксид (NaOH), раствор – 2 моль/дм3.
5 Порядок проведения испытаний
К пробе воды объемом 50 см3 добавляют 2,5 см3 буферного раствора и 0,15 г индикаторной смеси (эриохром черный). Полученный раствор титруют раствором комплексона III до перехода красной окраски в синюю.
6 Обработка и вычисление результатов измерений
6.1 Расчет суммарного содержания кальция и магния
Общее содержание Mg2+ и Ca2+ в анализируемой пробе воды (N, моль/дм3) рассчитывают по формуле:
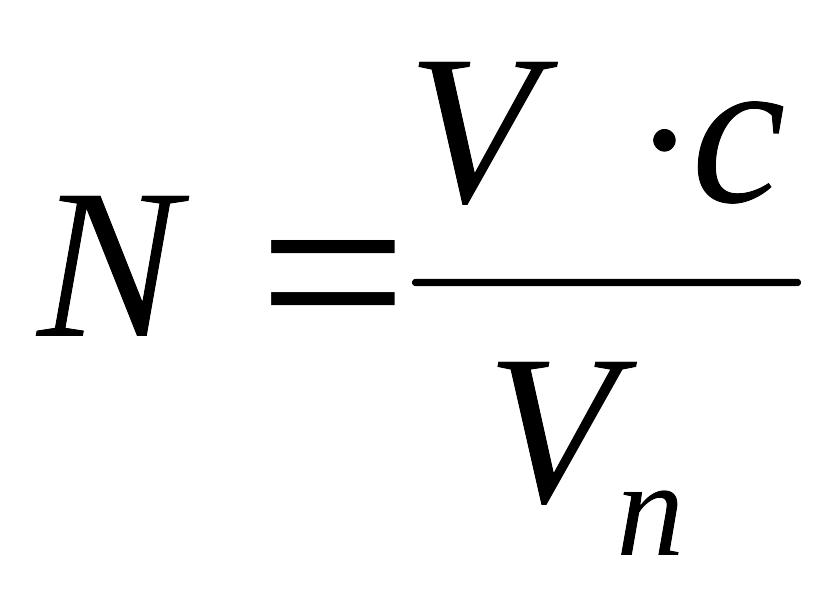 ,
,
где V – объем раствора комплексона III, затраченный на титрование, см3; с – концентрация раствора комплексона III, моль/дм3; V – объем пробы воды, взятой для анализа, см3.
6.2 Расчет общей жесткости воды
Для расчета общей
жесткости воды (Ж, ммоль/дм3)
значение N
(см. п. 6.1) пересчитывают на 1000 см3
воды и учитывают фактор эквивалентности
Mg2+
и Ca2+
(![]() ):
):
![]() .
.
За окончательный результат анализа принимают среднее арифметическое значение результатов двух параллельных определений, допускаемые расхождения между которыми в одной лаборатории не должны превышать по абсолютному значению 2 отн. %.
Вычисление проводят с точностью до первого десятичного знака.
7 Индивидуальное задание
Определить общую жесткость питьевой воды, отобранной в разных районах г. Минска.
