
- •Раздел 5. Гравиметрические методы
- •5.1. Лабораторная работа № 1 Определение в калийных удобрениях веществ, нерастворимых в воде
- •5.2. Лабораторная работа № 2 Определение золы в бумаге
- •5.3. Лабораторная работа № 3 Определение железа в растворе
- •5.4. Лабораторная работа № 4 Определение массовых долей влаги и нерастворимого в воде остатка в поваренной соли
- •5.5. Лабораторная работа № 5 Определение сульфатов в соках из фруктов
- •5.6. Вопросы для самостоятельной работы
5.3. Лабораторная работа № 3 Определение железа в растворе
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 г железа (около 0,02%), из которых 75% являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма – хлороз у растений и анемия у животных.
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине – важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК. Неорганические соединения железа встречается в некоторых бактериях, иногда используется ими для связывания азота воздуха.
В организм животных и человека железо поступает с пищей. Источником железа могут выступать печень, мясо, яйца, бобовые, хлеб, крупы, свёкла. Суточная потребность человека в железе составляет для детей – от 10 до 18 мг, взрослых мужчин – 10 мг, взрослых женщин – 18 мг, беременных женщин во второй половине беременности – 20 мг [25]. У женщин потребность в данном минерале несколько выше, чем у мужчин. Как правило, железа, поступающего с пищей, вполне достаточно, но в некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки с содержанием железа, например гематоген, ферроплекс и др.
Избыточная доза железа может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Содержание железа – важнейший показатель качества питьевой воды. Концентрация минерала более 1–2 мг/дм3 значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени. В соответствии с гигиеническими требованиями, утвержденными Министерством здравоохранения Республики Беларусь [26], ПДК железа в воде не должна превышать 0,3 мг/дм3.
1 Метод измерений
Метод основан на осаждении железа в виде гидроксида при определенном значении рН раствора (рН ≈ 5):
![]()
Форма осаждения Fe(OH)3∙xH2O. Гравиметрическая форма Fe2O3.
2 Средства измерений
Весы лабораторные 2-го класса точности с наибольшим пределом взвешивания 210 г;
Колба мерная вместимостью 100 см3;
Пипетка вместимостью 20 см3.
3 Вспомогательные устройства
Баня водяная;
Воронка;
Капельницы лабораторные стеклянные;
Стаканы стеклянные вместимостью 300–400 см3;
Палочка стеклянная с резиновым наконечником;
Чаши (тигли) кварцевые или фарфоровые;
Шкаф сушильный лабораторный, обеспечивающий поддержание температурного режима 40–150°С;
Щипцы тигельные;
Фильтр – красная лента.
4 Материалы, реактивы и растворы
Аммиачная вода (NH4OH), раствор – 10%;
Аммония нитрат (NH4NO3), раствор – 2%;
Вода дистиллированная;
Метиловый оранжевый, раствор – 0,1%;
Серебро азотнокислое (AgNO3), водный раствор – 0,5%.
5 Подготовка проб
Анализируемый раствор тщательно перемешивают.
6 Порядок проведения испытаний
50 см3 анализируемого раствора разбавляют в мерной колбе вместимостью 100 см3 водой. Полученный раствор перемешивают и пипеткой отбирают пробу 20 см3 в стакан вместимостью 300–400 см3. Раствор осторожно нагревают, не давая жидкости закипеть. К горячему раствору при перемешивании прибавляют раствор аммиачной воды и каплю метилового оранжевого до достижения раствором желтого цвета.
Содержимое стакана разбавляют 100 см3 горячей воды, перемешивают и оставляют стакан на 3–5 мин на горячей водяной бане для коагуляции осадка. Затем раствор фильтруют через фильтр с красной лентой.
Фильтр на воронке предварительно прогревают, смачивая горячей водой; раствор сливают по палочке на фильтр, не взмучивая осадка.
Количественно переносят осадок на фильтр: приставшие к стакану и палочке частицы снимают кусочком беззольного фильтра, кладут его на фильтр с осадком и омывают стенки и дно стакана горячей водой.
Осадок промывают раствором нитрата аммония, содержащим 3 капли раствора аммиачной воды на 100 см3 раствора, до полного удаления хлорид-ионов, что устанавливается пробой с нитратом серебра – не должно наблюдаться помутнение раствора.
Промытый осадок высушивают в сушильном шкафу при 100°С в течение 1 ч (не вынимая фильтра из воронки). Затем помещают свернутый фильтр во взвешенный тигель и прокаливают на горелке или в муфельной печи до постоянной массы.
7 Обработка и вычисление результатов измерений
Массу железа (X, г), рассчитывают по формуле:
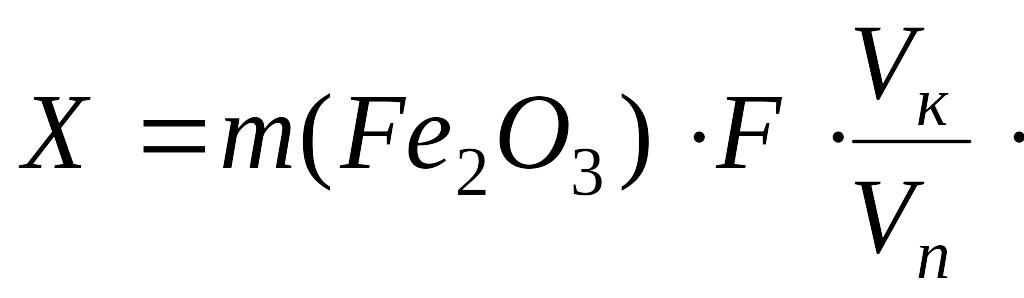
где F= 2M(Fe)/M(Fe2O3); Vк – объем анализируемого раствора, 100 см3; Vп – объем анализируемого раствора, взятого для анализа, 20 см3.
8 Индивидуальное задание
1) Определить содержание железа в пробах питьевой воды, отобранных в разных районах г. Минска. Рассчитать концентрацию железа в воде и сравнить с нормируемым значением [26];
2) Определить содержание железа в заданных растворах. Рассчитать массовую и молярную концентрации железа в растворах.
