
- •Введение Предмет и задачи химии окружающей среды
- •Происхождение и эволюция Земли
- •Образование земной коры и атмосферы
- •Эволюция атмосферы и происхождение жизни
- •Гидросфера
- •Глава 1. Физико-химические процессы в атмосфере
- •1.1. Состав атмосферы
- •1.2. Микрокомпонентные примеси в атмосфере
- •Время пребывания следов газов в естественной атмосфере
- •1.2.1. Геохимические источники
- •1.2.2. Биологические источники.
- •1.2.3. Антропогенные источники
- •Содержание основных компонентов выхлопов двигателей внутреннего сгорания (двс)
- •1.3 Смоги
- •1.4. Радиоактивное загрязнение атмосферы
- •Основные радиоактивные изотопы, обнаруживаемые в атмосфере после ядерного взрыва
- •1.5. Озоновый защитный слой
- •1.5.1. Механизмы разрушения озона
- •1.6. «Парниковый эффект»
- •Глава 2. Физико-химические процессы в литосфере
- •2.1. Состав и строение литосферы
- •2.2. Процессы выветривания
- •2.3. Почвы. Химический состав, свойства, загрязнение
- •2.3.1. Общие для большинства почв реакции
- •2.3.2. Катионный обмен
- •2.3.3. Потенциальная кислотность почв
- •2.3.4. Щелочность почв
- •2.3.5. Окислительно-восстановительные режимы
- •2.3.6. Гумификация
- •2.3.7. Химическое загрязнение и охрана почв
- •Глава 3. Физико-химические процессы в гидросфере
- •3.1. Пресные воды подземной гидросферы
- •3.2. Химия пресных поверхностных вод
- •3.2.1. Химия воды и режимы выветривания
- •3.2.2. Растворенные твердые вещества пресных вод
- •3.23. Биологические процессы
- •3.2.4. Диаграммы Eh-pH
- •3.2.5. Питательные вещества и эвтрофикация
- •3.3. Кислотные осадки
- •3.4. Океаны
- •3.5. Процессы в дельтах и эстуариях
- •Глава 4. Особенности распространения, трансформации и накопления загрязняющих веществ в окружающей среде
- •4.1. Изменения веществ в окружающем среде
- •4.1.1. Изменения во времени
- •4.1.2. Пространственные изменения
- •4.1.3. Распространение в окружающей среде
- •4.2. Перенос между различными средами
- •4.2.1. Перенос почва — вода
- •4.2.2 Перенос вода — воздух
- •4.23. Перенос почва -—воздух
- •4.2.4. Поступление и накопление в живых организмах
- •4.2.5. Географический и биотический перенос
- •4.3. Геохимические барьеры
- •4.4. Круговороты макроэлементов
- •Вещества, попавшие в окружающую среду исключительно в результате.Человеческой деятельности
- •4.4.1. Углерод
- •Атмосфера
- •4.4.2. Азот
- •Белок Аммонификация Фотосинтез
- •4.4.3. Фосфор
- •4.4.4. Сера
- •4.5. Круговороты второстепенных элементов
- •4.5.1. Галогены
- •Соединения хлора
- •Соединения йода
- •Соединения брома
- •Соединения фтора
- •4.5.2. Тяжелые металлы
- •Атмосфера
- •Биомасса
- •Общий запас
- •Общий запас
- •Стронций
Глава 3. Физико-химические процессы в гидросфере
Гидросфера - составная часть биосферы, непрерывная оболочка системы вода- пар, состоящая из соленой воды (моря, океаны), пресной воды (реки, озера, водохранилища), твердой воды (снежный покров, ледники), а также пронизанной водой или парами воды литосферы и атмосферы.
Гидросфера находится в состоянии непрерывного движения, развития, обновления. Ежегодно с поверхности Земли испаряется 0,5 млн. км3 воды, что составляет половину объема всех водоемов суши. Водяные пары атмосферы обновляются в течение десяти суток. Вода рек в результате стока сменяется каждые 12 суток. Вода озер обновляется каждые 10 лет. Воды мирового океана полностью сменяются каждые 3 тыс. лет, а в самой малоподвижной форме воды - в ледниках - полный водообмен происходит за 8,5 тыс. лет.
Большая часть поверхности нашей планеты, около 71%, покрыта мировым океаном, составляющим 97% всех поверхностных вод Земли и около половины всех вод литосферы.
Поперечник Земли (экваториальный диаметр) равен 12760 км, а средняя глубина океана в его современном ложе составляет 3700 м. Следовательно, толщина слоя океанической воды в среднем равна лишь 0,03% земного диаметра. В сущности, это тончайшая водяная пленка на поверхности Земли, пленка, играющая, подобно озоновому защитному слою, исключительно важную роль в биосфере.
В
0 1000 2000км
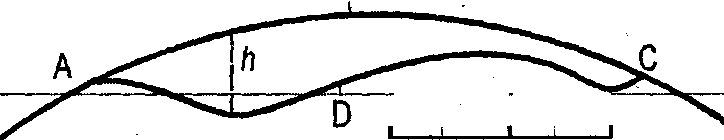
Рис. 14. Выпуклость и вогнутость дна океана
Объем Мирового океана составляет немногим более 0,1% объема земного шара, а по массе он еще меньше - всего 0,023% массы Земли.
Относительно небольшие объем и глубина Мирового океана по сравнению с объемом и диаметром земного шара приводят к тому, что дно океана фактически не является впадиной, «ямой»: оно выпуклое, а не вогнутое. На рисунке 14 линия АВС соответствует ширине Атлантического океана, равной 5800 км. Глубина океана на этом профиле не превышает 6000 м; в данном масштабе это не толще линии АВС, следовательно, дно океана на всем профиле выпуклое. Оно было бы вогнутым (в виде впадины) лишь в том случае, если бы лежало ниже хорды ADC, но тогда глубина превышала бы 800 км.
Живые организмы играют огромную роль в круговороте воды. Весь объем гидросферы (около 1,5 млрд. км3) проходит через живое вещество за 2 млн. лет.
Все воды планеты представляют собой растворы разного состава и различной концентрации. Среди растворенных в воде веществ можно выделить пять групп: главные ионы; биогенные элементы (С, Н, N, Р, Si, Fe, Mn), из которых состоят организмы; растворимые в воде газы: О2, N2, CО2, углеводороды и инертные газы; микроэлементы; органические вещества. Химический состав примесей пресной воды сильно отличается от состава примесей морской. Основные ионы речных вод: Са2+, Mg2+, Na+, K+, НСОз-, SО4-, Сl-. В речной воде преобладают карбонаты и гидрокарбонаты; из катионов наибольшие концентрации имеют кальций и магний. Однако химический состав пресных вод (рек, озер, грунтовых вод) значительно варьирует и зависит преимущественно от трех факторов: химии элементов, режимов выветривания, биологических процессов (см. далее).
Подавляющую часть морской соли составляют не карбонаты, а хлориды. В этом состоит главное отличие морской воды от речной. К тому же солевой состав морской воды (на всей Земле!) постоянен - это главнейшая закономерность в химии океана.
Концентрация растворенных солей определяет величину солености океана. Соленость определяется как вес в граммах неорганических ионов, растворенных в 1 кг воды. Семь ионов (Na+, Mg2+, К+, С1- , I-, SО42-, НSOз-) составляют более 99 % от всех ионов в морской воде, и соотношения их, напомним, постоянны во всех океанах Земли. Следовательно, на основании анализа одного иона можно по пропорции вычислить концентрацию всех остальных и соленость. Плотность морской воды, как и передача света и звука, зависит от солености. Соленость измеряется по проводимости электрического тока через воду (электропроводность). Измеренные значения выражаются относительно известного стандарта; таким образом, соленость не имеет единицы измерения, хотя во многих старых учебниках солености выражают как части на тысячу (ppt или %о) граммов на литр.
Воды открытого океана имеют средние значения солености 32-37, в большинстве около 35. В дельтах значения падают до величины ниже 1 по мере приближения к источнику пресной воды. В гиперсоленых средах соленость может превышать соленость морской воды, достигая значений более 300.
Важной химической характеристикой поверхностных вод является водородный показатель (рН). Выделение CO2 в результате дыхания и разложения вызывает понижение рН в природных водах, потому что при соединении СО2с водой образуется слабая (слабодиссоции-рующая) кислота Н2СОз:
Н2О + СО2 ↔ Н2СОз ↔ Н2СОз + Н+ (3.1)
С другой стороны, поглощение CO2 в процессе фотосинтеза приводит к уменьшению количества Н2СОз и Н+, т. е. к росту рН. Отсюда можно утверждать, что рН в водах регулируется равновесием СО2 и карбоната кальция:
Н2О + СО2 ↔ Н2СОз (3.2)
СаСОз (тв) + Н2СОз ↔ Са2+ + 2НСОз-. (3.3)
Видно, что повышение количества СО2 увеличивает содержание Н2СОз, что, в свою очередь, вызывает уменьшение содержания карбоната кальция, а уменьшение содержания СО2 приводит к осаждению карбоната кальция. Вода, содержащая Н2СОз и НСОз-, обладает буферными свойствами, поэтому достаточно большие изменения концентрации Н+ могут не приводить к сильному изменению рН.
Результирующие соотношения между молекулами и ионами, атмосферным СО2 и твердым карбонатом кальция приводят к формированию буферного раствора с рН = 8,0 - 8,4. При этом не исключено, что активность органического вещества или другие локальные причины могут образовать на некоторое время более низкие (до б) и более высокие (до 10) значения рН.
Существенной характеристикой, особенно важной для нормального протекания фотосинтеза, является прозрачность воды. За условную прозрачность морской воды принята глубина моря, на которой белый диск диаметром 30 см становится невидимым.
Важной характеристикой природных вод является их жесткость. Как известно, различают жесткость карбонатную (временную) и некарбонатную (постоянную). Первая обусловлена присутствием в воде бикарбонатов - Са(НСОз)2 и Mg(HCО3)2, вторая - сульфатами
CaSО4 и MgSО4 или их хлоридами. Карбонатная жесткость устраняется кипячением или прибавлением к воде Са(ОН)2
Са(НСОз)2 + Са(ОН)г → 2СаСОз↓ +2Н2О. (3.4)
Постоянная жесткость устранима прибавлением к воде соды:
CaSО4 + Na2CO3 → СаСОз↓+ NaSО4 (3.5)
Сумма временной и постоянной жесткости воды составляет общую жесткость, выраженную в миллиграмм-эквивалентах ионов Са2+ и Mg2+ на литр воды. Вода с жесткостью менее 4 мг-экв/л называется мягкой, от 4 до 8 - средней, от 8 - 12- жесткой, больше 12 мг-экв/л -очень жесткой. Жесткость отдельных естественных вод колеблется в весьма широких пределах. Для открытых водоемов она часто зависит от времени года и погоды. Наиболее «мягкой» природной водой является атмосферная вода, почти не содержащая растворенных солей.
