
- •Однокомпонентные системы.
- •Правило определения путей кристаллизации двухкомпонентных систем с ликвацией и полиморфными превращениями.
- •Правило определения пути кристаллизации двухкомпонентной системы с образованием твердых растворов.
- •Диаграмма состояния двухкомпонентных систем с образованием твердых растворов
- •Применение правила рычага в двухкомпонентных системах.
- •Треугольник концентраций
- •2.Точки составов химических соединений.
- •3.Пограничные кривые и поля первичной кристаллизации.
- •Тема: Применеие правила рычага в трехкомпонентной системе. Системы MgO-Al2o3- SiO2, k2o - Al2o3- SiO2, Na2o - CaO- SiO2, Li2o - Al2o3- SiO2
ВВЕДЕНИЕ
Данный конспект лекций необходим для закрепления основных положений курса «Физическая химия силикатов».
Основными целями конспекта лекций являются освоение студентами широкого круга вопросов, включающих сведения о свойствах кремния и, о строении и свойствах жидких, стеклообразных, кристаллических силикатов и силикатных расплавов, о твердофазовых процессах, происходящих в силикатных смесях при нагревании, о фазовых равновесиях в многокомпонентных системах, графических методах анализа и расчетов, дает сведения о диаграммах состояния одно-, двух-, трех- и многокомпонентных систем.
Основными задачами конспекта лекций являются:
дать студентам теоретические сведения о свойствах кремния и различных соединений;
научить подбирать оптимальные составы в одно-, двух-, трех- и многокомпонентных системах,
уметь управлять технологическими процессами и целенаправленно воздействовать на процесс синтеза для получения материалов с заранее заданными эксплуатационными характеристиками.
В конспект лекций включены: тематика лекционного материала, указан план проведения занятия, создан словарь основных понятий, в конце лекционного материала составлены контрольные вопросы, список литературы. Разработка имеет большое значение для студентов
Конспект лекций предназначен для студентов специальности:
050720 – Химическая технология неорганических веществ, специализация – Химическая технология тугоплавких неметаллических и силикатных материалов
Лекция № 1
Введение. Содержание и значение дисциплины «Физическая химия силикатов в химической технологии» как теоретической основы технологии силикатных и других тугоплавких соединений. Связь дисциплины с общетеоретическими специальными дисциплинами. Краткая история развития физической химии силикатов.
Значение дисциплины ФХС как теоретической основы технологии и других тугоплавких соединений.
Краткая история развития ФХС.
Модификация – переход вещества из одной фазы в другую.
Гомогенная система – система, внутри которой нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам.
Гетерогенная система – система, внутри которой имеются поверхности раздела, отделяющие друг от друга части системы, различающиеся по свойствам.
Предмет ФХС изучает современные данные по искусственным и природным соединениям кремния, новейшие сведения по системе кремнезема и его модификациях.
Предмет рассматривает фазовые равновесия в гомо- и гетерогенных системах, подробно изучает диаграмму состояния важнейших силикатных систем, изучает строение расплавов силикатов в кристаллическом и стеклообразном состояниях, важнейшие методы синтеза и занимается изучением их структуры и свойств.
Знание этих вопросов позволяет сознательно и целенаправленно управлять процессами силикатной технологии. ФХС является самостоятельной дисциплиной, которая в разделе о силикатах и других тугоплавких соединениях в кристаллическом состоянии уделяет внимание рассмотрению полиморфизма и дефектов кристаллической решетки.
Краткая история развития.
Искусство изготовления керамики путем формирования и обжига глины было известно на заре цивилизации. Наиболее древним изделием найденных в раскопках около 15 тыс лет до нашей эры. В противоположность этому производство цементоподобных материалов получило развитие около 200 лет назад. В древнем Египте использовали обожженную известь как кладочный раствор. Римляне комбинировали известь с вулканическим пеплом для изготовления цемента. Затем искусство было утрачено, но гидравлические свойства слабообожженных известняков были вновь открыты в Англии в 1750 году и в последующие 100 лет технология производства цемента сохранилась не претерпев изменений.
Основоположником науки о силикатах является Ломоносов. Элементы ФХС присутствуют в его труде « Курс истинной физической химии» в 1752 году. Он в своих исследованиях об окрашенных стеклах впервые особое внимание обратил на зависимость между составом и свойством стекла. В 1738 году И.Г Гмелин опубликовал статьи посвященные физикохимии и технологии изготовления фарфора.
Менделеев в своем труде «Стеклянное производство» впервые изложил научную теорию стеклообразного состояния.
Учения о растворах и фазовом равновесии между растворами возникло давно. Особое место в этом учении занимают работы Гиббса, создавшего теорию фазового равновесия. Им установлена возможность и необходимость изучения и количественного описания закономерностей, определяющих условие фазового равновесия. В направлении изучения фазовых равновесий в силикатных системах при высоких температурах ведущую роль сыграли работы Лессинга, создателя школы по ФХС и Курнакова, основателя метода термического анализа силикатов.
В изучении ФХС и расплавов больших успехов достигли ученые П.П. Лазарев, М.П. Воларович, П.А Аппен.
Ценнейший вклад в науку о стекле внес И.Г.Гребенщиков своими работами с ультрапористыми стеклами, образующимися при действии разбавленных кислот на некоторые боросиликатные стекла.
В области изучения основных закономерностей, определяющих ход реакции в твердых фазах, известны крупные работы академика Путникова, Яндера, Юнга, Журавлева. В изучении многокомпонентных оксидных систем, имеющих значение для получения высокогнеупоров, большая работа проводилась Бережным. Многочисленные физико-химические исследования в области синтеза стекол и стеклокристаллических материалов на основе промышленных отходов проведены Павлушкиным.
Вопросы:
Что изучает дисциплина физическая химия силикатов?
Назовите ученых, которые внесли вклад в развитие физической химии силикатов.
INTRODUCTION
The basic purposes of the abstract of lectures are development by the students of a wide circle of questions the including items of information on properties of silicon and, about a structure and properties liquid, glassform , crystal of silicates and silicate melt, about solid phase processes occurring in silikate mixes at heating, about phase balance in manycomponent systems, graphic methods of the analysis and accounts, gives the items of information on the diagrams of a condition one, two, three and manycomponent systems.
The basic tasks of the abstract of lectures are:
- To give the students the theoretical items of information on properties of silicon and various connections;
- To learn to select optimum composition in one, two, three and manycomponent systems,
-To be able to operate technological processes and purposefully to influence
process of synthesis for reception of materials with the beforehand given operational characteristics.
In the abstract of lectures are switched on: subjects of a lecture material, the plan of realization of employment(occupation) is specified, the dictionary of the basic concepts is created, at the end of a lecture material the control questions, list of the literature are made. The development has the large meaning (importance) for the students.
The abstract of lectures is intended for the students of a speciality:
5В0753000 - Chemical technology refractory not metal and silicate of materials.
Lecture № 1
1.Introduction. The contents and meaning of discipline PCS as theoretical basis of the technology of production, fire-proof and other refractory connections. Communication of discipline with total theoretical and special disciplines. A brief history of development of PCS.
1. Meaning of discipline PCS as theoretical basis of technology and other refractory connections.
2. Brief history of development PCS.
Modification - transition of substance from one phase in another.
Homogeneous system - system, inside which there are no surfaces of the unit separating from each other a parts of system, differing on properties.
Heterogeneous system - system, inside which there are surfaces of the unit separating from each other a parts of system, differing on properties.
The subject PCS studies the modern data on artificial and natural compounds of silicon, newest items of information on system silica and its modifications.
The subject considers of phase balance in homo- and heterogeneous systems, in detail studies the diagram of a condition important silicate of systems, studies a structure melt of silicates in crystal and glasslike condition, important methods of synthesis and is engaged in study of its structure and properties.
The knowledge of these questions allows consciously and purposefully to operate processes silicate of technology. PСS is independent discipline, which in section about of silicates and other refractory connections in a crystal condition gives attention to consideration polymorphism and defects of a crystal lattice.
Brief history of development.
The art of manufacturing of ceramics by forming and burning of clay was famous of a civilization. By the most ancient product found in excavation about 15 000 of years B.C. As opposed to this manufacture cement similarly of materials has received development about 200 years back. In ancient Egypt used burnt lime as masonry mortar (кладочный раствор). Roman combined lime with volcanic ashes for manufacturing cement. Then the art was lost, but the hydraulic properties low burnt of limes again were open in England in 1750 and in following 100 years the of technology of cement was saved not having undergone changes.
By founder of a science about silicate is Lomonosov. The elements PСS are present at his work " Cours of true physical chemistry " in 1752. He in the researches about the painted glasses for the first time special attention has paid on dependence between structure and property of a glass. In 1738 I.G.Gmelin has published articles devoted physics chemistry and technology of manufacturing of porcelain.
Mendeleev in the work " Glass manufacture " for the first time has stated the scientific theory glasslike of a condition.
The doctrines about solutions and phase balance between solutions has arisen for a long time. The special place in this doctrine is borrowed jobs Гиббса which has created the theory, phase balance. He established an opportunity and necessity of study and quantitative description of laws determining a condition of phase balance. In a direction of study phase balance in silicate systems at high temperatures a conducting role the jobs Lessinga, founder of school on PСS and Kurnakova, founder of a method of the thermal analysis of silicates have played.
In study PСS and melts of the large successes achieved the scientific Lazarev, M.P.Volarovich, P.A.Appen.
The most valuable contribution has brought to a science about glass I.G.Grebenshicov by the jobs with the ultra porous glasses formed at action of diluted acids on some borosilicate of a glass.
In the field of study of the basic laws determining a course of reaction in firm phases, are known the large jobs of the academician Putnicov, Yander, Yung, Gzuravleva. In study manycomponent oxide of systems important for obtained high proof, the large job was spent Beregznyim. The numerous phisics-chemical researches in the field of synthesis of glasses and glasscrystal of materials on the basis of industrial wastes are carried spent by Pavlushkin.
Questions:
1. What is studies the discipline physical chemistry of silicates?
2. Name the scientists, which have brought in the contribution to development of physical chemistry of silicates.
Лекция № 2.
Тема: Кремний и его открытие и распространенность в минеральном и органическом мире. Роль кремния и его соединений. Развитие химии кремния. Значение научных работ отечественных и зарубежных ученых.
Кремний и его открытие.
Развитие химии кремния.
Значение научных работ ученых.
Процелин - фарфор
Силаны - кремневодороды
Кремний 14 элемент периодической системы. Был получен в 1811 году Гей-Люссаком и Тенором восстановлением фторида кремния (SiF4) металлическим калием.
На наружной оболочке атома находится 4 электрона, чем и обусловлено сходство Si с другими элементами четвертой группы.
SiО2 – высшее кислородное соединение . В природе в свободном виде Si не встречается. По содержанию в земной коре (27,6%) занимает второе место после кислорода.
Сравнительно чистый кремний получают восстановлением кварца SiО2 магнием, а технически чистый – восстановлением (в электрических печах при 1800 0С) либо углеродом в присутствие железа:
SiО2 + 2 С = Si + 2СО
или карборундом:
SiО2 + 2 SiС = 3 Si + 2СО
Атомный вес кремния составляет 28,09. Имеются изотопы с массовыми числами 28,29,30. Получены три радиоактивных искусственных изотопа с массовыми числами 27,31, 32. Период полураспада не менее 100 лет.
Si – плавится при 1414 0 С и кипит при 2600 0 С.
Развитие производства полупроводниковых приборов и электроники создало для Si ответственную сферу применения. Это электронные счетно-решающие и управляющие устройства, радиоэлектроника, телеуправление и т.д.
Кремний относится к весьма важным полупроводниковым материалам. В большинстве полупроводниковых устройств кремний используется виде монокристаллов. С начала получают его летучие соединения – галогениды и нитриды: SiCl4 и пары цинка пропускают при 950 С через кварцевый реактор, где выпадают друзы кремния. Этот способ был предложен Бекетовым в прошлом столетие.
Монокристаллы кремния выращивают в тиглях из плавленого кварца погружением конца затравки вырезанной из монокристалла в расплав. Кремний нагретый на несколько градусов выше температуры плавления. После выдержки медленно и с вращением вытягивают монокристалл. Размеры монокристалла достигают более 50 мм в диаметре и 450 м в длину. У гидроокиси кремния отмечаются слабые кислотные свойства.
Кремний сильный восстановитель, растворяется в расплавленных металлах и имеет амфотерные свойства.
Кремний соединяется с 79 % элементов и образует с выше 160 бинарных соединений.
Кремний используется в производстве электронагревательных стержней. Он образует многочисленные кислородные и безкислородные соединения с другими элементами: кремневодороды (силаны) с галогенами, комплексные соединения кремния и фтора, соединения с металлами (силициды), углеродистый кремний, соединения кремния с бором и азотом.
Определяя задачи науки о силикатах, М.В.Ломоносов писал: «Физическая химия есть наука, объясняющая на основании положений и опытов физики то, что происходит в смешанных телах при помощи химических операций». Понятие «смешанного тела» полностью может быть отнесено к силикатной шихте, из которой путем обжига получают силикатный продукт (керамика, стекло и цемент). В его книге впервые дано научное определение процесса спекания керамических масс.
М.В.Ломоносов в своих исследованиях окрашенных стекол впервые особое внимание обратил на зависимость между составом и свойствами стекол.
В 1738 году И.Г.Гмелин опубликовал статьи, посвященные физико-химии и технологии изготовления фарфора. Необходимо отметить, что эти статьи были первыми по химической технологии, опубликованными в изданиях Российской Академии наук.
Высказывания о природе фарфора встречаются также в трудах выдающегося русского керамиста XVIII века, создателя первого русского фарфора Д.И. Виноградова. Мысли о природе фарфора и стекла изложены в его рукописи «Обстоятельное описание чистого процелина» (в XVIII веке фарфор называли процелином).
Идея о многообразной природе фарфора, состоящего из кристаллической и стекловидной фазы, получила развитие в трудах русского ученого В.М. Севергина.
Д.И. Менделеев в своем труде «Стеклянное производство» впервые изложил научную теорию стеклообразного состояния.
Учение о растворах и фазовом равновесии между растворами возникло давно. Особое место в этом учении занимают работы Гиббса, создавшего термодинамическую теорию фазового равновесия. Им установлена возможность и необходимость изучения и количественного описания закономерностей, определяющих условия фазового равновесия.
В направлении изучения фазовых равновесий в силикатных системах при высоких температурах решающую роль сыграли работы Ф.Ю.Левинсон-Лессинга – создателя школы по физико-химии силикатов и Н.С.Курнакова – основателя метода термического анализа силикатов.
Теория кристаллического состояния наиболее детально впервые разработана Ю.С. Федоровым, предсказавшим все возможные типы структур кристаллов, в том числе и силикатов.
В изучении физико-химии силикатных расплавов больших успехов достигли советские ученые П.П. Лазарев, М.П. Воларович, К.Г. Куманин, А.А. Аппен.
Велика заслуга в области геохимических знаний Ф.К. Вернадского, который дал классические характеристики роли силикатов в истории образования земной коры и минералообразования, установил структуру алюмосиликатных пород.
Ценнейший вклад в науку о стекле внес И.Г. Гребенщиков своими работами с ультрапористыми стеклами, образующимися при действии разбавленных кислот на некоторые боросиликатные стекла. В результате этих работ сложились совершенно новые представления о микрогетерогенном строении стекла.
В области изучения основных закономерностей, определяющих ход реакций в твердых фазах, известны крупные работы академика Н.П. Будникова, В. Яндера, В.Н. Юнга, Ю.М. Бута и В.Ф. Журавлева.
Изучение диаграмм состояния силикатных систем проводится во многих научно-исследовательских учреждениях России, в Казахстане.
Н.А. Тороповым выполнены многочисленные работы в области физической химии и петрографии различных оксидных и силикатных систем, важных для теории и технологии материалов, предназначенных для новой техники.
В изучении многокомпонентных оксидных систем, имеющих значение для получения высокоогнеупоров, большая работа проводилась А.С. Бережным.
Многочисленные физико-химические исследования в области синтеза стекол и стеклокристаллических материалов на основе промышленных отходов проведены И.И. Китайгородским и Н.М. Павлушкиным.
В ЮКГУ им. М.Ауезова проводились и проводятся фундаментальные исследования по изучению поликомпонентных систем СаО – MgO – Al2O3 – SiО2 – (Na2O, K2О), позволившие разработать технологию получения стеклокристаллических материалов на основе отходов промышленности и горных пород.
Вопросы:
Когда и кем был открыт кремний?
Где используется кремний?
Какие работы отечественных и зарубежных ученых Вы знаете?
Lecture 2.
Silicon, its opening and prevalence in the mineral and organic world, role of silicon and its connections in the technology of production of binding materials. Development of chemistry of silicon.
1. Silicon and its opening.
2. Development of chemistry of silicon.
3. Meaning of scientific jobs of the scientists.
Procelin - porcelain
Silane – hydrosilicons
Silicon is 14 elements of periodic system. Was received in 1811 Gei-Lyussak and Tenor by restoration flyoride of silicon (SiF4) by metal potassium.
On an outside environment of atom is 4 electron, than and the similarity Si with other elements of the fourth group.
SiО2 – highest oxygen compound. In a nature in a free kind Si does not meet. Under the contents in Earth crust (27,6 %) occupies the second place after oxygen.
Rather pure(clean) silicon receive by restoration of quartz SiО2 магнием, and technically pure(clean) - restoration (in electrical furnaces at 1800 0С) or carbon in presence of iron:
SiО2 + 2 With = Si + 2СО
Or карборундом:
SiО2 + 2 SiС = 3 Si + 2СО
The nuclear weight of silicon makes 28,09. There are isotopes with mass numbers 28,29,30. Three radioactive artificial isotopes with mass numbers 27,31, 32 are received. The period полураспада not less than 100 years.
Si - плавится at 1414 0 With and boils at 2600 0 С.
The development of manufacture of semi-conductor devices and electronics has created for Si responsible(crucial) sphere of application. It is electronic счетно-decisive and managing devices, radioelectronics, telecontrol etc.
The silicon concerns to the rather important semi-conductor materials. In the majority of semi-conductor devices the silicon is used a kind of monocrystals. From a beginning receive his(its) flying connections - галогениды and нитриды: SiCl4 and pairs of zinc pass(miss) at 950 With through quartz реактор, where drop out друзы of silicon. This way was offered Бекетовым in the past century.
Monocrystals of silicon выращивают in тиглях from плавленого of quartz by immersing of the end затравки cut out from a monocrystal in расплав. The silicon heated up on some degrees is higher than temperature плавления. After endurance slowly and with rotation extend a monocrystal. The sizes of a monocrystal reach(achieve) more than 50 mm in a diameter and 450 м in length. At гидроокиси of silicon the weak acid properties are marked.
The silicon strong восстановитель, is dissolved in расплавленных metals and has амфотерные of property.
The silicon incorporates from 79 % of elements and forms with higher(above) 160 binary connections.
The silicon is used in manufacture of electroheating cores. He forms numerous oxygen and безкислородные of connection with other elements: кремневодороды (силаны) with галогенами, complex connections of silicon and фтора, connection with metals (силициды), углеродистый silicon, connection of silicon with бором and nitrogen.
Defining(determining) tasks of a science about силикатах, М.В.Ломоносов wrote: " the Physical chemistry is science explaining on the basis of rules(situations) and experiences of physics that occurs in the mixed bodies through chemical operations ". The concept " of the mixed body " completely can be referred to силикатной шихте, from which by обжига receive силикатный a product (ceramics, glass and cement). In his(its) book scientific definition of process of sintering of ceramic weights for the first time is given.
М.В.Ломоносов in the researches of the painted glasses for the first time special attention has paid on dependence between structure and properties of glasses.
In 1738 И.Г.Гмелин has published clauses devoted to физико-chemistry and technology of manufacturing of porcelain. It is necessary to note, that these clauses were first on chemical technology published in the editions of the Russian Academy of sciences.
The statements about a nature of porcelain meet also in works outstanding Russian керамиста XVIII of century, founder of first Russian porcelain Д.И. Виноградова. The ideas on a nature of porcelain and glass are stated in his(its) manuscript " the Detailed description pure(clean) процелина " (in XVIII century of porcelain named процелином).
The idea about a diverse nature of porcelain consisting from crystal and стекловидной of a phase, has received development in works of Russian scientist В.М. Севергина.
Д.И. Менделеев in the work " Glass manufacture " for the first time has stated the scientific theory стеклообразного of a condition.
The doctrine about solutions and phase balance between solutions has arisen for a long time. The special place in this doctrine is borrowed(occupied) by(with) jobs Гиббса, phase balance, which has created the thermodynamic theory. He(it) establishes an opportunity and necessity of study and quantitative description of laws determining condition of phase balance.
In a direction of study phase равновесий in силикатных systems at high temperatures a main role the jobs Ф.Ю.Левинсон-Лессинга - founder of school on физико-chemistry силикатов and Н.С.Курнакова - founder of a method of the thermal analysis силикатов have played.
The theory of a crystal condition most in details for the first time is developed Ю.С. Федоровым, предсказавшим all possible(probable) types of structures of crystals, including силикатов.
In study of физико-chemistry силикатных расплавов of the large successes the Soviet scientific items have reached(achieved). Лазарев, М.П. Воларович, К.Г. Куманин, А.А. Аппен.
The merit is great in the field of geochemical knowledge Ф.К. Вернадского, which has given the classical characteristics of a role силикатов in a history of education terrestrial коры and минералообразования, has established structure алюмосиликатных of breeds.
The most valuable contribution has brought to a science about glass И.Г. Гребенщиков by the jobs with the ultra porous glasses formed at action of diluted acids on some боросиликатные of a glass. As a result of these jobs there were completely new representations about a microheterogeneous structure of a glass.
In the field of study of the basic laws determining a course of reactions in firm phases, the large jobs of the academician Н.П are known. Будникова, In. Яндера, В.Н. Юнга, Ю.М. Бута and В.Ф. Журавлева.
The study of the diagrams of a condition силикатных of systems is spent in many research establishments of Russia, in Kazakhstan.
Н.А. Тороповым the numerous jobs are executed in the field of physical chemistry both петрографии various оксидных and силикатных of systems, important for the theory and technology of materials intended for new engineering.
In study multicomponent оксидных of systems important for reception высокоогнеупоров, the large job was spent Ampere-second. Careful.
The numerous физико-chemical researches in the field of synthesis of glasses and стеклокристаллических of materials on the basis of industrial wastes are carried out(spent) И.И. Китайгородским and Н.М. Павлушкиным.
In ЮКГУ by him(it). М.Ауезова were spent and the basic researches on study поликомпонентных of systems СаО - MgO - Al2O3 - SiО2 - (Na2O, K2О), allowed are spent to develop technology of reception стеклокристаллических of materials on a basis отходов of an industry and mountain breeds.
Questions:
1. When also who open silicon?
2. Where the silicon is used?
3. What jobs of the domestic and foreign scientists you know?
Лекция № 3.
Тема : Кремнекислородные мотивы в структурах силикатов. Структура силикатов с крупными катионами – работы советской школы Н.В. Белова.
Кремнекислородные мотивы в структурах силикатов.
Работы Н.В.Белова.
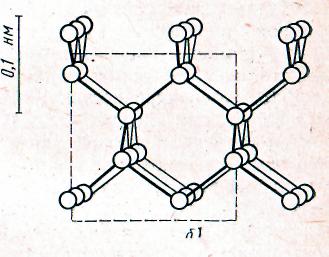
Ксонотлитовая лента - основа структуры многих гидросиликатов кальция. Ксонотлитовая лента - удвоение волластонитовой цепочки.
Силикаты представляют собой особый класс неорганических соединений, основной структурной единицей которых являются изолированные или связанные друг с другом кремнекислородные тетраэдрические группы [SiO4] 4- (ортосиликатные ионы)

0,162нм 0,264нм


Рисунок 1. - Средние параметры тетраэдрической группы [SiO4] 4- в кремнеземе.
Размеры тетраэдрической группы в силикатах в зависимости от кратности связи и степени ее ионности колеблются в сравнительно узких пределах, в частности, длины связи Si – О составляет в среднем 0,162нм, а расстояние между атомами кислорода 0,264 нм.
Одной из характерных свойств тетраэдрической группы [SiO4] 4- является их способность объединяться друг с другом через общие атомы кислорода, называемыми мостиковыми с образованием связи Si – О – Si . такое объединение может происходить только путем обобщений вершин тетраэдра (а не ребер или граней), причем каждая тетраэдрическая группа может иметь с соседними одну, две, три или все четыре вершины ( то есть общих атомов кислорода).
Благодаря этому создаются весь мА разнообразные по характеру сочетания взаимно связанных тетраэдрических групп [SiO4] 4-, образующих различные по составу и строению крупные комплексы, которые в структуре силикатов называют кремнекислородными мотивами или радикалами. Современная классификация основывается именно на характере этих кремнекислородных мотивов.
Кроме кремнекислородных групп в состав силикатов, которые отличаются довольно сложным химическим составом, входят многие другие ионы, в частности: Li, Ne,K, Be, Mg , Ca, Ti, Mn, Fe, Zn, B, Ba, O, H , F, и тд.
Некоторые катионы, прежде всего Al, B, Be обладают способностью имитировать кремний в кремнекислородном радикале, то есть частично изоморфно замещать ион, входя в состав кремнекислородного мотива.
Особую роль в силикатах играет алюминий, который в структуре может заменять двойственное положение.
Первый период изучения структур силикатов был связан с именем В.Л. Брэгга.
В начале 50-х годов Н.В. Белов и его школой были открыты новые цепочки, ленты и другие мотивы в основе которых лежат не одиночные тетраэдры [SiO4] 4-, а диортогруппы [Si 2O7] 6-.
В.Л. Брэггом изучались главным образом силикаты таких катионов как Mg2+ , Al2 3+ а так же замещающие их Fe2+ , Fe3+. Эти катионы в силикатных структурах имеют координационное число 6.
Н.В. Беловым изучались силикаты с крупными катионами: Na 2+, Ca2+ и др. Основной кремнекислородной единицей является диортогруппа [Si 2O7] 6
Примером цепочек с диортогруппами являются волластонитовая и родонитовая цепочки. В волластоните основой структуры являются бесконечные колонки из поставленных на ребро октаэдров. Каждый второй октаэдр сцеплен сразу с обоими тетраэдрами диортогруппы [Si2O7]6-. Однако поскольку высота диортогруппы несколько больше ребра Са- октаэдра, то группа [Si2O7] 6- искажается, оттягивается, приближаясь по размеру к Са-октаэдру.
Противоположное ребро группы удлиняется и создается возможность связать между собой две диортогруппы всего лишь одним октаэдром
[SiO4] 4- рис. 1 в родоните, в состав которого входят Ca, Mn – октаэдры, цепочки еще больше усложняется и элемент повторяемости этой цепочки содержит две диорто и одну ортогруппу рис.1
Удвоение волластонитовой цепочки дает ксонотлитовую ленту, которая отличается от амфиболовой тем, что состоит не из шестерных, а из восьмерных. Радикал ксонотлитовой ленты [Si 6O17] 10- . Ксонотлитовая лента является основой структуры многих гидросиликатов кальция и входит в структуру либо в виде самостоятельных радикалов либо в виде конденсированных слоев. Эти гидросиликаты играют важную роль в процессах гидратации и твердения цемента. При высоких температурах происходит разрыв лент или слоев, и большинство гидросиликатов превращается в волластонит.
В слоистых силикатах кроме широко распространенной сетки из шестиугольных колец, получающейся конденсацией амфиболовых лент и характерной для талька, слюд, каолинита, существуют и сетки, образованные конденсацией ксонотлитовых и более сложных лент. В их строении как и в строении ксонотлитовых лент, четко выделяется диортогруппа [Si 6O17] 10- .
Диортогруппы можно выделить так же и в каркасных силикатах, в которых присутствуют только крупные катионы, и в некоторых кольцевых силикатах. На основании исследования большинства силикатов с различными катионами Н.В. Белов пришел к выводу, что основная роль в силикатных структурах принадлежат катионным мотивам, к которым лишь приспосабливаются кремнекислородные радикалы. Между ионами кислорода окружающими катион в структуре силиката, располагаются мягкие ионы кремния. Каждый атом кремния занимает в данный момент только одну из шести соседних тетраэдрических пустот, так как согласно правилу Полинга, тетраэдры [SiO4] 4-, не должны иметь общих ребер. Атом кремния может легко мигрировать из одного тетраэдра в другой, чем и объясняется возможность приспосабливания кремнекислородных радикалов к основному мотиву кристаллической структуры. Если основные катионы имеют средние размеры, то соответствующий радикал строится из классических тетраэдров [SiO4]4-, если катионы более крупные кремнекислородные радикалы состоят из диортогрупп [Si 2O7] 6-.
Вопросы:
Что такое кремнекислородные мотивы в структурах силикатов?
Что является основной кремнекислородной единицей?
Размеры тетраэдрической группы в силикатах, длина связи Si – О и расстояние между атомами кислорода.
Что такое мостиковая связь?
Что Вы знаете о работах Н.В.Белова?
Lecture № 3.
Theme: Silicaoxygen motives in structures of silicates. Structure of silicates with large cations is job of the Soviet school N.V.Belov.
1. Silicaoxygen motives in structures of silicates.
2. Job N.V.Belov.
Xonotlite a tape is basis of structure many hydrosilicate of calcium.
Xonotlite a tape - doubling wollastonite of a chain.
Silicates represent the special class of inorganic connections, basic which structural unit are isolated or connected with each other silicaoxygen tetrahedral of group [SiO4] 4- (orthosilicates ions)
0,162нм 0,264нм
Figure 1. - Average parameters tetrahedral of group [SiO4] 4- in silica .
The sizes tetrahedral of group in silicates depending on ratio of connection and degree it electrovalence change in rather narrow limits, in particular, lengths of connection Si – O about makes on the average 0,162nm, and distance between atoms of oxygen 0,264 nm.
By one of characteristic properties tetrahedral of group [SiO4] 4- is their ability to be united with each other through common atoms of oxygen named bridge such association can occur to education of communication(connection) Si - About - Si. only by generalizations of tops tetrahedron (instead of edges or sides), and everyone tetrahedron group can have with next one, two, three or all four tops (that is general(common) atoms of oxygen).
Due to this are created all мА various on character of a combination mutually connected tetrahedral of groups [SiO4] 4-, forming various on structure and structure large complexes, which in structure silicate name silicaoxygen by motives or radicals. The modern classification is based on character these silicaoxygen of motives.
Except for silicaoxygen of groups structure silicate, which differ by rather complex(difficult) chemical structure, includes many other ions, in particular: Li, Ne, K, Be, Mg, Ca, Ti, Mn, Fe, Zn, B, Ba, O, H, F, and тд.
Some cation, first of all Al, B, Be have ability to simulate silicon in silicaoxygen a radical, that is partially isomorphic to replace an ion, entering in structure silicaoxygen of motive.
The special role in silicate is played by(with) aluminium, which in structure can replace a dual rule(situation).
The first period of study of structures silicate was connected to a name V.L. Bregga .
In the beginning 50 years N.V. Belov and his (its) school the new chains were open, the tapes and other motives in which basis lay not single tetrahedron [SiO4] 4-, and diorthogroup [Si 2O7] 6-.
В.Л. Брэггом were studied mainly silicate such cation as Mg2 +, Al2 3 + and as replacing them Fe2 +, Fe3 +. These cation in silicate structures have coordination number 6.
Н.В. Беловым were studied silicate with large cation: Na 2 +, Ca2 + etc. Basic silicaoxygen by unit is diorthogroup [Si 2O7] 6.
Example of chains with diorthogroup are wollastonite and rhodonite of a chain. In волластоните a basis of structure are the infinite columns from put on an edge octahedron. Everyone second octahedron is linked at once to both tetrahedron diorthogroup [Si2O7] 6-. However as height diorthogroup is a little bit more than an edge Са- octahedron, group [Si2O7] 6- is deformed, is delayed, coming nearer on the size to Са- octahedron.
The opposite edge of group is extended and the opportunity is created to connect among themselves two diorthogroup only by one octahedron
[SiO4] 4- fig. 1 in rhodonite, into which structure enter Ca, Mn - octahedron, chains an element of repeatability of this chain becomes complicated even more two diorto and one ortogroup also contain a fig. 1
The doubling wollastonite of a chain gives xonotlite a tape, which differs from amphibolic by that consists not from senary, and from octamerous. A radical xonotlite of a tape [Si 6O17] 10-. xonotlite the tape is a basis of structure many hydrosilicate calcium and enters into structure either as independent radicals or as the condensed layers. These hydrosilicate play the important role in processes hydration and hardening of cement. At high temperatures there is a break of tapes or layers, and the majority hydrosilicate turns in wollastonite.
In layered silicate except for the widely widespread grid from six-coal rings the turning out condensation amphibolic of tapes and characteristic for talc, micas, kaolinite, exists also grids formed(educated) by condensation xonotlite and more complex(difficult) tapes. In their structure as well as in a structure xonotlite of tapes, is precisely allocated diortogroup [Si 6O17] 10-.
diortogroup it is possible to allocate as and in frame silicate, at which are present only large катионы, and in some ring silicate. On the basis of research of the majority silicate with various cation Н.В. Белов has come to a conclusion, that the basic role in silicate structures belong cation to motives, by which only adapt кремнекислородные radicals. Between ions of oxygen environmental cation in structure silicate, the soft ions of silicon settle down. Each atom of silicon borrows(occupies) at the given moment only one of six next тетраэдрических of emptiness, as according to a rule Полинга, тетраэдры [SiO4] 4-, should not have general(common) edges. The atom of silicon can easily мигрировать from one тетраэдра in another, than and the opportunity of adaptation кремнекислородных of radicals to the basic motive of crystal structure is explained. If basic cation have the average sizes, the appropriate radical is under construction from classical тетраэдров [SiO4] 4-, if cation larger кремнекислородные radicals consist from диортогрупп [Si 2O7] 6-.
Questions:
1. What such кремнекислородные motives in structures силикатов?
2. What is basic кремнекислородной by unit?
3. Sizes тетраэдрической of group in силикатах, length of communication(connection) Si - About and distance between atoms of oxygen.
4. What such мостиковая communication(connection)?
5. What you know about jobs Н.В.Белова?
Кремнекислордный - Silicaoxygen
Ксонотлитовая лента - hydrosilicate of calcium
Гидросиликаты кальция - hydrosilicate of calcium
Удвоение волластонитовой цепочки - doubling wollastonite of a chain
Tетраэдрической – tetrahedral
Кратность - ratio
Ионность - electrovalence
Мостиковая связь – bridge bond
Такое объединение – such association
Лекция № 4.
Тема : Кристаллическое состояние силикатных материалов. Методы изучения структуры кристаллических веществ. Основные правила построения ионно-ковалентных структур.
1. Силикаты в кристаллическом сосотянии.
2. Методы изучения структуры кристаллических веществ.a
3. Основные правила построения ионно-ковалентных структур.
ДТА - дифференциальный термический анализa
ТГ - термогравиметрический анализ
Дифракционные методы
К дифракционным методам исследования структуры относятся рентгенография, электронография и нейтронография. Методы основаны на использовании излучений с длиной волны, соизмеримой с расстоянием между структурными элементами кристаллов. Проходя через кристалл, лучи дифрагируют, возникающая дифракционная картина строго соответствует структуре исследуемого вещества.
Метод дифракции рентгеновского излучения.
Развитие рентгеноструктурного анализа началось со знаменитого опыта М. Лауэ (1912), показавшего, что пучок рентгеновского излучения, проходя через кристалл, испытывает дифракцию, причем симметрия, распределения дифракционных максимумов соответствует симметрии кристалла. Дифракционные максимумы возникают во всех направлениях, отвечающих основному закону рентгеноструктурного анализа— уравнению Вульф а — Брэгга
Дифракционные методы можно условно разделить на две группы: 1) угол падения луча на кристалл постоянный, а длина излучения меняется; 2) длина волны постоянная, а угол падения меняется.
К методам первой группы относится метод Лауэ, заключающийся в том, что полихроматическое рентгеновское излучение направляется на неподвижный монокристалл, за которым располагается фотопленка. Из множества длин волн, имеющихся в полихроматическом излучении, всегда найдется такая волна, которая удовлетворяет условиям уравнения Вульфа — Брзгга. Метод Лауэ дает возможность выявить симметрию кристалла. К методам второй группы относятся методы вращения монокристалла и поликристаллического образца. В методе вращения монокристалла монохроматический луч направляется на монокристалл, вращающийся вокруг оси, нормальной к направлению луча. При этом различные плоскости кристалла попадают в положение, соответствующее условиям дифракции, что приводит к образованию соответствующей дифракционной картины. Измерением интегральной интенсивности и определением набора структурных амплитуд можно расшифровать структуру кристалла.
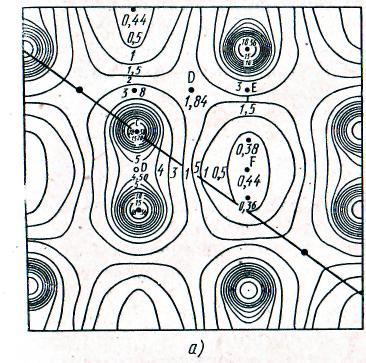
При изучении поликристаллических материалов образец освещается монохроматическим излучением. В множестве произвольно ориентированных кристаллов всегда найдется такой, ориентировка которого отвечает уравнению Вульфа-Брэгга. Отраженный луч регистрируется фотоспособом (рис.2) либо ионизационными или сцинтилляционными счетчиками, сигнал через систему усилителей и пересчетных устройств подается на потенциометр, записывающий кривую распределения интенсивности (рис.3). По расположению дифракционных максимумов судят о геометрии решетки, а по их интенсивности — о распределении электронной плотности, т. е. о вероятности нахождения электронов в той или иной точке кристалла (рис. 4). Распределение электронной плотности дает возможность определять не только положение атомов в решетке, но и тип химической связи. Высокотемпературные приставки к дифрактометрам позволяют регистрировать полиморфные превращения при нагревании, следить за твердофазовыми реакциями.
Рентгенография дает также возможность изучать дефекты в кристаллах.
выход луча; 4 — область малых углов 9
Рис. 2. Съемка • рентгенограммы поликристаллических образцов методом фоторегистрации:
Рис. 3. Рентгенограмма кварца, полученная на установке со сцинтилляционным методом регистрации
Метод дифракции электронов (электронография). Метод основан на том, что при взаимодействии с электростатическим полем атомов происходит рассеяние пучка электронов. В отличие от рентгеновского, электронное излучение может проникать лишь на небольшую глубину, поэтому исследуемые образцы должны иметь вид тонких пленок. При помощи электронографии можно, помимо определения межплоскостных расстояний в кристалле, изучать положение легких атомов в решетке, чего нельзя сделать при помощи рентгеновского излучения, слабо рассеивающегося легкими атомами.
Метод дифракции нейтронов. Для получения пучка нейтронов необходим атомный реактор, поэтому данный метод используется сравнительно редко. При выходе из реактора пучок значительно ослаблен, поэтому необходимо использовать широкий пучок и соответственно увеличивать размер образца. Преимуществом метода является возможность определения пространственного положения атомов водорода, что невозможно сделать другими дифракционными методами.
Рис. 4. Распределение электронной плотности (о) и структура (б) кристалла с ковалентной связью (алмаз)
Спектроскопические методы
Спектроскопия изучает спектры электромагнитного излучения, испускаемого, поглощаемого или рассеиваемого исследуемым веществом. Электромагнитное излучение характеризуется либо энергетическими, либо волновыми параметрами. По диапазонам излучаемых длин волн различают гамма-спектроскопию, рентгеновскую, оптическую и радиоспектроскопию. Оптическая спектроскопия, в свою очередь, подразделяется на спектроскопию видимого, инфракрасного и ультрафиолетового излучения. Каждому виду электромагнитного излучения соответствует какой-то определенный атомный или молекулярный процесс.
Гамма-спектроскопия. Наиболее коротковолновое γ-излучение характеризуется волновым числом 1010 см-1.
Рентгеноспектроскопия. Рентгеновское излучение характеризуется волновыми числами 109... 107 см-1. Оно возникает в результате бомбардировки вещества электронами высокой энергии либо при жестком рентгеновском облучении. При этом происходит вырывание электронов из внутренних электронных слоев, на освободившееся место переходят электроны из более далеких от ядра слоев, что сопровождается испусканием квантов характеристического рентгеновского излучения. Частота рентгеновского излучения элемента линейно связана с его атомным номером. Рентгеноспектральный анализ используется для качественного и количественного определения химического состава вещества.
Различают флуоресцентный рентгеноспектральный анализ, в котором для возбуждения рентгеновского спектра используется рентгеновское излучение, и микрорентгеновский анализ, в котором рентгеновский спектр генерируется пучком электронов. Флуоресцентный рентгеновский анализ широко применяется в заводских лабораториях, он дает возможность быстро получить точные данные о химическом составе контролируемого объекта и использовать их для автоматического регулирования технологического процесса. Микрорентгеноспектральный анализ проводят при помощи электронного зонда, который дает возможность исследовать состав вещества в точке, определить характер микровключений и дать им качественную оценку.
Оптическая спектроскопия. Метод используется для характеристики молекулярных процессов. В молекуле происходят переходы внешних электронов — ультрафиолетовое и видимое излучение (106... 104 см-1), колебания атомов в молекулах - ближнее инфракрасное излучение (103 см-1) и вращение самих молекул — дальнее инфракрасное излучение (102 см-1). Излучение электронных переходов с помощью видимого и ультрафиолетового излучений дает возможность определить энергетические характеристики молекул - энергию возбуждения, ионизации и химической связи.
Колебательные спектры исследуются с помощью инфракрасного излучения. По ним можно установить пространственное строение группировок и молекул, охарактеризовать природу химической связи и ее полярность. Колебательный спектр молекулы определяет главным образом массы колеблющихся атомов и их группировок
Колебания атомов в молекуле могут происходить вдоль линии связи (валентные колебания) и под прямым углом к линии связи (деформационные колебания). Валентные колебания характеризуют жесткость химической связи, деформационные - жесткость валентных углов.
Колебания группы атомов зависят от координационного числа центрального иона и от типа координационного многогранника. По мере усложнения комплексов наблюдается сдвиг максимумов поглощения в коротковолновую область. Так, например, у островных силикатов максимумы поглощения лежат в более длинноволновой области, чем у цепочечных, ленточных, слоистых силикатов (рис. 5).
Интенсивность поглощения связана с концентрацией вещества, поэтому ИК-спектры можно использовать также для количественного определения содержания данного вещества в смеси.
Рис. 5. ИК-спектры островного (1), цепочечного (2), ленточного (3) и слоистого
(4) силикатов
Радиоспектроскопия. При помощи самых длинных волн (радиоволн), которые характеризуются волновым числом (10...15)-3 см-1, можно регистрировать спиновые переходы ядер и электронов.
Термография
Термография является одним из наиболее широко применяемых методов физико-химического анализа. Большинство химических и физических процессов, протекающих в данном веществе или системе, сопровождается поглощением или выделением теплоты, кроме того, в процессе нагрева изменяются линейные размеры, масса, электрическая проводимость и некоторые другие параметры. Термический анализ широко применяется при построении диаграмм состояния вещества. Сущность термического анализа заключается в определении температур, при которых изменяется физическое состояние или химический состав вещества (системы). При термическом анализе регистрируются изменение энергии (дифференциальный термический анализ), массы (термогравиметрический анализ), линейных размеров (дилатометрия), электрической проводимости. Наиболее часто используются дифференциальный термический анализ (ДТА) и термогравиметрический анализ (ТГ). В последнее время широкое распространение получила дериватография, включающая одновременное снятие кривых ДТА, ТГ и дифференциальной потери массы (ДТГ). По эндо- и экзотермическим эффектам на кривых ДТА можно судить о том, какие процессы протекают в системе. Поглощение теплоты при нагревании (эндотермические процессы) связано с процессами разложения вещества с выделением газовой фазы, разложения вещества без выделения газовой фазы, энантиотропного полиморфного превращения, плавления вещества. Выделение теплоты (экзотермические процессы) вызывается реакциями, сопровождающимися поглощением газовой фазы (окислением), полиморфными превращениями монотропного характера, переходом неустойчивых фаз в устойчивые (переход коллоидов и стекол в кристаллическое состояние), кристаллизацией расплава; реакциями образования веществ в твердой фазе.
Электронная микроскопия
Современные электронные микроскопы дают полезное увеличение в 300 000 раз и имеют разрешающую способность (2... 5)х10-!0 м, что позволяет исследователям наблюдать объекты, не различимые в обычном световом микроскопе. Метод электронной микроскопии позволил установить, что многие вещества, считавшиеся ранее аморфными, состоят из мельчайших кристаллов. Методы исследования при помощи электронного микроскопа делятся на прямые и косвенные.
Основные правила построения ионно-ковалентных структур.
Структуру кристаллов со свойствами составляющих их атомов, впервые связал В. М. Гольдшмидт, который особое значение придавал размеру ионных радиусов.
Л. К. Полинг сформулировал несколько правил построения структур ионных кристаллов.
Первое из этих правил является уточнением правила Гольдшмидта о связи координации ионов с их ионными радиусами и гласит, что каждый катион окружен анионами, находящимися в вершинах координационного полиэдра (многогранника) - рис. 6.
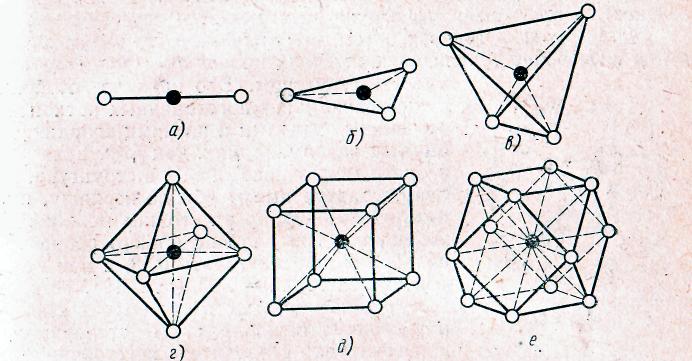
Рис. 6. Координационные многогранники:
A –гантель (КЧ - 2); б – треугольник (КЧ -3); в – тетраэдр (КЧ - 4);
г – октаэдр (КЧ-6); д – куб (КЧ-8); е – кубооктаэдр (КЧ -12)
Расстояние между центрами катиона и соседнего аниона определяется суммой ионных радиусов, а координационное число (КЧ) — их отношением (гк : rа).
Второе правило — правило электростатической валентности — гласит, что в устойчивой ионной структуре сумма сил электростатических связей, соединяющих анион с окружающими его катионами, равна заряду аниона; при этом силой связи 5 называется отношение заряда катиона к числу окружающих его анионов. Сила связи катиона различна при изменении его координационного числа.
Третье правило говорит о том, что наличие в структуре общих ребер и особенно граней двух соседних полиэдров снижает устойчивость структуры. Это правило особенно существенно для многозарядных катионов с большими зарядами и низкими координационными числами, таких как Si+4.
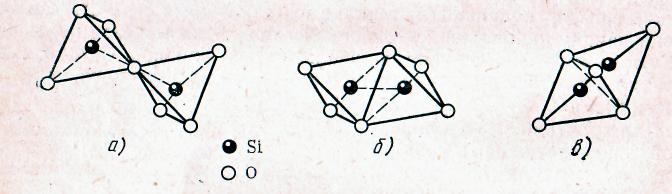
Рис. 7. Различные способы соединения кремнекислородных тетраэдров:
а — вершинами (устойчивая система); б — ребрами; в — гранями (неустойчивые системы)
Четвертое правило гласит, что если в структуре существует несколько видов катионов, то катионы с малыми координационными числами, но с более высоким зарядом стремятся к такой упаковке, чтобы их координационные полиэдры имели бы минимальное количество общих вершин.
Пятое правило является правилом экономичности: химически идентичные ионы обычно имеют одинаковые координационные полиэдры и координационные числа в структуре.
Два последних правила не имеют такой универсальности, как предыдущие.
Согласно принципу минимума потенциальной энергии каждый атом стремится взаимодействовать с максимально большим числом других атомов. Это приводит к образованию плотнейших упаковок.
Анализируя структуры, сложенные из различных атомов, Н. В. Белов показал, что к ним может быть приложен принцип плотнейшей упаковки. Пользуясь системами ионных радиусов, можно рассматривать геометрические возможности «заселения» пустот в упаковке анионов катионами. Эти возможности определяются пределами соотношений ионных радиусов, соответствующих тетраэдрической или октаэдрической координации. Однако в ионных структурах размеры катионов очень часто оказываются больше, чем нужно, из чисто геометрических соотношений, и они как бы раздвигают анионы.

Рис. 8. Плотнейшие шаровые упаковки:
а — кубическая; б— гексагональная
Вопросы:
1. Какие методы изучения структуры кристаллических веществ Вы знаете?
2. Назовите правила построения ионно-ковалентных структур.
Lecture № 4.
Theme: a crystal condition of silicate materials. Methods of study of structure of crystal substances. The basic rules of construction ionic-covalent of structures.
1. Silicate in crystal condition.
2. Methods of study of structure of crystal substances.
3. Basic rules of construction ionic-covalent of structures.
ДТА - differential thermal analysis
ТГ - thermogravimetric the analysis
Diffracting methods
To diffracting to methods of research of structure concern roentgenography, electronography and neutronography. The methods are based on use of radiations with length of a wave, commensurable with distance between structural elements of crystals. Passing through a crystal, beams дифрагируют, arising diffracting the picture strictly corresponds(meets) to structure of researched substance.
Method diffraction of x-ray radiation.
The development X-ray diffraction analysis began from famous experience of m. Laye (1912), shown, that a bunch(beam) of x-ray radiation, passing
Through a crystal, tests diffraction, and the symmetry, distribution diffraction, of maxima corresponds(meets) to symmetry
Crystal. Diffraction, maxima arise in all directions adequate(answering) the basic law X-ray diffraction analysis to the equation Vulf-Bregg
Diffraction the methods can conditionally be divided(shared) into two groups: 1) corner of fall of a beam on a crystal constant, and length of radiation varies; 2) length of a wave constant, and the corner of fall varies.
The method Laye, consisting concerns to methods of the first group that polychromatic the x-ray radiation is directed on a motionless monocrystal, behind which the film settles down. From set of lengths of waves available in polychromatic radiation, always there will be such wave, which satisfies to conditions of the equation Vulf-Bregg. The method Laye enables to reveal symmetry of a crystal. The methods of rotation of a monocrystal and polycrystalline sample concern to methods of the second group. In a method of rotation of a monocrystal
monochromatic the beam is directed on a monocrystal rotating around of an axis, normal to a direction of a beam. Thus the various planes of a crystal get in a rule(situation) appropriate to conditions diffraction, that results in education appropriate diffraction of a picture. By measurement of integrated intensity and definition of a set of structural amplitudes it is possible to decipher structure of a crystal.
At study of polycrystalline materials the sample is shined(covered) монохроматическим by radiation. In set of arbitrary focused crystals always there will be such, which orientation answers the equation Вульфа-Брэгга. The reflected beam is registered by a photoway (fig. 2) either ионизационными or сцинтилляционными by counters, the signal through system of amplifiers and пересчетных of devices moves on потенциометр, writing down a curve of distribution of intensity (fig. 3). On an arrangement дифракционных of maxima judge geometry of a lattice, and on their intensity - about distribution of electronic density, т. е. About probability of a presence(finding) электронов in this or that point of a crystal (fig. 4). The distribution of electronic density enables to define(determine) not only rule(situation) of atoms in a lattice, but also type of chemical communication(connection). The high-temperature prefixes to дифрактометрам allow to register polymorphic transformations at heating, to watch(keep up) for твердофазовыми by reactions.
Рентгенография gives also opportunity to study defects in crystals.
Output(exit) of a beam; 4 - area of small corners 9
Fig. 2. Shooting o рентгенограммы of polycrystalline samples by a method of photoregistration:
Fig. 3. Рентгенограмма of quartz received on installation with сцинтилляционным by a method of registration
Method дифракции электронов (электронография). The method is based that at interaction with an electrostatic field of atoms there is a dispersion of a bunch(beam) электронов. As against x-ray, the electronic radiation can penetrate only on small depth therefore researched samples should look like thin пленок. With the help электронографии it is possible, besides definition межплоскостных of distances in a crystal, to study a rule(situation) of easy atoms in a lattice, that cannot be made through x-ray radiation poorly dissipating by easy atoms.
Method дифракции of neutrons. For reception of a bunch(beam) of neutrons is necessary nuclear реактор, therefore given method is used rather seldom. At an output(exit) from реактора the bunch(beam) is considerably weakened, therefore it is necessary to use a wide bunch(beam) and accordingly to increase the size of a sample. Advantage of a method is the opportunity of definition of a spatial rule(situation) of atoms of hydrogen, that it is impossible to make by others дифракционными by methods.
Fig. 4. Distribution of electronic density (о) and structure (б) of a crystal with ковалентной by communication(connection) (diamond)
Спектроскопические methods
Спектроскопия studies spectra of electromagnetic radiation which is let out, absorbed or рассеиваемого by researched substance. The electromagnetic radiation is characterized either power, or wave parameters. On ranges излучаемых of lengths of waves distinguish scale - спектроскопию, x-ray, optical and радиоспектроскопию. Optical спектроскопия, in turn, is subdivided on спектроскопию seen, infra-red and ultra-violet radiation. To each kind of electromagnetic radiation there corresponds(meets) any certain nuclear or molecular process.
Scale - спектроскопия. Most short-wave? The radiation is characterized by wave number 1010 см-1.
Рентгеноспектроскопия. The x-ray radiation is characterized by wave numbers 109... 107 см-1. It results from bombardment of substance электронами of high energy or at a rigid x-ray irradiation. Thus occurs вырывание электронов from internal electronic layers, to the released(exempted) place pass электроны from layers, farther from a nucleus, that is accompanied испусканием of quantums of characteristic x-ray radiation. The frequency of x-ray radiation of an element is linearly connected to his(its) nuclear number(room). Рентгеноспектральный the analysis is used for qualitative and quantitative definition of chemical structure of substance.
Distinguish fluorescent рентгеноспектральный the analysis, in which for excitation of a x-ray spectrum the x-ray radiation is used, and the microx-ray analysis, in which x-ray spectrum is generated by a bunch(beam) электронов. The fluorescent x-ray analysis is widely applied in factory laboratories, he enables quickly to receive the exact data on chemical structure of controllable object and to use them for automatic control of technological process. Микрорентгеноспектральный the analysis spend through an electronic probe, which enables to investigate structure of substance in a point, to define(determine) character of microinclusions and to give them a qualitative estimation.
Optical спектроскопия. The method is used for the characteristic of molecular processes. In a molecule there are transitions external электронов - ultra-violet and seen radiation (106... 104 см-1), fluctuation of atoms in molecules - near infra-red radiation (103 см-1) and rotation of molecules - distant infra-red radiation (102 см-1). The radiation of electronic transitions with the help of seen and ultra-violet radiations enables to define(determine) the power characteristics of molecules - energy of excitation, ionization and chemical communication(connection).
The oscillatory spectra are investigated with the help of infra-red radiation. On them it is possible to establish a spatial structure of groupings and molecules, to characterize a nature of chemical communication(connection) and its(her) polarity. The oscillatory spectrum of a molecule defines(determines) mainly weights of varying atoms and their groupings
The fluctuations of atoms in a molecule can occur along the communication line (валентные of fluctuation) and under a direct corner to the communication line (деформационные of fluctuation). Валентные of fluctuation characterize rigidity of chemical communication(connection), деформационные - rigidity валентных of corners.
The fluctuations of group of atoms depend on coordination number of the central ion and from a type coordination многогранника. In process of complication of complexes the shift of maxima of absorption in short-wave area is observed. So, for example, at island силикатов maxima of absorption lay in more длинноволновой of area, than at chained, tape, layered силикатов (fig. 5).
The intensity of absorption is connected to concentration of substance, therefore Ик-spectra can be used also for quantitative definition of the contents of the given substance in a mix.
Fig. 5. Ик-spectra island (1), chained (2), tape (3) and layered
(4) силикатов
Радиоспектроскопия. Through the longest waves (radiowaves), which are characterized by wave number (10... 15) -3 см-1, it is possible to register spin transitions of nucleuses and электронов.
Термография
Термография is one of most widely used methods of the физико-chemical analysis. The majority of chemical and physical processes proceeding in the given substance or system, is accompanied by absorption or allocation of heat, besides during heating the linear sizes, weight, electrical conductivity and some other parameters change. The thermal analysis is widely applied at construction of the diagrams of a condition of substance. The essence of the thermal analysis consists in definition of temperatures, at which the physical condition or chemical structure of substance (system) changes. At the thermal analysis are registered change of energy (differential thermal analysis), weight (термогравиметрический the analysis), linear sizes (дилатометрия), electrical conductivity. Most often are used the differential thermal analysis (ДТА) and термогравиметрический the analysis (ТГ). Recently wide circulation has received дериватография, including simultaneous removal of curves ДТА, ТГ and differential loss of weight (ДТГ). On эндо- and экзотермическим the effects on curves ДТА can judge what processes proceed in system. The absorption of heat at heating (эндотермические processes) is connected to processes of decomposition of substance with allocation of a gas phase, decomposition of substance without allocation of a gas phase, энантиотропного of polymorphic transformation, плавления of substance. The allocation of heat (экзотермические processes) is caused by reactions accompanying with absorption of a gas phase (oxidation), polymorphic transformations монотропного of character, transition of unstable phases in steady (transition коллоидов and glasses in a crystal condition), кристаллизацией расплава; by reactions of education of substances in a firm phase.
Electronic микроскопия
Modern electronic микроскопы give useful increase in 300 000 times and have resolution (2... 5) х10-! 0 м, that allows the researchers to observe objects, not distinct in usual light микроскопе. The method electronic микроскопии has allowed to establish, that many substances considered earlier аморфными, consist of smallest crystals. The methods of research through electronic микроскопа are divided on direct and indirect.
The basic rules of construction ионно-ковалентных of structures.
Structure of crystals with properties of atoms, making them, for the first time has connected In. M. Гольдшмидт, which gave the special meaning(importance) to the size ионных of radiuses.
Л. To. Полинг has formulated some rules of construction of structures ионных of crystals.
First of these rules is specification of a rule Гольдшмидта about communication(connection) of coordination of ions from them ионными in radiuses and says, that everyone катион is surrounded анионами, taking place in tops coordination полиэдра (многогранника) - fig. 6.
Fig. 6. Coordination многогранники:
A - гантель (КЧ - 2); - triangle (КЧ -3); in - тетраэдр (КЧ - 4);
г - октаэдр (КЧ-6); д - cube (КЧ-8); е - кубооктаэдр (КЧ -12)
Distance centre to centre катиона and next аниона is defined(determined) by the sum ионных of radiuses, and coordination number (КЧ) - their attitude(relation) (гк: rа).
The second rule - rule of electrostatic valency - says, that in steady ионной the sum of forces of electrostatic communications(connections) connecting анион with environmental it(him) катионами, is equal to structure to a charge аниона; thus as force of communication(connection) 5 the attitude(relation) of a charge катиона to number environmental it(him) анионов is called. The force of communication(connection) катиона is various at change of his(its) coordination number.
The third rule speaks that the presence in structure of general(common) edges and is especial of sides two next полиэдров reduces stability of structure. This rule is especially essential for многозарядных катионов with the large charges and low coordination numbers, such as Si+4.
Fig. 7. Various ways of connection кремнекислородных тетраэдров:
а - tops (steady system); - edges; in - sides (unstable systems)
The fourth rule says, that if in structure there are some kinds катионов, катионы with small coordination numbers, but with higher charge aspire to such packing, that their coordination полиэдры would have a minimum quantity of general(common) tops.
The fifth rule is a rule of profitability: the chemically identical ions usually have identical coordination полиэдры and coordination numbers in structure.
Last two corrected have no such universality, as previous.
According to a principle of a minimum of potential energy each atom aspires to cooperate with the maximum large number of other atoms. It results in education of most dense packings.
Analyzing structures combined from various atoms, Н. In. Белов has shown, that the principle of most dense packing can be enclosed to them. Using systems ионных of radiuses, it is possible to consider(examine) geometrical opportunities of "settling" of emptiness in packing анионов катионами. These opportunities are defined(determined) by limits of parities(ratio) ионных of radiuses appropriate тетраэдрической or октаэдрической to coordination. However in ионных structures the sizes катионов very much often appear more, than it is necessary, from only geometrical parities(ratio), and they as though move apart анионы.
Fig. 8. Most dense spherical packings:
а - cubic; гексагональная
Questions:
2. Name rules of construction ионно-ковалентных of structures.
1. What methods of study of structure of crystal substances you know?
Lecture № 5.
Theme: defects of a crystal lattice in knitting materials. Classification of defects. Dot nuclear defects in ионных crystals. Defects on Я.И.Френкелю and В.Шоттки. Firm solutions. Linear defects (дислокации).
1. Defects of a crystal lattice.
2. Firm solutions.
3. Defects on YA.I.Phrenkel and B.Shottki.
4. Linear defects (dislocation).
Defects - distortion or infringement.
Firm solutions - homogeneous crystal phases of variable structure.
DEFECTS of a CRYSTAL LATTICE
In a lattice of an ideal crystal atoms (ions) settle down in space strictly is ordered and naturally, and электроны should be at levels with the minimal energy. In real crystals there are various distortions or infringements of this ideal arrangement of particles, which usually name by defects of a crystal lattice.
The nature of defects can be various and reaches from microlevel(electronic, nuclear) up to defects in microvolumes of substance. Depending on the size of that area disorder(area of distortions of a lattice), which is borrowed(occupied) by(with) those or other defects, they can be classified to an only geometrical attribute - "dimensions" of defect ("dimension" - number of measurements, on which the defect has macroscopic extent). On this classification the defects of a crystal lattice divide(share) on zero-dementional (dot), one, two and three-dimensional. Zero-dementional defects as a first approximation borrow(occupy) in a crystal area of distortions, commensurable on all directions with the size of atom or electron. The one-dimensional defects have extent considerably superior the size of atoms in any one direction (in other directions they zero-dementional), two demensions- in two and three-dimensional - in three directions.
Zero and the one-dimensional defects concern to microdefects or to defects of thin structure of a crystal. Zero-dementional the defects can be divided (shared) on electronic and nuclear. To electronic defects belong superfluous electrons, hole and exitons. To atomic zero-dementional to defects (fig. 9) the vacancies, impurity atoms replacing own atoms of substance in their regular rule (in lattice site), and own or impurity atoms which are taking place (displaced by) in irregular position irregular a rule(situation) in interstitial site of a lattice (of a particle, taking place in interstitial site, sometimes name interstitial site or interstitial). To one-dimensional nuclear defects concern regional and screw dislocation.
Two and the three-dimensional defects belong to macrodefects or defects of rough structure. Examples two demensions of defects are so-called mosaic structure of crystals, border of grains, the defects of packing, three-dimensional -pore, crack in a crystal, inclusion in him(it) of other phase and other infringements of integrity of a crystal.
Fig. 9. Types nuclear нульмерных of defects:
1- vacancies; 2 - примесный atom in unit of a lattice; 3 -примесный atom in междоузлии
The large meaning(importance), which is given to study of defects of a crystal lattice in physics of a firm body, is caused by their huge influence on properties of crystal substances. Besides the defects render often decisive influence on such processes, as growth of crystals, mass transport (diffussion) in firm bodies determining kinetics such important in technology silicates and other refractory not metal materials of processes, as powder (solid) phase of reaction, sintering, recrystallization and e. c.
As it was already marked, to nuclear нульмерным or dot defects the vacancies, примесные atoms in regular units concern lattices and примесные atoms, дислоцированные in междоузлиях. These the types of defects basically can meet in a lattice of crystals separately, but more often they are present at a combination with each other. Depending on it distinguish the following types nuclear нульмерных of defects: firm solutions (switching defect nonstoichiometry), defects on Шоттки and defects on Френкелю.
Firm solutions
By firm solutions the homogeneous crystal phases of variable structure name.
The firm solutions of the certain structure represent one crystal phase, which structure in the certain limits (in so-called area гомогенности) can change without occurrence of new phases. Distinguish some types of firm solutions (fig. 10). Two types firm solutions of replacement (firm solutions I of a sort) and firm solutions of introduction (firm solutions II of a sort) are formed at introduction in a lattice ("dissolution" in a lattice) any of crystal connection of atoms or ions of other connection. And at education of firm solutions of replacement the "own" atoms of the basic substance (matrix) are replaced on taking root atoms, and at education of firm solutions of introduction these atoms settle down in междоузлиях of a lattice of matrix substance. The third type of firm solutions is not connected to introduction in a lattice of extraneous atoms or ions, and is caused by a deviation(rejection) in the certain limits of structure of the given connection from it(him) стехиометрического of structure. Such firm solutions are called as defects нестехиометрии (for some of them sometimes use the name firm solutions of subtraction).
-
Fig. 10. Types of firm solutions: and - replacement; - introduction; in - subtraction
The firm solutions are not any exclusive phenomenon. On the contrary, this rather characteristic condition of real substances, as does not exist of substances absolutely insoluble in each other in a firm condition. Precisely as practically there are no connections with coordination lattices, which structure always precisely would correspond(meet) стехиометрическому to structure.
Firm solutions of replacement. If atoms or the ions of one substance, taking root in a lattice of other substance, replace his(its) own atoms or ions in units of a lattice, there are firm solutions of replacement.
As firm solutions of replacement such solutions are called which are formed as a result of statistical replacement of atoms or ions in structure any of crystal substance (solvents or matrixes) atoms or ions of other (dissolved) substance borrowing(occupying) as a result of it regular units of a crystal lattice.
The firm solutions of replacement (fig. 10, а) often name also by mixed crystals and изоморфными by mixes, and process of education of firm solutions of replacement name изоморфным by replacement.
At education of firm solutions of replacement basically to replace each other can both катионы, and анионы.
Some substances can form firm solutions rather easily, for example at their joint кристаллизации of solutions. However more often, for example in силикатных systems, educations of firm solutions need significant energy of activation, therefore their occurrence is connected to various thermal processes (heating to high temperature, плавлением with subsequent кристаллизацией, гидротермальными by processes).
The quantity(amount) of extraneous atoms or ions which are taking root in structure of the basic substance, can be various. Some substances can mix up among themselves over a wide range, down to complete replacement of own atoms with atoms of other substance. In this case speak about a continuous number(line) of firm solutions, complete смешиваемости or accomplished(perfect) изоморфизме. To such substances, for example, the forming continuous firm solutions - оливины concern 2МgO·SiO2 and 2FеО-SiO2. And in structure 2FеО·SiO2 катионы of iron can be completely replaced on катионы магния and, on the contrary, in structure 2МgO·SiO2 катионы магния on катионы of iron (replacement such as Мg2 +-Fе2 +). Replacements quantitatively however are much more often can occur only in the certain limits, outside of which the firm solutions are not formed any more. In this case speak about the limited number(line) твер д ы х of solutions limited смешиваемости or imperfect изоморфизме (at very small solubility education of firm solutions name эндокриптией - masking).
Ability of atoms or ions to enter into structure of other substance is defined(determined), on the one hand, by individual properties of atoms or ions (size, charge, electronic structure) and, on the other hand, by features of crystal structure of substances forming firm solutions.
Firm solutions of introduction. The atoms or ions of one substance can not replace atoms or ions another, and to settle down in intervals between them (fig. 10, б). In this case there are firm solutions of introduction.
As firm solutions of introduction such solutions are called which are formed as a result of introduction of atoms or ions of one substance in free intervals (междоузлия) of a crystal lattice of other substance - solvent.
The typical representatives of similar firm solutions are the so-called phases of introduction - connections formed at introduction in междоузлия плотноупакованных of lattices of transitive metals of atoms неметаллов, for example of hydrogen (гидриды), nitrogen (нитриды), carbon (карбиды) and т. д. A concrete example of a phase of introduction is the steel - firm solution of introduction of carbon in a lattice of iron. The phases of introduction of variable structure often have significant areas гомогенности.
It is necessary to note, that the firm solutions of introduction as against firm solutions of replacement can be only limited, as it is usual at the certain concentration растворяющегося of a component of a pressure(voltage) in a lattice at the expense of taking root atoms become so significant, that the existence of a steady firm solution is poorly probable.
Many properties of phases of introduction, such, for example, as high hardness and тугоплавкость, exceeding these characteristics at metals, are caused strong ковалентной by communication(connection) of atoms of metal and неметалла with participation -электронов. The presence of metal internuclear communication(connection) in similar phases explains their metal shine, high electrical conductivity, ability of some of them near to temperature of absolute zero to pass in сверхпроводящее a condition.
Defects нестехиометрии. Now is established, that practically all chemical connections in a firm condition with coordination (nuclear, ионными or metal) lattices have variable structure, т. е. Find out to some extent deviations(rejection) from стехиометрического of structure expressed by the formula of this connection. The area of structures laying inside boundary meanings(importance) of infringement стехиометрического of structure, is called as area гомогенности or area нестехиометрии. Constant and constant chemical structure appropriate стехиометрической to the formula, can have only connections with molecular lattices.
The deviations(rejection) from стехиометрии are a consequence of defects of a lattice (defects нестехиометрии), which can be shown as surplus (in comparison with стехиометрическим) катионов owing to анионных of vacancies (КС1, ТhO2, СеO2, РbО, ТiO and т. д.) or as a result of presence катионов in междоузлиях of a lattice (ZnО, СdO and т. д.), surplus анионов because of presence in a lattice катионных of vacancies (FеО, NiO, FеS, ТiO and т. д.) or presence анионов in междоузлиях (UO2 and т. д.). The combinations of the specified kinds of defects in the same connection are possible(probable) also.
As нестехиометрические of connection within the limits of area гомогенности represent one phase of variable structure, they can be qualified as firm solutions. If the infringements стехиометрии are called by presence in a lattice катионных or анионных of vacancies, т. е. At lack of atoms in appropriate катионной or анионной подрешетке, such firm solutions sometimes name by firm solutions of subtraction (fig. 10, е), if these infringements are called by surplus катионов or анионов in междоузлиях, such firm solutions can be considered(examined) as firm solutions of introduction own катионов or анионов of the given connection in his(its) crystal lattice.
The occurrence нестехиометрических of connections is a consequence термодинамически of an inevitable exchange of substance of the given crystal phase with an environment, т. е. By other phases (газообразными, liquid or firm). The degree of a deviation(rejection) from стехиометрии depends first of all on a физико-chemical nature of the connection and for different connections is various. Sometimes area гомогенности (area нестехиометрии) happens rather narrow and its(her) detection is limited to unsufficient sensitivity of used methods of research. Such connections can conditionally be considered(examined) as connection not having areas гомогенности, т. е. Connections of constant structure. Them sometimes name by linear phases, as on the diagram of a condition the structure of these connections is displayed by a vertical line - ordinate of the appropriate structure.
Defects on Шоттки and Френкелю
The defects on Шоттки and Френкелю concern to the thermal equilibrium defects connected to a disorder arrangement in a lattice of a crystal of "own" particles (of atoms or ions). Such arrangement arises, if the particle leaves(abandons) the regular rule(situation) in unit of a lattice, leaving his(its) free (vacant). There are two opportunities of education of defects in a lattice at the expense of moving particles from its(her) units. One of them was постулирована I. And. Френкелем, another - In. Шоттки.
The atom or ion can move from unit of a lattice, leaving there vacancy, in междоузлие, removed from unit on some distance.
Such defect as pair vacancy - междоузельный atom (ion) is called as defect on Френкелю (fig. 11, а). If atom (ion) leaves(abandons) unit of a lattice, leaving in him vacancy, and leaves for limits of a lattice on a surface of a crystal, completing her(it), in a lattice there are only vacancies. Such type of defect as free (vacant) units of a lattice is called as defect on Шоттки (fig. 11,6).
The basic reason of education of defects on Френкелю and Шоттки are the thermal fluctuations of atoms (ions). The average amplitude of fluctuation of atoms at usual temperatures is rather small (? 5... 10 % from size of the period of a lattice).
Fig. 11. The schematic image of defects on Френкелю (а) and on Шоттки (б) (in - ideal lattice)
However atoms in a lattice make thermal fluctuations not strictly in coordination, therefore even in these conditions at the expense of power флуктуации one of atoms can receive from next energy, sufficient for his(its) output(exit) from unit of a lattice. Especially this process occurs at the raised(increased) temperatures, at which the amplitude of fluctuation of atoms strongly grows. Thus, any crystal which is taking place at temperature, distinct from absolute zero, will contain always certain number of the specified thermal defects.
For education of defects on Френкелю and Шоттки the certain expenses of energy (energy of activation of process of education of defect) are required, however it is accompanied by increase энтропии at the expense of increase of a degree разупорядоченности of a lattice, that causes reduction of energy Гиббса. Hence, the education of similar defects appears energetically favourable and results in increase of stability of a crystal. From here follows, that the thermal defects on Френкелю and Шоттки are equilibrium and to each temperature there corresponds(meets) their certain equilibrium concentration in a crystal.
From the given equations follows, that the equilibrium concentration of defects on Шоттки and Френкелю is экспоненциальной function of temperature and energy of activation. Increase of temperature and accordingly reduction of energy of activation result in increase of equilibrium concentration of defects.
The energy of activation of process of education of dot defects depends on their type, chemical nature of substance and his(its) structure, therefore, though at a lattice of any not molecular crystal there are simultaneously all kinds of dot defects, one of them (with smaller energy of activation) usually prevail above others. The energy of education of defects on Шоттки with other things being equal is less, than defects on Френкелю, as accommodation of atom in междоузлии requires(demands) usually significant power expenses
For example, the defects on Френкелю will arise more easy in crystals with structure having large emptiness, or then, when the sizes аниона and катиона strongly differ, as all this facilitates accommodation катионов in междоузлиях.
Defects on Френкелю in the pure state, т. е. When the number of vacancies is equal to number межузельных of atoms, can take place only in crystals стехиометрического of structure, in real crystals with coordination lattices it, as a rule, is not observed. The defects on Шоттки can arise at the expense of education both катионных, and анионных of vacancies. In ионных crystals often there is energetically to more favourable an education of pairs vacancies, т. е. The education of vacant unit on a place катиона and аниона, as thus is more easy saved an electroneutrality of a surface of a crystal and lattice as a whole. However basically it is not necessary and in real crystals equality thermal катионных and анионных of vacancies can and not be observed.
The dot nuclear defects in a crystal lattice have the certain properties. For example, the vacancies in ионных crystals act by carriers of a charge, and катионная the vacancy bears(carries) negative, and анионная - a positive charge. Certainly, actually charge in vacancy does not contain, but electrical field, arising around of it,(her,) same, what would arise, if in vacancy the charge, on meaning(importance) equal settled down, and on a mark opposite to a charge of an ion, which has left(abandoned) given unit of a lattice. Any dot defects have ability to migration (диффузии) in a crystal lattice as a result of thermal флуктуации or application to a crystal of an external electrical field. For example, катион in междоузлии can pass at the appropriate excitation in next междоузлие, vacancy мигрируют at the expense of moving the next ion to vacant unit, т. е. By a consecutive exchange of positions between ions and vacancies (at such so-called вакансионном the mechanism диффузии the moving of vacancies in one direction is equivalent to moving of ions in the friend). The dot defects can cooperate with each other, forming in the elementary case ассоциаты - defects borrowing(occupying) next кристаллографические of a position. For example, in a lattice there can be connected groups of vacancies (кластеры). The connected pairs vacancies are capable диффундировать faster, than the isolated vacancies, and threefold кластеры are even faster.
The presence in crystals of dot defects on Шоттки and Френкелю renders essential influence on many properties of crystal ph. In particular, their presence at a crystal and ability to migration cause ионную electrical conductivity and processes массопереноса (диффузии) in a crystal lattice (in бездефектном an ideal crystal the process массопереноса practically is impossible). In this connection the presence of dot defects strongly accelerates such important in technology силикатов and refractory not metal materials processes, as твердофазовые of reaction, sintering, рекристаллизацию and т. д., which speed is defined(determined) by speed диффузии of material particles. The education of defects on Шоттки results in increase of volume of a crystal (crystal as though "swells" for the bill достраивания from a surface by atoms excluded from units of a lattice) and downturn of his(its) density (education of defects on Френкелю anyway as a first approximation does not result in change of density).
Дислокации
Дислокации concern to linear defects of a lattice, т. е. To imperfections covering in a crystal area, which extent in one direction considerably surpasses the size of atoms or ions. On character of distortions of a lattice дислокации are divided in the pure state on regional (linear) and screw. In real crystals дислокации often represent a combination regional and screw дислокаций. Such дислокации are called mixed. Дислокации are a source of internal pressure(voltage) in crystal bodies, they create even in free from external loadings a crystal a field of deformations and pressure(voltage).
One of the basic concepts of the theory дислокаций is the concept of a line дислокации. As a line дислокации that imagined line in a crystal is called, along which (in its(her) small vicinity) the maximal distortions of a lattice concentrate. Actually at occurrence дислокации the crystal lattice remains undistorted everywhere, except for area directly environmental a line дислокации. The line дислокации not necessarily should be a straight line, and can have excesses, step, т. е. Any form. The feature of this line consists that she never comes to an end (breaks) in a crystal, and leaves on his(its) surface, becomes isolated on itself, forming a loop, or becomes isolated on other lines дислокации.
Regional дислокация. An attribute regional дислокации is the presence in one part of a crystal superfluous ("torn off" or "unfinished") nuclear plane (полуплоскости or экстраплоскости), not having continuations in other part of a crystal (fig. 12, экстраплоскость is specified by an arrow(pointer)).
The maximal distortions and pressure(voltage) in a lattice concentrate at presence regional дислокации along edges(territory) of a superfluous nuclear plane. This zone of the maximal pressure(voltage) limited to a dashed line in a fig. 13, is called as a nucleus дислокации.
Screw дислокация. An attribute screw дислокации is the transformation of parallel nuclear planes (in бездефектном a crystal) in a uniform nuclear plane as геликоидальной of a surface (like a screw plane) and presence on a surface of a crystal original дислокационной nuclear ступеньки (уступа).
1 .
Fig. 12. Model regional дислокации a Fig. 13. The circuit of education кра-
In a crystal евой дислокации
The schematic image screw дислокации is given in a fig. 16. Its(her) education can be imagined if mentally to make in a crystal a cut(section) (on a plane АВСD), and then at the expense of force Р to move one part of a crystal in this plane in relation to other part on one internuclear distance downwards so that one cut off edge(territory) of each nuclear plane of a lattice, perpendicular planes среза, has coincided with other cut off edge(territory) нижележащей of a plane of a lattice. The cut off surfaces can thus be connected absolutely precisely, then it is impossible to distinguish, on what plane inside кри сталла the cut(section) was made.
Fig. 14. The circuit of education screw дисло- a Fig. 15. The schematic image nuclear
кации of planes at screw дислокации
In other words, at presence screw дислокации nuclear planes of a lattice, as it was already marked, turn to similarity спиралевидной of a screw surface, whence and name - screw дислокация (fig. 15).
Questions:
1. What such defects of a crystal lattice?
2. What such firm solutions and what conditions of education of firm solutions of replacement and introduction?
3. Characterize defects on Я.И.Френкелю and In. Шоттки and why defects on Шоттки and Френкелю concern to термодинамически to equilibrium defects, in what the reason of their education and what factors render influence on their concentration in a crystal lattice?
4. Name kinds of linear defects.
5. What is a structural attribute of presence in a crystal lattice regional both screw дислокации and their qualitative and quantitative characteristic?
6. Describe the reasons of education and property дислокаций, methods of definition of their density and result meanings(importance) of this density in the perfect and deformed crystals.
Lecture № 6.
Theme: structure crystal силикатов. Development of representations about structure силикатов. Features of structures of knitting substances. Structural classification силикатов. Structure боридов, карбидов, нитридов and силицидов.
1. Structure crystal силикатов.
2. Development of representations about structure силикатов.
3. Feature of structures of knitting substances.
4. Structural classification силикатов.
5. Structure боридов, карбидов, нитридов and силицидов.
Structure силикатов - тетраэдр [SiO4]
Карборунд - карбид of silicon
Structure crystal силикатов
Силикаты and алюмосиликаты - most widespread minerals in terrestrial коре. They make more thirds of all minerals.
The majority natural силикатов has complex(difficult) structure and, as a rule, insolubly in water. This long time complicated an establishment of their structure. Therefore in a history of study силикатов it is possible clearly to allocate 5 stages.
The first stage is connected to only chemical study силикатов. In this перид the items of information on their structure collected. The empirical formulas силикатов entered the name as оксидов in ascending order of charge катиона. For example Na2O·Al2O3·6SiO2 - альбит, СaO·Al2O3·2SiO2 - анортит.
In a basis of classification силикатов the attitude(relation) of number of atoms of oxygen connected to silicon, to number of atoms of oxygen connected to others катионами was necessary. On this classification силикаты were divided on моно-, ди-, трисиликаты etc. So СaO·Al2O3·2SiO2 is моносиликатом, because the number of atoms of oxygen connected to silicon, is equal to number of atoms of oxygen connected with кальцием and aluminium (4). On similar accounts лейцит К2O·Al2O3·4SiO2 is дисиликатом, and альбит Na2O·Al2O3·6SiO2 - трисиликатом. Thus the substances, close on a nature, (field шпаты - альбит, ортоклаз, анортит) got in different classes, and various - in one of a class.
The second stage is connected to representation about силикатах, as about salts of hypothetical polysilicon acids - метакремниевой Н2SiO3, ортокремниевой Н4SiO4 and ортодикремниевой Н6Si2O7. However question on a structure силикатов and here remained unsolved.
The third stage in development силикатов is closely connected to a name of outstanding Russian scientist В.И.Вернадского (1863-1945г), which in 1891 has put forward idea about the special role of aluminium in силикатах, that has facilitated decoding their structures.
At the fourth stage of study силикатов was connected to successes of stereochemistry of complex connections. By analogy with четырехвалентной by platinum, which in complex connections has coordination number 6, the same coordination number attributed also to silicon. The structural formulas constructed on these principles, further have appeared incorrect.
The modern (fifth) stage of development of representations about structures силикатов is closely connected to successes рентгеноструктурного of the analysis. Leaning(basing) on rules of education ионных of crystals formulated Л.К. Полингом in 1929г., В.Л.Брегу and Ф.Махачки it was possible to decipher the first structures силикатов. Has appeared, that силикаты are not ионными crystals. A primary type of communication(connection) in силикатах is ионно-ковалентная communication(connection). Now are deciphered a structure and structure many complex(difficult) силикатов. The especially large merit in it belongs to the Soviet school кристаллографии, based акад. Н.В.Беловым.
Features of structures силикатов
In a basis of structure силикатов lays тетраэдр [SiO4] formed(educated) at sp3- гибридизации валентных электронов. The ions of oxygen тетраэдрически surround an ion of silicon and are on distance 1,62·10-10 м from him(it). Practically in all connections the silicon saves coordination number 4, as a parity(ratio) rк: rа = 0,39. At comparison of an ion [SiO4] 2- with others тетраэдрическими by ions [РO4] 3-, [SiO4] 2- it is visible, that he is characterized by the least force of communication(connection). On Полингу, communication(connection) Si - O on 50 % ионная, the energy of communication(connection) makes ~ 470 кДж/моль. Therefore силикаты on the properties are closer to оксидам, than to acids. Тетраэдры [SiO4] 4- сочленяются with each other by tops through atoms of oxygen. General(common) edges and sides тетраэдры have no, therefore such structures are малоустойчивыми. As тетраэдр has four tops, two can be general(common) one,, three and all four tops. It defines(determines) all variety of structures and various attitude(relation) Si: O in силикатах. Various under the form of a combination mutually connected тетраэдров [SiO4] 4- are called кремнекислородными as motives.
Кремнекислородные motives can be of the final and infinite sizes. They образую of a ring, chain, tapes, layers, skeletons. Characteristic feature of a structure силикатов is the opportunity of replacement in crystal structure of ions of silicon a little bit large on the size by ions of aluminium. The attitude(relation) rк: rа for aluminium makes 0,415, i.e. is boundary. Therefore aluminium can have coordination number 4 and 6. The aluminium with coordination number 4 can enter in кремнекислородный motive. The aluminium with coordination number 6 plays a role катиона.
Силикаты, in which the aluminium replaces silicon, are called алюмосиликатами. Силикаты, in which the aluminium does not enter in кремнекислородный motive, are called силикатами of aluminium.
Sometimes in силикатах contain additional анионы - more often О2-, he, F-, and also neutral molecules of water. Most often meeting in силикатах катионами are Мg2 +, Fe2 +, Al3 +, Ca2 +, K +, Na +, Mn2 +, Zr4 +, Ti4 + Small on the size катионы Мg2 +, Fe2 +, Al3 + usually have coordination number 6. Such катионы as Ca2 +, Zr4 +, Ti4 +, can have coordination numbers 6 and 8. Large однозарядные катионы K +, Na + have coordination numbers 8 and even 12.
In силикатах is extremely advanced изовалентный and гетеровалентный изоморфизм.
In a basis of structural classification силикатов and алюмосиликатов the way сочленения тетраэдров is fixed [SiO4] 4- in a crystal lattice.
On structural classification offered Брегом and Ф.Махачки all силикаты is possible to divide(share) on two large groups: силикаты with кремнекислородными by motives of the final sizes and кремнекислородными by motives infinite in one or several directions of the sizes.
Structure силикатов
Силикаты with кремнекислородными Силикаты with кремнекислородными
By motives of the final sizes by motives of the final sizes
силикаты with изоли- силикаты with Силикаты with Силикаты with Силикаты with
рованными оди- by groups from one-dimensional двухмерными three-dimensional
Night тетра- тетраэдров by chains by layers from continuous
эдрами [SiO4] 4- [SiO4] 4- or tapes тетраэдров skeleton from
( Island final тетраэдров [SiO4] 4- тетраэдров
струтуры) sizes [SiO4] 4- (це- (layered [SiO4] 4-
почечные and structure) (frame
Tape structures)
Structures)
Structures силикатов with кремнекислородными by motives of the final sizes.
1. Structure силикатов with isolated single тетраэдрами [SiO4] 4- (island structures) In these structures тетраэдры [SiO4] 4- are not connected directly to others similar тетраэдрами through atoms of oxygen, and incorporate through катионы of metals which are included in structure силикатов, i.e. кремнекислородный the motive in similar силикатах has structure [SiO4] 4-. Isolated тетраэдры [SiO4] 4- name ортогруппами, and силикаты, containing ортогруппы, - ортосиликатами. To them carry силикаты, in which the attitude(relation) of number of atoms of oxygen to atoms of silicon equally or is more 4. The minerals of this group represent силикаты, in which тетраэдры [SiO4] 4- do not incorporate among themselves by tops. Each ion of oxygen belongs to one тетраэдру. Groups [SiO4] 4- incorporate among themselves катионами. Into structure these силикатов enter small and average двухзарядные катионы Мg2 +, Fe2 +, Ca2 +, Mn2 +. Such катионы, as K +, Na +,, in them does not meet almost, and Al3 + never replaces Si4 +. The main representatives island силикатов are the minerals of groups оливинов (форстерит Mg2 [SiO4], фаялит Fe2 [SiO4]), силлиманита, белит Ca2 [SiO4], mineral of group гранатов гроссуляр, монтичелит CaMg [SiO4], and also циркон.
2. Structure силикатов with groups from тетраэдров [SiO4] 4- final sizes. Into this group enter силикаты, which structure contains groups of the final sizes from тетраэдров [SiO4] 4-, connected among themselves through general(common) (мостиковые) atoms of oxygen. The form and the sizes of oxygen motives in силикатах of this group can be various. A radical [Si2O7] 6- (диортогруппа) consists of two тетраэдров [SiO4] 4-, connected by general(common) top, i.e. one atom of oxygen is general(common) for two тетраэдров. Силикаты, containing such radicals, are called диортосиликатами or пиросиликатами. The representatives similar силикатов are the minerals: окерманит Ca2Mg [Si2O7], ранкинит Ca3 [Si2O7], гидрат трехкальциевого силиката Ca6 [Si2O7] (HE) 6, etc.
Other type кремнекислородных of motives of the final sizes arises in the event that a little тетраэдров incorporate in a ring, forming ring кремнекислородные radicals. Thus, if in everyone тетраэдре обобществляются two аниона of oxygen, can be formed unary three, four and шестичленные rings containing accordingly 3, 4 and 6 кремнекислородных тетраэдров, each of which has two general(common) atoms of oxygen with next тетраэдрами. The radical appropriate трехчленному to a ring, has structure [Si3O9] 6-, четырехчленному - [Si4O12] 8- and шестичленному - [Si6O8] 12-. Except for the specified types of radicals in structures силикатов there are also radicals [Si5O15] 10- - five сочлененных тетраэдров and [Si12O30] 12- - dual ("two-storeyed") шестичленное a ring (three general(common) atoms of oxygen in everyone тетраэдре). By an example силиката with кремнекислородным by motive [Si3O9] 6- is бентонит BaTi [Si3O9]; шестичленные of a ring with a radical [Si6O18] 12- contain in structure of such minerals, as берилл BeAl2 [Si6O18], кордиерит Mg2Al3 [AlSi5O18], in кремнекислородном which radical, as it is visible from the structural formula, one atom of silicon is replaced on aluminium.
Structure силикатов with кремнекислородными by motives of the infinite sizes.
1. Structures with one-dimensional (infinite in one measurement) chains or tapes from тетраэдров [SiO4] 4- chained and tape structures. Тетраэдры [SiO4] 4-, incorporating among themselves by tops, can form unary chains, infinite in one direction. Everyone тетраэдр in a chain will have two general(common) atoms of oxygen with two next тетраэдрами and two free valencies, through which катионы of metals will connect chains in a lattice. The number тетраэдров in a chain beyond all bounds in the sense that is defined(determined) only by size of the given crystal. The structure кремнекислородного of motive in structures with infinite radicals is defined(determined) by structure of the period of repeatability (identity) of this motive made in square brackets, i.e. that structural element, which infinite recurrence in this or that direction is formed кремнекислородный motive by [SiO3] 2-? (one mark of infinity specifies infinity of a chain in one direction).
Other motive of this structural group силикатов is formed, if two infinite chains incorporate through tops тетраэдров together, forming dual infinite in one direction of a tape or belt(zone) (tape structures). Thus the motives as tapes can be formed various on structure and configuration: the dual chain with четырехчленными by rings having a radical of structure [Si2O5] 2-?, dual chain with шестичленными by rings with a radical [Si4O11] 6-?, dual chain with восьмичленными by rings with a radical [Si4O11] 10-?. The minerals with chained and tape кремнекислородными by radicals make the large group. Chained кремнекислородные motives of structure [SiO3] 2-?, have, for example, метасиликаты (силикаты with the attitude(relation) О: Si =3). пироксенов, in particular, concern to them minerals of group: энстатит Mg [SiO3], диопсид Са Mg [SiO3] 2 etc. Tape кремнекислородные radicals have the minerals of group амфиболов - connections, as a rule, of complex(difficult) structure similar to structure пироксенов, but as against them, containing group he. To амфиболам such minerals, as horn обманка, тремолит and пр concern.
2. Structures with двухмерными by layers from тетраэдров [SiO4] 4 - layered structures. If everyone тетраэдр [SiO4] 4- incorporates by three tops with next тетраэдрами, the layers (sheets or grids) can be formed infinite in two measurements.
The structure and character of radicals in layered силикатах also can be various. The most simple and widespread type of a layer - кремнекислородный the layer гексагонального of a type representing sheets with шестичленными by rings, has a radical [Si2O5] 2-??. Such minerals concern to this structural type, as каолинит Al2 [Si2O5] (HE) 4, пластинчатые minerals such as micas, for example мусковит КAl2 [AlSi3O10] (HE) 2, тальк Mg3 (HE) [Si2O5] 2 2, and also such minerals of more complex(difficult) structure, as биотит, вермикулит etc.
To the same type of structures concern силикаты, having кремнекислородные layers from four, five and восьмичленными by rings.
3. Structures with a three-dimensional continuous skeleton from тетраэдров [SiO4] 4- - frame structures. In силикатах with frame structure all 4 atoms of oxygen everyone тетраэдра are general(common) with atoms of oxygen of four tops тетраэдра the three-dimensional skeleton is formed infinite in three measurements. As on each atom of silicon thus it is necessary 2 atoms of oxygen, the structure of a radical will be expressed by the formula [SiO2]. Such radical have the various updatings кремнезема SiO2 (quartz, тридимит, кристобалит). The frame structures of updatings SiO2 do not submit to a principle of most dense packing and represent "friable", "ажурные" of structure containing rather large structural emptiness.
In clean(only) кремнеземистом a skeleton of valency of silicon are completely compensated by valencies of oxygen. However if четырехвалентный the silicon in such skeleton изоморфно is replaced, for example, трехвалентным by aluminium, the skeleton gets a negative charge, for which indemnification the introduction in emptiness of structure additional катионов of metal is necessary. The similar structure will consist from тетраэдрических of groups [SiO4] 4- and [Al O4] 5-, and all тетраэдры will be had by(with) general(common) tops. The structure mixed алюмокремникислородного of motive can be expressed thus by the general(common) formula [(Si, Al) O] n-. Frame structures of many widespread natural and artificial minerals such as field шпатов, цеолитов etc. thus are formed
In a basis of structure field шпатов, being one of basic породообразующих of natural minerals and having the large technical meaning(importance) (for example in technology of ceramics), the skeleton from connected among themselves тетраэдрических of groups lays [SiO4] 4- and [Al O4] 5- (изоморфное replacement Si4 + on Al 5 +), and in emptiness of this negatively charged skeleton settle down compensating a charge катионы of alkaline and щелочно-ground metals (To, Na, Ca, Ba)
Structure refractory simple and complex(difficult) оксидов, карбидов, боридов and силицидов.
To simple concern оксиды, containing with what - or one kind of atom метала, to complex(difficult) - оксиды, into which structure enter of two and more various kinds of atoms of metals. To last, in particular, belong numerous technically important double оксиды such as шпинелей.
Rather widespread(rather distributed) among simple оксидов of metals with the general(common) formula Ме2+О is структуный a type of stone salt (NaCl) .Кубическую a lattice with structure NaCl have MgO, CaO, SrO, BaO, CdO, Vo, MnO, FeO, CoO, NiO.
Feature of a structure of crystal lattices оксидов are that their basis is made dense cubic or гексагональная by(with) packing of ions of oxygen. In similar оксидов with small ионным in radius катиона метала this катион borrows(occupies) all октаэдрические of emptiness in dense packing from анионов of oxygen.
In some simple оксидах with the general(common) formula Ме2+О, кристаллизующихся in in a structural type вюрц ита, for example Pb, BeO, ZnO, катионы метала settle down periodically in half тетраэдрических of emptiness dense гексагональной of packing of atoms of oxygen.
In simple оксидах with the general(common) formula Ме23+О3 often there is a structural type корунда, to which belongs except for? -Al2O3, for example, structure гематита? - Fe2O3, Cr2O3, V2O3 and тд.
Many оксиды with the simple formula Ме4+О2 crystallize in a structural type флюорита CaF2, for example: NiO2, CaO, VO2, ZrO2 (гексагональная structure флюорита) or structural type рутила TiO2, for example: GeO2, TiO2, WO2 etc.
The large group complex(difficult) double оксидов crystallizes in a structural type шпинели. To шпинелям concern crystallized in cubic system double оксиды with the general(common) formula Ме2+О * Ме23+О3,
Where: Ме2 + - Mg, Fe, Mn, Zn, Be, Ni, Co, Cr, Cd, Pb,
Ме3 +- - distinguish алюмошпинели (for example noble шпинель MgO *Al2O3, герценит FeO* Cr2O3), хромошпинели (for example ферохромит FeO* Cr2O3) and т.д
The similarity of structures and parameters of a lattice smaller шпинелей causes one of features - ease of education between them of firm solutions of replacement.
Карбид of silicon (карборунд) - углеродистый the silicon for the first time was received in 1824г. by the Swedish chemist Берцелиусом. Two polymorphic crystal updatings карбида of silicon - cubic (lattice such as diamond а=0,4359нм.) and гексагональная (layered structure with parameters а=в=0,3078 нм are known. And с=0,2518 n нм, where n- number of layers in гексагональной to a cell). In an interval of temperatures 2100-2400о With the cubic updating монотропно passes in гексагональную.
Карбид meets in a nature a kind of fine crystals, sometimes in association smallest crystals of diamond. The crystals карборунда are found out in meteoric craters, diamond трубках, volcanic eruptions.
In industrial conditions карбид of silicon receive in electric furnaces at 2000-2200о With and heating of a mix of quartz with coke or термоантрацитом on reaction requiring(demanding) the large expenses of heat:
SiO2 + 3C SiC + 2CO -Q
Or (at smaller expenses of heat) direct method from silicon and carbon.
Chemically pure(clean) карбид of silicon is colourless, and technical the black colour by impurity Fe, Al, Mg, Zn, Ti, Cr is painted in greenish colour or сине -. Карборунд chemically of racks. He does not react with acids, except for a mix concentrated HF and HNO3.
Расплавленные metals Mg, Mn, Al, Fe, Co, Ni, Cr, Pt, cooperate with карбидом of silicon, whereas Zn, Pb, Cu with it(him) do not react.
Карборундовые materials differ high теплопроводностью, термостойкостью, stability(resistance) to corrosive attack of sour slags, абразивной by stability(resistance) and heat resistance, concerning high electrical conductivity.
Карборунд is used in quality абразивного of a material (powders, circles, grinding and наждачная a paper) at processing metals and alloys, stone, and as for manufacturing high-temperature heaters. The most important areas of application карбида of silicon are connected to his(its) special electrical, including semi-conductor properties.
Бориды of silicon.
2 chemical connections of silicon with бором B3Si and B6Si are known. The crystals B3Si have the form of rhombic plates of black colour with density 2520 kg /м3, B6Si is formed in the form of opaque grains of the wrong form with density 2470кг/м3. Бориды receive by restoration кремнезема in vacuum on reaction:
SiO2 + 8B B6Si + 2BO
Or way of hot pressing of a mix of powders бора and silicon at temperature 1600.. 1800 With. Бориды of silicon differ by high hardness and chemical stability(resistance). They плавятся at 2000 With slowly окисляются at very high temperatures.
The education of firm solutions бора in silicon results in sharp decrease(reduction) to electroresistance last. So the additive 0,0005%уменьгает specific resistance Si in 100 times, and additive 1 % in 1000 times. The additives to application from 0,01 up to 1 % бора cause it(him) дырочную conductivity. Semi-conductor properties of a firm solution бора in silicon is used at creation there of so-called solar batteries - photo cells serving for transformation of a solar energy in electrical. Are applied or силициды бора and to reception special высокоогнеупоров.
Силициды.
With the majority of metals the elementary silicon at high temperatures forms connections парообразного of structure representing crystal substances having metal shine and significant fragility.
Силициды are applied in metallurgy for раскисления of steel and reception кремневодородов, on reaction:
Mg2Si + 4HCl 2MgCl2 + SiH4
At processing силицида кальция the hydrochloric acid on a cold turns out гидраты of the lowest oxides of silicon - лейконы.
Силициды кальция are applied to clearing steel of sulfur and phosphorus. They turn out on reaction:
3СaO + 5 Si 2CaSi2 + CaSiO3
CaC2 + 2SiO2 + 2C CaSi2 + 4CO
2Si + CaO +C = CaSi2 + CO
Силициды кальция it is possible to receive and direct сплавлением Са and Si in an atmosphere of nitrogen or hydrogen. The large technical meaning(importance) in metallurgy have силициды of iron which is included in structure of a technical product - ферросилиций, received or in доменных furnaces or electrical furnaces.
The alloys of silicon with aluminium, are known under the name силуминов, as are applied in engineering as a material to manufacturing products of small densities and large durability.
Now more and more wide application in quality rather жароустойчивого of a material receives дисилицид молибдена, being as by an excellent heat resisting covering for products from a metal layer молибдена, generally speaking, chemically rather unstable at high temperatures.
Questions:
1. Lowest connections of silicon with oxygen. Силиконы and лейконы.
2. Кремнеорганические of connection:
диметилсилан (CH3) 2 SiH2
триметилсилан (CH3) Si (C2H5) 3
тримтилфенилсилан (CH3) 3Si (C6H5)
3. Features of structures силикатов also that lays to a basis of structure силикатов
4. What features of structures боридов, карбидов, нитридов and силицидов?
Lecture № 7.
Theme: knitting materials in a liquid condition. The theory of a structure of liquids. Features of structure силикатных расплавов.
1. Knitting materials in a liquid condition.
2. Hypothesis of a structure of a liquid.
3. Feature of structure силикатных расплавов.
Квазикристаллической - deformed crystal
Сиботаксическая group - strongly deformed deformed structure of crystals
As is known, key operation in manufacture силикатных and other refractory materials is the high-temperature processing, during which the initial firm substances can completely (technology flown down, enamels, глазури, плавленых of cements, огнеупоров, абразивов) or partially to pass in расплав (портландцементный клинкер, глиноземистый cement, porcelain, faience, шамотные both динасовые огнеупоры and т. д.). Knowledge of a nature расплавов силикатов and their properties therefore is rather important.
Плавление - process of transition of substance of a firm condition in liquid, made under action of temperature. Плавление of crystal substances is phase transformation caused spasmodic change of their internal structure and физико-chemical properties, connected to it(him).
From the known theorems of classical thermodynamics follows, that at balance between two condition of substance of free energy of unit of weight of substance in both condition should be identical. From here condition of balance between firm and liquid phases should be equality Gтв=Gж.
Плавление - эндотермический process, it(him) characterize by the latent heat плавления, т. е. By quantity(amount) of heat, which is necessary to inform the substance which has been heated up to temperature плавления, that it(him) расплавить. This heat is spent for overcoming of forces of interaction of atoms of a crystal lattice and characterizes a difference in energy of interaction between particles in firm and liquid condition.
Temperature плавления, being the characteristic of a crystal showing his(its) stability to thermal influences, should be in interrelation with energy of a crystal lattice.
Besides structure on a structure расплавов, in particular on structure of particles, of which they consist, the large influence is rendered by(with) temperature. Agrees
О. In. Мазурину, kinds of structural transformations in расплавах, the temperatures, occurring at change, are reduced to the following basic types:
1. Temperature флуктуации of density. This kind of heterogeneity is typical of any расплавов. In process of cooling the intensity these флуктуации decreases proportionally to decrease(reduction) of temperature so long as расплав is saved in метастабильном a condition.
2. Change of coordination. The influence of structure on coordination of ions in расплаве is investigated in detail enough, influence of temperature on a parity(ratio) in расплаве of the same atoms which are taking place in different coordination condition on oxygen, even is qualitatively investigated very little. In most cases it is necessary to expect reduction of coordination numbers at growth of temperature.
3. Education and диссоциация of structural complexes. The amplification(strengthening) of thermal fluctuations of ions with increase of temperature results in break of communications(connections) 51 and splitting of complexes. At downturn of temperature, on the contrary, there is an integration of complexes, т. е. Increase of a degree of association.
Thus, the temperature factor defines(determines) a dynamic nature of structural components расплава. It is necessary always to mean, that there, where at the certain moment the greatest correctness of mutual orientation was observed, at the following moment there can be a deformation resulting(bringing) gradually in complete infringement of an ordered arrangement of particles. The speed of mutual transition defines(determines) also parity(ratio) of volumes ordered and аморфной of parts of a liquid. And to each temperature there corresponds(meets) the certain parity(ratio) of these volumes.
At manufacturing the majority силикатных of products (glass, ceramics, цементного клинкера) during them обжига occurs private(individual) or even complete плавление of a material. The properties formed thus of a liquid phase are rendered by(with) the extremely large influence on technological process of manufacture and on final properties of ready production. Now is established, that between a structure of substances which are taking place in crystal, liquid or стеклообразном a condition, are available not only various, but also essential similarities. Basically there are three hypotheses of a structure of a liquid. The greatest recognition was received by(with) models of a structure of liquids offered in different years Берналом, И.Я. Френкелем and Г.Стюартом. Agrees Берналу, offered a hypothesis бездефектной of a liquid, the liquid has structure poorly distinguished from geometry of a crystal, from which she is received. The model of a structure of a liquid offered Френкелем, is called квазикристаллической. According to this model is especial in близи of temperature кристаллизации is considered(examined) as the deformed crystal, in which the distant order is lost, but is saved near.
According to the theory " Роев or сиботаксисов " in a liquid there are units named сиботаксическими by groups representing pseudo-crystal educations, which structure comes nearer to a structure of the appropriate crystals allocated from a liquid at кристаллизации. The structure сиботаксических of groups can be considered(examined) as the strongly deformed deformed structure of crystals. Сиботаксические of group are mobile, dynamic units, which collapse at movement and are created again. These groups are divided(shared) by areas of a chaotic arrangement of particles, however of sharp transitions between areas with partially ordered and disorder. This hypothesis in comparison with other hypotheses now has the greatest recognition.
Structure расплавов силикатов.
High temperature плавления силикатов (is usual from 500 0С up to 2000 0С) puts significant obstacles to research of their structure in расплавленном a condition. To number of the most important properties силикатных расплавов, connected with their structure and investigated with sufficient completeness concern: viscosity, superficial tension and density.
Viscosity силикатных расплавов.
Viscosity of substance in particular силикатных расплавов is understood as property of substance to render resistance mainly of one parts of a liquid concerning others. The existing methods of measurement of viscosity of glasses can be divided(shared) into 2 kinds:
1) Methods of definition of viscosity in rather low temperatures:
а) Method of a stretching of a string;
б) Method of a deflection of a string;
в) Method закручивания of a core.
2) Method of definition of viscosity at high temperatures:
а) Method of a falling ball;
б) Method of rotating cylinders.
Superficial tension расплавляющихся силикатов.
The size of a superficial tension is measured by job, which is necessary for making for education of unit of a new surface or for increase of a surface of a liquid at unit at constant temperature:
Where, - factor of a superficial tension;
And job on increase of a surface of a liquid;
S- Area.
The superficial tension plays the important role in engineering. The heating of glass products causes under influence of a superficial tension, rounding off of sharp edges(territories). At sintering fire-resistant materials and destruction them расплавленными силикатами, at кристаллизации расплавов and dissolution in them of crystals.
Density силикатных расплавов is defined(determined) by a method of measurement of loss in weight shipped in расплав of a platinum ball of known volume and weight suspended on a thin platinum string attached top end to коромыслу analytical весов. Thus density d is defined(determined) under the formula:
D = Рв - Р р
The role расплавов by manufacture силикатных of materials is rather various. Determining meaning(importance) have the properties силикатных расплавов for technology of a glass - product of cooling расплавов without them кристаллизации. The vast role расплавов and for technology of various materials received by them кристаллизации (плавленые огнеупоры, cements, абразивы, monocrystals various оксидов, халькогенидов, галогенидов and т is abundantly clear. д.). At the same time it is necessary to note and that large meaning(importance), which belongs расплавам in technology of a number(line) of the basic multitonnage products силикатной of technology, where they are that environment(Wednesday), in which there are many reactions of education of chemical connections determining at the end properties of ready products. The liquid phase in many respects defines(determines) also processes of sintering, т. е. Condensation of a material at обжиге many силикатных of products.
It is possible to result many examples from various areas of technology силикатов, which well illustrate a role расплавов in technology силикатов.
1. At обжиге портландцементного клинкера in rotating
Furnaces a liquid phase appearing in a zone of sintering, completely
Supervises process of formation main цементного of a mineral - трехкальцевого силиката - алита ЗСаО · SiO2.
Н. And. Торопов describes process of formation цементного клинкера as follows. At the first stage - stage твердофазного of sintering from a raw mix consisting from карбоната кальция and clay, three are formed клинкерных of a mineral: ЗСаО · SiO2, ЗСаО-А12О3 and 4СаО-А12O3-Fе2O3. Трехкальциевый силикат, distinguished by the highest absolute durability among цементных of minerals and speed of its(her) increase, at this stage is not formed. He is formed at the second stage - stage жидкофазного of sintering цементного клинкера. At this stage there is a dissolution superfluous оксида кальция and 2СаО · SiO2 in клинкерной of a liquid. In her from ions Са2 +, О2- also [SiO4] -4 is formed трехкальциевый силикат ЗСаО·SiO2. Considerably smaller solubility in клинкерной of a liquid in comparison with other minerals quickly results in creation расплавов, пересыщенных in relation to трехкальциевому силикату, therefore he by first and выкристаллизовывается in these conditions.
2. By manufacture of one of most important fire-resistant
Materials - динаса the liquid phase also plays determining
Role. Динас - sour огнеупор, on structure approximately on 90 % (May).
Consisting from SiO2 and 10 % (May). СаО. In the phase attitude(relation) is submitted basically тридимитом. Last is more desirable phase, than other polymorphic versions SiO2, as the transformation it(him) from the high-temperature form in низкотемпературную is accompanied considerably by smaller change of volume, than, for example, at similar transformation of quartz, and it is rather important at job тридимита as футеровочного of a material. As an initial material for manufacture динаса is the quartz, it(he) is necessary for translating at heating in тридимит. This process in a firm phase goes very slowly. The addition of small weight СаО results in occurrence at rather low temperatures (1430... 1450ЁС) in complete conformity with the diagram of a condition of system СаО- SiO2 of the significant contents расплава. Astable at such temperatures the quartz is well dissolved in a liquid phase and allocates more stable in the given conditions the form кремнезема - тридимит.
3. By manufacture of porcelain the basic phase component of this material - муллит is formed by dissolution of quartz and products of decomposition каолинита in полевошпатовом расплаве.
Thus, nature and the properties расплавов, raw materials, formed at high-temperature processing, by manufacture various силикатных of materials, have huge practical meaning(importance), enabling a choice of optimum parameters of technological process and reception of materials with the beforehand given properties.
Questions:
What factors define(determine) absolute meaning(importance) of temperature плавления of crystal substances?
Describe essence of existing modelling representations about a structure of liquids and, in particular, structure силикатных расплавов.
How influence temperature and structure силикатных расплавов their viscosity?
What defines(determines) size of a superficial tension and moistening ability расплавов?
How it is possible to classify оксиды on their influence on a superficial tension?
In what parameter and how it is possible to characterize moistening ability расплавов?
Result examples of a role of a liquid phase by manufacture силикатных of materials.
Lecture № 8.
Theme: Кристаллизация силикатных расплавов and knitting substances. Education of the centres кристаллизации and growth of crystals.
1. Кристаллизация силикатных расплавов.
2. Homogeneous and heterogeneous education of the centres кристаллизации.
3. Growth of crystals.
Ситалл - стеклокристаллический a material.
Germ - centre кристаллизации
Кристаллизацией расплава or glass the process of transition of substance from термодинамически of a unstable condition with disorder or малоупорядоченной by structure in a steady condition with the ordered crystal lattice is called.
Кристаллизация силикатных расплавов and glasses is the important stage of technological processes of reception many силикатных of materials, influences the basic properties ситаллов, crystal enamels, глушеных глазурей, dairy and коллоидно-painted glasses; essentially influences properties of ceramics, огнеупоров, портландцементного клинкера etc.
Structure, number and order of allocation of crystal phases depend on chemical structure расплава or glass and rule(situation) of initial structure on the diagram of a condition of the appropriate system.
Agrees In. Н. Филиповичу, расплавы and glass on character кристаллизации it is possible to divide(share) into two groups: 1) расплавы and glass, in which began кристаллизации is accompanied by disintegration on phases distinguished on structure from initial structure; 2) расплавы and glass, which at кристаллизации give crystals or firm solutions of the same structure, as initial расплав. From расплавов of the first group it is possible to receive glass or мелкокристаллическую structure at the appropriate thermal processing. Кристаллизация расплавов of the second group is connected only to structural reorganizations, the origin and growth of crystals is not limited диффузионными by processes, therefore at кристаллизации such расплавов the large crystals are formed, from which it is difficult to receive glass.
According to one @. Тамману, in the field of temperatures equilibrium плавления there is a temperature interval - метастабильная a zone of overcooling, in which the speed of education of the centres of a new phase is insignificant. Below than temperature метастабильной of a zone of overcooling the spontaneous process кристаллизации is possible(probable) and depends on speed of education or number of the centres кристаллизации (germs) 1 and from growth rate of crystals.
The process кристаллизации of a new phase consists of two basic stages:
нуклеации - education of the centres (germs) кристаллизации and further р about with т and crystals at the expense of a congestion of structural elements on germs down to volumetric кристаллизации of all weight расплава or glass.
The education of germs (centres) кристаллизации can be homogeneous (spontaneous), when the germs of a new phase have the same structure, as the future crystals, and heterogeneous, when as germs are used substances (impurity) distinguished on structure from кристаллизующейся of a phase.
Homogeneous education of the centres кристаллизации. The education of the centres кристаллизации can be explained on the basis молекулярно-кинетической of the theory. At certain temperature of a molecule are in continuous thermal movement and have the appropriate energy. At downturn of temperature the energy of system decreases, however кинетическая the energy of molecules is still high enough also any новообразование breaks up owing to thermal movement of particles. The further downturn of temperature results in decrease кинетической of energy and education of steadier congestions of molecules. At certain temperature there are steady enough groups of molecules, which become germs of a new phase. For process кристаллизации it is rather essential, that the arrangement of molecules or atoms in germs corresponded(met) to their rule(situation) in a crystal lattice.
Heterogeneous education of the centres кристаллизации. Is experimentally established, that the education of the centres кристаллизации of a new phase is accelerated, if into system to enter the initiators кристаллизации- impurity promoting more effective and fast overcoming of a power barrier зародышеобразования and acceleration of processes of phase transition. Such impurity are called as catalysts кристаллизации.
One of the main and decisive influences of the catalyst on кристаллизацию at heterogeneous зародышеобразовании is his(its) influence on reduction of size of a superficial tension between the catalyst and primary crystal phase, that provides good wetting of the catalyst with a phase forming a germ, and serves a necessary condition of heterogeneous process.
To catalysts кристаллизации the following requirements are showed: the catalyst кристаллизации should have high solubility in расплаве at high temperatures and limited solubility near to temperature of a softening, to have low energy of activation at education of the centres кристаллизации from расплава in the field of the lowered temperatures. Ions or the atoms of the catalyst at the lowered temperatures should have higher speed диффузии in comparison with the basic components расплава or glass. The distinction of parameters of a crystal lattice of a new crystal phase and parameters of a crystal lattice of the catalyst should not exceed 10... 15 %.
As catalysts кристаллизации apply metals, оксиды, фториды and сульфиды of metals or their combination.
Growth of crystals. The growth of crystals is the second step of process кристаллизации after education of germs - centres кристаллизации. The arisen crystal continues to grow at small overcooling. At increase of overcooling or introduction of impurity the growth rate of different sides of a crystal can change, т. е. The growth rate of separate sides of a crystal is various. The growth of sides occurs послойно, consecutive escalating of layers. In result флуктуационного of education on a surface двумерного of a germ arise ступеньки. Arisen at edges or units of a crystal ступенька moves along a side with speed, in hundreds time exceeding speed of moving in a direction, perpendicular side. The connection of atoms to ступеньке occurs to smaller power expenses, than connection to smooth sites of a side. For realization of such mechanism overcoming insignificant threshold overcooling is necessary. The growth of a crystal can occur and at education on a surface of a crystal screw дислокации.
The total process of education of the centres кристаллизации and growth of crystals in силикатном расплаве characterizes кристаллизационную ability расплава, determined by experimental methods.
Questions:
1. What such кристаллизация расплавов?
2. Of what stages the process кристаллизации consists?
3. Characterize homogeneous and heterogeneous education of the centres кристаллизации.
4. How there is a growth of crystals?
Lecture № 9.
Theme: properties of binding materials in a liquid condition. Viscosity. Density. Mechanical, thermal properties of binding substances.
1. Property of binding materials in a liquid condition.
2. Mechanical, thermal properties of binding substances.
Thixotropy - ability of structures after their destruction as a result of any of mechanical influence themselvs liberally to be restored in time.
Water demand of binding substance - it is necessary to enter quantity of water, which into it for reception of the paste with so-called normal density.
The properties melts depend on their chemical structure and features of a structure.
Viscosity
The viscosity melts of silicates is closely connected to their structure, than more difficultly anionic complexes, the above viscosity of melts at same temperature (tab. 1).
Тable 1. - Viscosity of melts silicates
Material |
Relation О : Si |
Viscosity of melts (for1400оС), Pа·s |
Quartz |
2 |
10 9,6 |
Feldspar |
2,7 |
105 |
Glass |
2,5 |
28 |
Basalts |
≈ 3 |
8 |
Furnace slag |
3,7 |
0,5 |
The dependence of the logarithm of viscosity on temperature for melts with complex anionic by complexes represents smooth curve (fig. 16, curves 1 and 2), showing about absence
crystallization.

Fig. 16. Dependence of viscosity of silicates melts from temperature:
1 - window glass; 2 - quartz glass; 3 - slag
Melts of slags consist of simple anionic of complexes, as causes low viscosity melts at high temperatures and fast crystallization of melts in a narrow interval of temperatures. Raise viscosity of slags oxides of silicon and aluminium; lower - calcium oxide, magnesium
, manganese, natrium (sodium), potassium (kalium), iron.
Structure both properties цементного of the test and hardened cement (stone).
As a result of careful mixture цементного of a powder with water taken in quantity(amount) 25-40 % of his(its) weight, receive цементное тесто, named differently by paste. With increase of quantity(amount) of water тесто becomes more mobile, the consistence it(him) decreases.
1. Structural viscosity and plastic durability of the test.
Тесто, made from cement or from any of other knitting substance, represents concentrated water суспензию, described by the certain structure and, hence, by raised(increased) viscosity. Viscosity similar суспензий define(determine) under the formula:
? =? н +? стр,
Where? н - normal or ньютоновская viscosity of system;? стр- additional, structural viscosity of the same system. Such systems name вязкопластичными. Occurrence of the raised(increased) viscosity separate charge ван-дер-ваальсовых of forces, in this or that measure connecting высокодисперсные частички in суспензии. The destruction of such structures comes, in particular, at mechanical influences on system (vibration, pushes, встряхивание, hashing and т. Item). Thus the structural viscosity falls, and суспензия gets ability a leak. At the termination(discontinuance) of mechanical influences the structural communications(connections) in system again are restored, the viscosity суспензии raises, and the fluid condition disappears. The similar systems are called тиксотропными.
The normally viscous systems begin a leak at any difference of pressure. At the structured systems on Бингаму it is necessary to apply(put) additional force appropriate to a limiting pressure(voltage) of shift to call their current.
The structural viscosity to a great extent depends both on properties of cements, and from concentration, temperature and duration выдерживания суспензии. It is important to note, that depending on В/Ц and the durations выдерживания of the test considerably change character and time subsequent застудневания at the termination(discontinuance) of mechanical influences, together with structural viscosity. For definition of structural viscosity цементных of pastes and solutions And. Е. Десов has developed вибровискозиметр. In a fig. 17 the results of some definitions of structural viscosity of the test from usual cement, and also test with the additive пластификатора - омыленного пека in quantity(amount) 0,05 and 0,1 % of weight of cement are given. Пек, being by superficial - active substance (ПАВ), promotes significant reduction of viscosity цементного of the test, and also растворных and concrete mixes, best them удобоукладываемости, increase of density and, hence, their qualities.
At introduction in портландцемент трепела, диатомита, опоки and т. The item structural viscosity sharply grows. So, if to the test made at В/Д = 0,5 to add 30 % трепела, the structural viscosity is increased in tens time.
Fig. 17. Structural viscosity pure(clean) цементного of the test and with the additive омыленного пека
1 - портландцемент + 0,05 % пека;
2 - портландцемент pure(clean);
3 - портландцемент + 0,1 % пека
Physical and mechanical properties of cements
1. Density and volumetric weight.
Density портландцементов depending on chemical and phase structure, and also various additives changes within the limits of 3-3,2 г/см3.
The cements with lowered density at equal activity, водопотребности and speed твердения in comparison with cements with raised(increased) density are more economic, as at the identical weight charge knitting give more пластичные concrete mixes because of the increased output(exit) цементного of the test.
The cements with raised(increased) density are used at erection of accident protection devices from nuclear radiations. They are applied also at цементационных jobs and for тампонирования of petroleum chinks. Such cements with raised(increased) density receive at the expense of increase in their structure of ferruterous phases С4АF and С2F. In necessary cases in structure of cements at their manufacturing enter окись бария ВаО, which reacts with кремнеземом with education 2ВаО ·SiO2 (density 5,4 г/см3).
Slag and пуццолановые портландцементs are characterized in lower density (2,7-2,9 г/см3), than usual портландцемент.
So-called bulk volumetric weight of cement is connected also to density. Distinguish volumetric weight (weight) in the friable and condensed condition. Than less than density and than is more thin the cement is crushed, the his(its) volumetric weight is less. Bulk volumetric weight портландцемента in a friable condition changes within the limits of 900-1100, and in condensed - 1400-1700 kg / м3.
To know volumetric bulk weight of cement it is necessary at account of volume of bunkers and силосов for his(its) storage, at volumetric дозировании making of concrete and т. Item. Often in accounts of volume of warehouse capacities accept average bulk weight of cement in 1200 kg / м3.
2. Водопотребность and normal density of the test.
Under водопотребностью of knitting substance understand that quantity(amount) of water, which is necessary for entering into him(it) for reception of the test with so-called normal density. As normal density цементного of the test such consistence conditionally is called, at which пестик Тетмайера is immersed in him(it) on certain(determined), normalized by the standard 310-60, depth.
Водопотребность of cement at reception of the test of normal density is equal to quantity(amount) of water designed in percentage of weight of cement. Водопотребность портландцементов changes usually within the limits of 24-28 %. It is necessary to note, what is it sometimes it is more necessary for passage of reactions гидратации клинкерных of minerals. In result entered in тесто superfluous water raises пористость цементного of a stone, that negatively has an effect for his(its) durability. Therefore ври other equal conditions, than less водопотребность of knitting substance, the higher is his(its) quality. Портландцемент concerns to knitting substances with lowest водопотребностью. Водопотребность of building plaster, for example, 50-70 %, and пуццоланового портландцемента - 35-40 % (reaches(achieves) at the additives осадочного of an origin).
Водопотребность портландцемента depends on many factors and, in particular, from it(him) минералогического of structure. The it is more in him алюминатов кальция, the she is higher. More thin crushing also increases her(it) a little. This is promoted also by introduction of such materials, as трепел, диатомит and other active additives осадочного of an origin, even in quantity(amount) 10-15 %.
Водопотребность of cements it is possible to adjust in significant limits with the help of the additives of superficial - active substances (ПАВ). They render разжижающее action. In quality ПАВ apply сульфитно-спиртовую барду and its(her) derivative, абиетат натрия and many other materials more often. ПАВ in quantity(amount) 0,1-0,3 % enter in cements at помоле, and receive so-called пластифицированные портландцементы. They can be added and at manufacturing растворных and concrete mixes.
3. Схватывание of the test.
The large practical meaning(importance) at use of knitting substances gets speed them схватывания and твердения.
Схватыванием the process is called, at which the rather mobile mix of cement with water gradually густеет and gets such initial durability, at which its(her) mechanical processing becomes practically inconvenient and even impossible (in the end схватывания). Therefore knitting substances, including the cements, should be characterized by such terms схватывания, which allow приготовлять растворные and concrete mixes and to use them in business.
Distinguish a beginning and end схватывания of the test from this or that knitting. Conditionally according to the standards these terms схватывания define(determine) on the test of normal density at temperature 20ЁС + 2 on depth of immersing in him(it) needles Вика. On ГОСТу on портландцемент the beginning схватывания of the test from this knitting should come not earlier than 45 mines, and end схватывания - not later than 12 ч, considering from the moment of mixture of cement with water.
Knitting of themes ценнее, than faster his(its) durability the ambassador of a beginning схватывания and, hence, than less break in time between his(its) beginning and end accrues. Terms схватывания of cements depend on many factors and submit to regulation in rather wide limits in view of the requirements showed to knitting, used in construction.
Минералогический the structure of cements is appreciably reflected in speed them схватывания. So, the cements with the raised(increased) contents алюминатов кальция are characterized by shorter terms схватывания. Белитовые cements are seized more slowly.
Terms схватывания of cements are influenced also by(with) many other substances, one extend them, others reduce.
4. Uniformity of change of volume
The knitting substances, including cements, at твердении should be characterized by uniformity of change of volume. The cements with non-uniform change of volume result not only in decrease(reduction) of durability of concrete at them твердении, but even to their destruction.
The non-uniformity of change of volume of cements can be called:
1) гидратацией free окиси кальция at the contents her(it) in клинкере more than 1,5-2 %;
2) гидратацией free окиси магния, present in клинкере as high-temperature slowly гасящейся of the form - периклаза;
3) Education in hardening cement высокосульфатной of the form гидросульфоалюмината кальция at the raised(increased) contents in клинкере С3А and at superfluous introduction of plaster in портландцемент at it(him) помоле.
5. Activity both durability портландцементов and their dependence on the various factors.
а) Definition of durability and stamp of cements under the standards
Major property портландцемента is his(its) ability to harden at interaction with water and to pass in камневидное a condition.
Than the above mechanical durability hardened камневидного of a body (solution, concrete) and than faster she is achieved, the higher is the quality of cement or other knitting substance. Therefore distinguish:
1) Final durability, which can be achieved by cement at твердении, and
2) Speed твердения, characterized by intensity of growth of durability of hardening cement in time.
6. Influence of temperature and additives on speed твердения портландцементов.
Temperature renders the very large influence on твердение портландцементов and his(its) derivative (slag and пуццоланового портландцемента etc.)
7. Усадка and набухание цементного of a stone at change of his(its) humidity.
If previously sample, sated with water, of this or that form (prism, cylinder and т.п.0, made from цементного of the test, solution or concrete to place on air environment(Wednesday), which relative humidity below achievable at complete saturation, the sample will begin to dry up thus water in the beginning to evaporate from large cavities and пор, and then from capillaries of the lesser diameter. She will evaporate until, when the balance between moisture content in a sample and in an environment (relative humidity) will be established.
8. Variable humidifying and drying цементного of a stone.
If the cycles of drying and humidifying цементного of a stone or concrete repeatedly repeat, being accompanied by processes, varying on a direction, усадки and набухания, residual deformations gradually collect, the structure is loosened, external volume and пористость of system is increased, and mechanical durability and durability of concrete (are reduced.
9. Трещиностойкость
Усадка цементного of a stone and цементных of concrete is closely connected from them трещиностойкостью during drying, which has the large practical meaning(importance). For example, at evaporation of water from a surface цементного or concrete sample more intensive develop усадочные of deformation, him in internal zones of a material, where влагоотдача or is slowed down, or her(it) completely no. Because of it in internal zones there are pressure(voltage) of compression, and in outside layers - stretching.
The researches show also, that the cements with approximately identical parameters усадки can considerably differ on трещиностойкости. Believe, that the cements with the lowered speed твердения are characterized by smaller propensity to трещинообразованию. Therefore to judge about трещиностойкости of this or that cement only on parameters it(him) усадки it is impossible.
10. Ползучесть цементного of a stone
Ползучестью the property цементного of a stone is called or concrete is irreversible to be deformed under influence is long of pressure,(voltage,) working in them arising at action of external loadings, and also усадки, temperature and other factors.
Depending on size of the enclosed forces the deformation ползучести or is gradually stabilized at some constant level, or, being continuously increased, results in destruction of a body.
At pressure(voltage) in concrete till 50-60 Ё/о of a limit of his(its) durability at compression ползучесть carries linear character and is caused mainly by viscous current of a material at малозаметном infringement of his(its) microstructure.
Questions
1. What such viscosity?
2. What concerns to физико-mechanical properties of cements?
3. Characterize each property of cements.
Тиксотропия –thixotropy
Самопрoизвольно – themselvs liberally
Водопотребность –water demand
Тесто – dough, paste
Кварц – quartz
Полевой шпат – Feldspar
Стекло – glass
Базальт –basalts
Доменный шлак –furnace slag
Отношение О : Si – relation, attitude toward
Кристаллизации – crystallization
Oксид кальция – calcium oxide
Магния – magnesium
Марганец - manganese
Силикаты in высокодисперсном a condition
Lecture №10.
Theme: Силикаты in высокодисперсном a condition. Concept about дисперсных systems. A measure дисперсности. Classification дисперсных of systems. The characteristic and methods of reception коллоидных of systems. Коллоидные of the form кремнезема. Гели of a silicon acid.
1. Concept about дисперсных systems. A measure дисперсности. Classification дисперсных of systems
2. Characteristic and methods of reception коллоидных of systems. Коллоидные of the form кремнезема. Гели of a silicon acid.
Золь кремнезема, is суспензия кремнезема
Гель soft weight
Concept about дисперсных systems. A measure дисперсности.
Дисперсные of system - heterogeneous systems with the strongly advanced internal surface between phases consisting of two or greater numbers of phases, and, at least one of them (named дисперсной by a phase), has enough high дисперсностью and is distributed(allocated) in environmental continuous дисперсионной to environment(Wednesday) as fine particles.
In process of reduction of the sizes of particles дисперсной phases the surface undressed of phases grows. Thus, the concept " дисперсные of system " unites systems containing particles small in all measurements, and system with particles having the significant sizes (down to microscopic).
Дисперсность - characteristic of heterogeneous system back proportional to the size (diameter) of particles дисперсной of a phase. Дисперсность defines(determines) size of a specific surface Sудv, i.e. attitude(relation) of a surface of a particle S1 to its(her) volume V1:
Sудv = S1/ V1
In practice it is necessary to deal in overwhelming majority of cases with полидисперсными by systems, the size of particles in which changes from several ангстрем (10-10м) up to hundreds микрометров (10-4м).
The large interest to дисперсным to systems on the part of the theorists and практиков is called by a wide circulation them in a nature and engineering. The mountain breeds, грунты and ground, fogs and clouds, rain and snow, space dust and fabrics alive организмов are дисперсными systems. Дисперсной structure have the majority of materials of modern engineering - the alloys, polymeric and fibrous materials, concrete and composites.
Classifications дисперсных of systems
There are many classifications дисперсных of systems to various attributes. Elementary is the division all дисперсных of systems on 3 groups on a degree дисперсности: высокодисперсные, or ультрамикрогетерогенные, the size of which particles lays in limits from 10-9 up to 10-7м (1-100 нм), microheterogeneous with the size of particles from 10-7 up to 10-5 м (1-10 microns) and грубодисперсные with particles, which size exceeds 10-5м.
On a modular condition дисперсные of system are divided into three groups - with firm (т), liquid (ж) and газообразной (г) дисперсионными by environments(Wednesdays). Everyone of willows of these groups can be divided(shared) but three subgroups - according to a modular condition дисперсной of a phase. Practically are realized only 8 of 9-ти of theoretically possible(probable) combinations, since the gas in gas in usual conditions forms homogeneous system. Only in особах cases (for example, in space space) the non-uniform areas with флуктуациями of density such as Г-Г are possible(probable).
In technology refractory not metal and силикатных of materials the greatest meaning(importance) have the systems such as Т/Ж with high concentration дисперсной of a phase (суспензии, paste), Т/Г (diluted of a dust, smokes; концентрировенные - powders), Ж/Ж. - эмульсии. Суспензии in an industry have the various names: in technology of knitting materials - шламы, in technology of ceramics and огнеупоров - шликеры, in technology of inorganic substances -пульпы. Высококонцентрированные суспензии name by paste, test (for example, известковое тесто).
On intensity of molecular interaction between phases on their surface of the unit дисперсные of system are divided(shared) лиофильные and лиофобные (from греч. "лиос" - a liquid, "фило" I like ", фобо " - I hate). With reference to water дисперсионной to environment(Wednesday) such systems name гидрофильными and гидрофобными. Лиофильные of system (for example, clay) show strong interaction with дисперсионной by environment(Wednesday) at the expense of small distinction in their molecular nature (polarity and are capable диспергироваться spontaneously, forming термодинамически steady коллоиды. In лиофобных systems this interaction is weak owing to the large difference полярностей of substances, forming them, therefore such systems термодинамически are unstable. The fine particles having raised(increased) free superficial energy, is spontaneous коагулируют (stick together) or коалесцируют (merge). For increase of stability of similar systems enter stabilizers (ions, superficial - active substance to other), адсорбирующиеся on a surface of particles дисперсной of a phase and forming blanket interfering accusation of particles with each other.
On a degree структурирования дисперсные the systems can be divided(shared) into 3 basic groups. To first concern свободнодисперсные (unstructured) systems (золи), in which particle дисперсной of a phase are free, are not connected with each other and can independently move in дисперсионной to environment(Wednesday) by gravity or броуновского of movement. Some concern лиозоли, to them суспензии and эмульсии, aerosol. The second group make связнодисперсные systems described by presence of spatial structure (of a grid, skeleton), made by particles дисперсной of a phase, for example: гели to graze, powders, some суспензии etc. Частички, forming structure, are not capable to mutual moving and can make only oscillatory movements. At enough strong структурпой to a grid such дисперсные of system get a number(line) of properties of firm bodies (high structural viscosity, elasticity etc.), irrespective of a modular condition дисперсионной of environment(Wednesday) and дисперсной фгеы, П.А.Ребиндер of system of the first group has named жидкообразными, and second - твердообразными. The intermediate rule(situation) is borrowed(occupied) by(with) the structured liquids - дисперсные of system the separate particles дисперсной of which phase are connected with each other in friable units, but do not form continuous structure. These units can be considered(examined) as обрывки of a spatial grid, which for whatever reasons has not received complete development or partially has broken up. At complete destruction of structure structured дисперсные of system pass in unstructured (свободнодисперсные). If such transformation occurs is convertible, speak about presence тиксотропии in system.
The characteristic and methods of reception коллоидных of systems.
Heterogeneous высокодисперсные (коллоидные) of system are widely distributed in a nature and have the extremely important meaning(importance) in engineering. Коллоидное the condition is characterized certain(determined) дисперсностью (degree of crushing) firm phase, Depending on the size of particles all дисперсные of system classify as follows: грубодисперсные of system (суспензии, эмульсии), consisting from particles is larger 10-6 м; systems intermediate дисперсности (thin suspensions, smokes, porous bodies), consisting from particles by the sizes 10-6... 10-7 м; высокодисперсные of system (actually коллоиды), consisting from particles by the sizes 10-7.. 19-9 m. As the crushed substance usually is in any environment(Wednesday), from which it to a greater or lesser extent cooperates, the properties are necessary it(him) for considering(examining) in aggregate with this environment(Wednesday). As a result of interaction коллоидных of particles with each other and with дисперсионной by environment(Wednesday) are formed коллоидные of structure with a specific complex of properties. The variety of properties высокодисперсных of systems is caused by the following factors: by chemical structure of separate components, sizes of particles дисперсной of a phase, modular condition of initial products, molecular forces in superficial межфазных layers, and also properties and structure of these layers.
Коллоидные of system are formed in result or splitting of large pieces of substance up to required дисперсности, either association of molecules or ions in units коллоидных of the sizes. According to it exist диспергационные and конденсационные methods of reception дисперсных of systems.
Диспергационные methods. On these methods above system make job for overcoming intermolecular forces and accumulation of free superficial energy. Mechanical диспергирование provides crushing a material at the expense of mechanical job. The electrical way of reception коллоидных of systems is based on education of a volt arch between electrodes from диспергируемого of metal placed in cooled water. This method to диспергационным concerns conditionally, as the metal of an electrode is sprayed at temperature of an arch with education паров, which subsequently are condensed in a cold liquid. Also is conditional to methods диспергирования a concern - method пептизации: to свежеприготовленному to a friable deposit диспергируемого of substance add a solution of the электролита-stabilizer, under which action of a particle of a deposit are separated from each other and pass in the weighed condition, forming золь. Диспергационными by methods to reach(achieve) high дисперсности usually it fails.
Конденсационные methods. By these methods subdivided on physical and chemical, receive systems with the sizes of particles about 10-8... 10-9 m.
Major physical methods of reception дисперсных of systems - condensation from паров and replacement of the solvent. At change of parameters of system, in particular, at downturn of temperature, pressure pair above a liquid (or firm body) can Become above equilibrium and in a gas phase will arise new liquid (or firm) phase; the system becomes heterogeneous, the condensed particles form with a gas phase дисперсную system a fog (or smoke). For education дисперсной of system on a method of replacement of the solvent to a true solution any the substances add in large volume other liquid being for this substance the bad solvent, but well mixing up with the initial solvent. The methods of chemical condensation are based on конденсационном allocation of a new phase from пересыщенного of a solution, thus substance forming дисперсную a phase, occurs as a result of chemical reactions of an exchange, окислительно-восстановительных, гидролиза etc.
Коллоидные of the form кремнезема. Гели of a silicon acid.
The majority of changes, which occur with кремнеземом in a nature, is caused by interaction with water. By the basic characteristic of system кремнезем - water is the tendency it оксида to form коллоидные solutions or гидратированные of weight. Assume, that at education quartz lived осаждение геля кремнезема sometimes precedes development of crystals of quartz. At education аморфного the disgrace кремнезем in the beginning is allocated as soft гелеобразной of weight, which gradually hardens and begins to show peculiar to her дифракционные of property.
To typical natural коллоидным the forms кремнезема posess disgraces; метаколлоидный character have халцедоны and part of quartz.
Коллоидный кремнезем, or золь кремнезема, is суспензия кремнезема, the sizes of which particles are in коллоидной of area. The following ways of preparation water золей кремнезема are known: neutralization of a solution силиката натрия and диализ through полупроницаемые of a membrane; application электродиализа; dissolution of elementary silicon in water solutions of ammonia or амина; neutralization силиката натрия by an acid; пептизация гелей at raised(increased) temperature; application ионообменной of pitch for removal(distance) натрия from a solution силиката натрия. After mixing силиката натрия and hydrochloric acid the silicon acid turns out in высокодисперсном, probably, molecular, condition; she gradually becomes коллоидной at continuous growth of particles. Even at careful further clearing the relative viscosity золя is increased down to education геля. If пересыщенный a solution of a monosilicon acid to leave to grow old, a firm phase аморфного кремнезема at the end is defined(determined). This кремнезем can appear in the form коллоидных of particles, deposit or геля. It was supposed, that the transformation of a monosilicon acid occurs through the intermediate forms of a polysilicon acid up to one of these forms аморфного кремнезема, - as the change represents returning system to a condition adequate(answering) the minimal superficial energy. But this rule(situation), on Р. Айлеру, does not explain the mechanism полимеризации of a silicon acid and does not predict, what form will accept the final polymer. The general(common) equation полимеризации can be submitted as follows:
n Si (OH) 4 > (SiO2) n + 2nH2O
In opinion In. And. Вейля, the process полимеризации entails distribution HE - ions between various atoms of silicon conducting to education of polymeric cells, in which each atom Si4 + is surrounded октаэдрически with six HE - ions. At the presence of small quantity(amount) of alkali the silicon acid can полимеризоваться before education steady дисперсных коллоидных of particles, while in a sour solution is formed гель кремнезема.
The surface of particles коллоидного кремнезема is so great, that гидратация becomes measurable and it is possible to speak about коллоидном гидратированном кремнеземе.
The education геля кремнезема proceeds in two stages. In the first stage originally formed(originally educated) Si (HE) 4 is condensed before education коллоидных частичек. In the diluted solution the further slow increase of the sizes of particles is unique(sole) change, but at the contents about 1 % (May). SiO2 these initial particles are capable to be condensed before education of continuous structure, which provides the certain degree of its(her) rigidity.
The mechanism of both stages полимеризации is identical, namely: condensation before education of communications(connections) Si-О-Si. The irreversibility of process of formation геля is explained by irreversibility of reaction of condensation accompanying with education силоксановой of communication(connection).
Коагуляционные of structure are formed by coupling particles ван-дер-ваальсовыми by forces through layers of a liquid in parts, chains, spatial grids - friable skeletons. The systems with коагуляционными by structures have, as a rule, small durability known plasticity, and also some elasticity. Specific property коагуляционных of structures is тиксотропия - the ability of structures after their destruction as a result of any of mechanical influence spontaneously to be restored in time.
Конденсационно-кристаллизационные of structure arise or as a result of education of strong chemical communications(connections) between particles (конденсационные of structure), or owing to merging кристалликов in process выкристаллизовывания of a new phase. The structures with such character of communications(connections) between particles show упругохрупкие of property. The durability them usually considerably is higher than durability коагуляционных of structures.
Questions
1. Characteristic дисперсных of systems? What is a measure дисперсности?
2. To what attributes классификацируются дисперсные of system?
3. What methods of reception коллоидных of systems exist?
4. Гели of a silicon acid.
Лекция № 11 ФХС .
Тема: Коллоидно-химические явления в технологии силикатных материалов.
Неорганические вяжущие вещества- материалы (обычно в виде тонкодисперсных порошков, способные при смешивании с водой (затворении) образовывать пластично-вязкую массу (тесто), которая постепенно затвердевает, превращаясь в прочное камневидное тело.
Рассмотрим факторы, обусловливающие пластичность вяжущего теста, теории твердения вяжущих веществ, влияние добавок на процессы твердения, явления смачивания и адгезии.
Пластичность вяжущего теста. Вяжущее вещество при смешивании с водой (или другими затворителями) образует практически однородную пастообразную смесь - вяжущее тесто. Это тесто представляет собой высококонцентрированную суспензию частиц вяжущего (порошка) в жидкости, которую по Ребиндеру, можно считать твердообразной жидкостью. Вяжущее тесто способно под влиянием внешних механических воздействий деформироваться без нарушений сплошности и сохранять полученную форму, когда действие внешней силы прекращено. Такое свойство называется пластичностью теста. При хорошей пластичности массы операции ее смешивания, укладки, формования и уплотнения ускоряются и удешевляются. Применение достаточно пластичных масс способствует также повышению плотности и однородности готовых изделий, что благоприятно сказывается на их физических, химических и механических свойствах.
Твердение вяжущих веществ. Твердение, т.е. превращение пластичного вяжущего теста в твердое камневидное тело, происходит в результате химических процессов, специфичных для каждого вяжущего. Рассмотрим общую схему механизма гидратационного твердения. В процессе твердения принято различать два периода: схватывание и твердение.
Началу схватывания соответствует момент, когда вяжущее тесто начинает загустевать и теряет пластичность, а вместе с ней и тиксотропную способность. В дальнейшем тесто превращается в землисто-рыхлое твердое тело, которое не обладает существенной прочностью, что соответствует концу схватывания. При этом протекает необратимое химическое взаимодействие исходных компонентов друг с другом с образованием новой высокодисперсной твердой фазы и превращение грубодисперсной гетерогенной системы в микрогетерогенную коллоидно-дисперсную систему.
Выяснение механизма гидратационного твердения вяжущих веществ давно привлекало внимание исследователей. Одной из первых теорий этого процесса была кристаллизационная теория Ле-Шателье (1882) разработанная им на примере описания полуводного сульфата кальция (гипсового вяжущего). По Ле-Шателье, вяжущее вещество реагирует с водой, образуя соединения, существенно отличающиеся по свойствам от исходного вещества. Позднее была преждложена коллоидная теория (В Михаэлис, В Оствальд, Л.М. Блюмен,1892). По этой теории процесс образования гидратных фаз происходит топохимически – в результате взаимодействия молекул воды с поверхностью частичек минеральных фаз, входящих в состав вяжущего, вследствие чего образуется коллоидная масса – коагуляционная структура, состоящая из мельчайших частиц гидратных фаз. Прочность системы растет по мере увеличения степени уплотнения геля, которая постоянно возрастает за счет продолжающегося связывания жидкости поверхностью твердых частиц, а также в результате потери влаги вследствие высыхания.
А.А.Байков предложил теорию твердения (1923), в которой учитывались взгляды и основные положения как кристаллизационного, так и коллоидного механизмов формирования прочности.
М.М.Сычев в процессах твердения существенную роль отводит физико-химическому состоянию воды на разных этапах формирования структуры. При гидратообразовании поверхностная энергия системы значительно возрастает за счет увеличения удельной поверхности, что делает систему неустойчивой.
Влияние добавок на процессы твердения вяжущих веществ.
В Б.Ратинов и Т.И. Розенберг разделили ускорители твердения по механизму действия условно на четыре класса:
изменяющие растворимость вяжущего и вступающие с ним в химическую реакцию;
химически взаимодействующие с вяжущим с образованием труднорастворимых соединений;
являющиеся центрами кристаллизации
ПАВ, адсорбирующиеся на зернах вяжущих и новообразованиях.
К добавкам первого класса относятся соединения различной природы (электролиты, неэлектролиты), изменяющие пересыщение в растворе, а следовательно и скорость гидратации и твердение вяжущих материало. Неэлектролиты (например, спирты), химически не взаимодействуя с исходным и конечными фазами, обычно только понижают их растворимость и поэтому относятся к числу замедлителей твердения.
Добавки второго класса образуют в результате химической реакции с вяжущими и продуктами их гидратации труднорастворимые вещества или малодиссоциированные комплексные соединения.
Добавки третьего класса, являясь кристаллическими затравками, облегчают выделение новой фазы из пересыщенных растворов, поэтому их введение целесообразно в тех случаях, когда лимитирующей стадией твердения является скорость кристаллизации новообразований.
Четвертый класс составляют органические ПАВ, позволяющие при их добавлении в очень малых количествах значительно изменять свойства цементного камня, а иногда и придать ему некоторые новые.
The Lecture 11 FHS.
Subject: Colloidal-chemical phenomenas in technologies astringent
The Inorganic astringent- material (in the manner of тонкодисперсных powder usually, capable at mix with water (shutterring) form plastic-viscous mass (the dough), which gradually solidifies, превращаясь in strong камневидное body.
We shall Consider the factors, conditionning пластичность вяжущего test, theories of the repeating over and over again astringent, influence of the additives on processes of the repeating over and over again, phenomenas смачивания and адгезии.
Plastichnosti вяжущего test. The Astringent at mix with water (or the other затворителями) forms practically uniform пастообразную mixture - вяжущее dough. This dough presents itself высококонцентрированную суспензию particles вяжущего (powder) in liquids, which on Rebinderu, possible consider the твердообразной by liquid. Vyazhuschee dough capable under influence external mechanical influence be deformed without breaches сплошности and save the got form, when action of external power is stopped. Such characteristic is identified the пластичностью of the test. Under good пластичности masses to operations of her(its) mix, stowages, формования and compactions speed up and are reduced the price of. Using it is enough plastic masses promotes also increasing to density and homogeneity of the final products that favourable tells on their physical, chemical and mechanical characteristic.
Repeating over and over again astringent. Repeating over and over again i.e. conversion plastic вяжущего test in hard камневидное body, results from chemical processes, specific for each вяжущего. We shall Consider the general scheme of the mechanism гидратационного repeating over and over again. In process of the repeating over and over again is accepted distinguish two periods: схватывание and repeating over and over again.
The Beginning схватывания corresponds to the moment, when вяжущее dough begins загустевать and loses пластичность, but together with her and тиксотропную ability. Hereinafter, the dough changes in землисто-friable hard body, which does not possess essential toughness that corresponds to the end схватывания. Herewith runs the inconvertible chemical interaction source component with formation new высокодисперсной hard phase with each other and conversion грубодисперсной гетерогенной systems in микрогетерогенную colloidal-дисперсную system.
The Clarification of the mechanism гидратационного repeating over and over again astringent long ago attracted attention of the researchers. One of the first theory of this process was кристаллизационная theory Le-SHatelie (1882) designed by him on example of the description полуводного sulphate calcium (gypsum вяжущего). On Le-SHatelie, the astringent s with water, forming join, greatly differring on characteristic from source material. Later, преждложена colloidal theory (In Mihaelis, In Ostvalid, L.M. Blyumen,1892). On this theories process formation гидратных phases occurs the топохимически - as a result of interactions of the molecules of water with surface small part mineral phases, being included in вяжущего in consequence of which it is formed colloidal mass - коагуляционная structure, consisting of the most small particles гидратных phases. Toughness of the system grows on measure of the increase degree compactions helium, which constantly increases to account of the continuinging collecting to liquids by surface of the hard particles, as well as as a result of loss влаги in consequence of высыхания.
A.A.BAYKOV has offered the theory of the repeating over and over again (1923), in which were taken into account glances and the main positions as кристаллизационного, so and colloidal mechanism of the shaping to toughness.
M.M.SYCHEV in process of the repeating over and over again essential role conducts physico-chemical condition of water on miscellaneous stage shaping the structure. Under гидратообразовании surrface energy of the system vastly increases to account of the increase to specific surface that does the system unstable.
The Influence of the additives on processes of the repeating over and over again astringent.
In B.RATINOV and T.I. Rozenberg have separated the boosters of the repeating over and over again on mechanism of the action on four classes conditionally:
1. changing растворимость вяжущего and enterring with him in chemical reaction;
2. chemical interacting with вяжущим with formation труднорастворимых join;
3. being centre to crystallizations
4. SUNG, adsorbing on grain вяжущих and new formation.
Joining the different nature pertain To first-class additive (the electrolytes, неэлектролиты), changing пересыщение in solution, but consequently and velocity гидратации and repeating over and over again вяжущих материало. Neelektrolity (for instance, alcohols), chemical not interacting with source and final phase, usually only lower their растворимость and so pertain to count;calculate;list замедлителей of the repeating over and over again.
The second-class Additive form as a result of chemical reaction with вяжущими and product their гидратации труднорастворимые material or малодиссоциированные complex join.
The third-class Additive, being crystalline затравками, relieve the separation of the new phase from пересыщенных solution so their introduction in that events reasonable, when limiting stage of the repeating over and over again is a velocity to crystallizations of the new formations.
The Fourth class form organic SUNG, allowing under their accompaniment in very small amount vastly to change the characteristic cement stone, but sometimes and add him some new.
Лекция № 12 ФХС .
Тема: Твердофазовые процессы в силикатных системах вяжущих материалов. Спекание и рекристаллизация. Реакции веществ в твердом состоянии. Механизм реакции в твердом состоянии.
Реакции веществ в твердом состоянии были открыты и стали изучаться в конце XIX - начале XX вв. Основы учения о твердых растворах заложены исследованиями П.П.Аносова, Н.Н.Бекетова, Д.К.Чернова и позднее И.В Кобба, Дж. А. Хедвала и Г Таммана.
Реакции веществ в твердом состоянии представляют большой научный и практический интерес.
Отличительной особенностью реакций в твердых фазах является то, что взаимодействие твердых веществ (обычно в виде порошков различной степени дисперсности) происходит в отсутствие жидкой фазы, при этом наряду с химическими в системе протекают физические и физико-химические процессы. Твердофазовые процессы протекают очень медленно и в реальных условиях практически никогда не доходят до конца, однако большинство смесей оксидов и силикатов реагируют в твердом состоянии при нагревании. При достижении некоторой температуры, характерной для каждого из реагирующих веществ, амплитуда колебаний атомов в кристаллической решетке становится настолько большой, что атомы могут перемещаться внутри решетки или выходить за ее пределы. Течение процесса облегчается при нагревании: решетка кристаллов становится более рыхлой, увеличивается число дефектов в решетке и существенно возрастает роль диффузионных процессов, фактически обеспечивающих взаимодействие в твердой фазе.
Диффузия – самопризвольный процесс переноса вещества, приводящий к установлению равновесного распределения концентраций в результате беспорядочного теплового движения молекул, атомов, ионов или коллоидных частиц в газах, жидкостях или твердых телах. Диффузия происходит в результате движения частиц, беспорядочного или направленного в сторону падения концентрации диффундирующего вещества, а для ионов – под действием электрического поля.
Диффузионные процессы, протекающие в твердых телах, отличаются большим разнообразием. Различают самодиффузию и гетеродиффузию.
Механизм реакции в твердом состоянии. Химические взаимодействия в смеси твердых реагентов имеют некоторые существенные особенности: протекают на поверхности раздела соответствующих фаз(имеют гетерогенный характер), зависят от пространственного расположения масс реагирующих компонентов и в конечном счете связаны с возникновением фаз измененного химического состава.
По Г.Ф.Хюттингу, процесс взаимодействия реагентов в смеси разделяется на шесть основных периодов:
«прикрывание» - соприкосновение зерен, затрудняющее доступ реагента к местам и х контакта;
Активирование- образование элементарных оболочек (квазимолекул) из передвигающихся ионов более подвижного компонента на поверхности зерен менее подвижного компонента;
Дезактивация-уменьшение подвижности частиц в образовавшихся оболочках в результате усиления их связи, с решеткой покрываемого компонента и насыщения поверхности частиц этого компонента;
Второе активирование – начало диффузии более подвижного компонента внутрь решетки менее подвижного компонента;
Образование кристаллического продукта реакции, решетка которого имеет много дефектов структуры;
Исправление дефектов решетки образовавшегося соединения.
Многочисленными исследованиями установлено, что в общем случае процесс физико-химических превращений в смеси твердых веществ может включать в себя следующие основные процессы или стадии: возникновение дефектов, разрыхление кристаллических решеток; перестройку решеток вследствие полиморфных превращений; образование и распад твердых растворов; диффузию (внешнюю, внутреннюю, поверхностную); спекание «отдых» - уменьшение числа дефектов решетки, рекристаллизацию, плавление, растворение компонентов системы в расплаве; кристаллизацию из жидкой фазы; возгонку; диссоциацию; собственно химическое взаимодействие.
Основные положения о механизме и специфических особенностях протекания реакций в кристаллических смесях сформулированы Г.Тамманом и Дж. А.Хедвалом. Они могут быть сведены к следующему:
реакции, возникающие при нагревании смесей кристаллических веществ (напрмер, солей и окстдов, основных и кислотных оксидов, металлов и оксидов, сульфидов и металлов, сульфидов и оксидов и т. д.) протекают за счет непосредственного взаимодействия между зернами этих тел. Роль жидких и газообразных веществ в этих реакциях исключается.
Реакции между твердыми веществами идут с выделением теплоты.
Достижение равновесия в системах, не содержащих твердых растворов, практически невозможно
Температура начала реакции соответствует температуре интенсивного обмена местами элементов кристаллических решеток реагирующих веществ и температуре их спекания (совпадает с этой температурой)
При полиморфном превращении одного из компонентов смеси при относительно низкой температуре химическая реакция начинается и интенсивно протекает в точке этого полиморфного превращения.
The Lecture 12 FHS.
The Subject: Tverdofazovye processes in silicate system вяжущих material. Spekanie and рекристаллизация. The Reactions material in solid states. The Mechanism to reactions in solid states.
The Reactions material in solid states were open and become be studied at the end XIX - begin XX vv. Bases of the teaching about hard solution by mortgaged studies P.P.ANOSOVA, N.N.BEKETOVA, D.K.CHERNOVA and later I.V Kobba, Dzh. A. Hedvala and G Tammana.
The Reactions material in solid states present big scientific and practical interest.
The Discriminating particularity reaction in hard phase is that interaction hard material (usually in the manner of powder different degree дисперсности) occurs in absence of the fluid phase, herewith alongside with chemical in system run physical and physico-chemical processes. Tverdofazovye processes run much slowly and in real condition practically never get to the end, however majority of the mixtures oxides and silicate in solid states when heating. At achievement of a certain temperature, typical of each of ing material, amplitude of the fluctuations atom in crystalline lattice becomes so big that atoms can move inwardly lattices or leave for her(its) limits. The Current of the process is relieved when heating: lattice crystal becomes more friable, increases the number a defect in lattice and greatly increases the role диффузионных processes, practically providing interaction in hard phase.
The Diffusion - самопризвольный process of the carrying material, bring about determination равновесного distribution concentration as a result of disorderly heat moving the molecules, atom, ion or colloidal particles in gas, liquid or hard body. The Diffusion results from moving the particles, disorderly or made for side of the fall to concentrations диффундирующего material, but for ion - under the action of electric field.
Diffuzionnye processes, running in hard body, differ the broad range. Distinguish самодиффузию and гетеродиффузию.
The Mechanism to reactions in solid states. The Chemical interactions in mixture hard reagent have some essential particularities: run on surfaces of the section corresponding to phases(have гетерогенный nature), hang from spatial location of the masses ing component and are eventually connected with arising the phases changed chemical composition.
On G.F.HYUTTINGU, the process of the interaction reagent in mixture divides for six main periods:
1) "прикрывание" - a contiguity зерен, obstructing access of the reagent to places and h contact;
2) Aktivirovanie- formation elementary shell (the квазимолекул) from moving ion of the more rolling component on surfaces зерен more rolling components;
3) Deactivation-reduction to mobilities of the particles in formed shell as a result of reinforcements their relationship, with lattice of the covered component and saturation to surfaces of the particles of this component;
4) Second активирование - begin diffusions of the more rolling component inside lattices of the more rolling component;
5) Forming the crystalline product to reactions, which lattice has much defects of the structure;
6) Correction defect of the lattice of the educated join.
The Multiple studies is installed that in general event process physico-chemical conversions in mixture hard material can comprise of itself following main processes or stage: origin defect, разрыхление crystalline lattices; the realignment of the lattices in consequence of polymorphic conversions; formation and disinteration hard solution; the diffusion (external, internal, surrface); спекание is "rest" - a reduction of the number defect lattices, рекристаллизацию, melting, system component dissolution in melt; the crystallization from fluid phase; the sublimation; диссоциацию; strictly chemical interaction.
The Main positions about mechanism and specific particularity протекания reaction in crystalline mixture are worded by G.TAMMANOM and Dzh. A.HEDVALOM. They can be сведены to the following:
1) to reactions, appearing when heating the mixtures crystalline material (напрмер, salts and окстдов, the main and acid oxides, metal and oxides, sulfide and metal, sulfide and oxides and t. d.) run to account of the direct interaction between grain these tel. The Role fluid and gaseous material in these reaction is excluded.
2) To Reactions between hard material go with separation of the heat.
3) Achievement balances in system, not containing hard solution, practically impossible
4) Temperature begin reactions corresponds to the temperature of the intensive exchange by places element crystalline lattices ing material and the temperature their спекания (complies with this temperature) 5) Under polymorphic conversion one of the component mixture under comparatively low temperature chemical reaction begins and intensive runs this polymorphic conversion in point.
Лекция № 13 ФХС .
Тема: Влияние отдельных факторов на скорость твердофазовых реакций. Дисперсность, температура, газовая и жидкая фаза. Общая характеристика процесса спекания. Спекание в твердой фазе. Рекристаллизация.
Равномерность и степень измельчения кристаллических реагентов оказывают влияние прежде всего на следующие параметры процессов, протекающих в твердой фазе: на площадь поверхности и величину поверхностной энергии зерен; на скорость растворения, возгонки, диссоциации и химического взаимодействия с другими реагентами, на толщину слоя продукта, образующегося на зернах в процессе химического взаимодействия, и на скорость диффузии через этот слой.
На практике реакции в кристаллических смесях обычно протекают при постепенном повышении температуры. При таком прохождении процесса вероятен его переход из одной области (стадии) в другую, например из области химической кинетики в диффузионную.
Газовая и жидкая фазы. Наличие жидкой и газовой фаз оказывает существенное влияние на протекание реакций в твердых фазах, главным образом увеличивая площадь поверхности взаимодействия между реагентами. Если процесс протекает при наличии газа или жидкости, то они омывают зерна, в связи с чем площадь реакционной поверхности равна (или близка) площади поверхности зерен одного из реагентов. Площадь поверхности химического взаимодействия, осуществляемого при непосредственном контакте твердых частиц, обычно в 104 …. 107 раз меньше, чем при взаимодействии, осуществляемом через газовую или жидкую фазу.
Учитывая, что роль газовой и жидкой фазы в процессах, происходящих при нагревании твердых смесей, имеет большое значение для характеристики их механизмов, эти процессы можно разделить на следующие группы:
процессы непосредственного взаимодействия между зернами твердых веществ;
процессы, протекающие при участии газовой фазы
процессы, протекающие при участии жидкой фазы;
процессы, протекающие при одновременном участии газовой и жидкой фаз.
Общая характеристика процесса спекания. В технологии силикатов обычно применяют композиции, содержащие несколько компонентов. До нагревания смеси представляют собой системы с различной пористостью, в процессе термообработки превращающиеся в более плотное тело. Явление упрочнения и уплотнения исходных, относительно малосвязанных смесей зернистых компонентов, происходящее за счет физико-химических процессов переноса вещества, развивающихся и протекающих с заметной скоростью при повышении температуры (и давления), называется спеканием.
Сложная последовательность процессов, происходящих при спекании, разделена Я.Е. Гегузиным по геометрическому признаку на три стадии. На первой стадии происходит взаимное припекание частиц, сопровождающееся увеличением поверхности их контакта. Однако суммарная поверхность контактов мала, и поры являются непрерывной фазой. На второй стадии материал превращается в сплошное пористое тело, в котором и твердая и поровая фазы являются практически непрерывными. Третья стадия характеризуется наличием разобщенных, изолированных пор, включенных в непрерывную твердую фазу; уплотнение материала на этой стадии происходит за счет уменьшения числа пор и их размеров. В реальных системах эти стадии в различной мере перекрываются, протекая одновременно.
Внешним признаком спекания служит уменьшение размеров (усадка) спекаемого тела. Перенос вещества осуществляется по одному или нескольким механизмам; спекание может происходить как в твердой фазе, так и в присутствии жидкой фазы.
Спекание в твердой фазе. При спекании протекают два параллельных процесса - образование и рост контактов между частицами и изменение формы и величины поровых каналов.
Чаще всего спекание в твердой фазе осуществляется по двум механизмам: за счет переноса вещества испарением – конденсацией и за счет диффузии.
Спекание за счет испарения – конденсации. Этот вид спекания имеет место в небольшом числе систем, поскольку для переноса вещества необходима упругость паров, превышающая 10-5….. 10-6 МПа. Такая упругость паров достигается, например, при 2200….24000С в системе, рассчитанной на получение карбида кремния, вследствие чего спекание карбида кремния активно протекает при этой температуре через паровую фазу.
Спекание диффузией. Если упругость пара мала, то более вероятным является спекание за счет объемной, и отчасти, поверхностной диффузии. Диффузионный механизм переноса вещества наблюдается при спекании большинства кристаллических фаз в отсутствие жидкой фазы и характерен, например, для спекания оксидной (огнеупоры), ферритной (ферромагнитные материалы), титанатной (конденсаторы) и других видов керамики.
Рекристаллизация. В подавляющем большинстве случаев диффузионное спекание кристаллических тел в некотором температурном интервале сопровождается образованием новых кристаллов или ростом одних зерен за счет других. Изменение количества и (или) размеров кристаллов по сравнению с исходными называется рекристаллизацией.
Следует различать основные компоненты, слагающие процесс рекристаллизации, - первичную, вторичную и рост зерен.
Первичная (истинная, рекристаллизация обработки) рекристаллизация – процесс, при котором в массе, подвергнутой пластической деформации, образуются центры кристаллизации и растут зерна новообразований.
Вторичная (аномальная, собирательная, прерывистая) рекристаллизация – процесс, не связанный с предварительной деформацией тела.
При повышении температуры в любом тонкозернистом агрегате кристаллов независимо от того, протекает или нет первичная рекристаллизация, происходит увеличение среднего размера кристаллов; этот процесс называется ростом зерен.
The Lecture 13 FСS
The Subject: Influence separate factor on velocity твердофазовых reaction. Dispersnosti, the temperature, gas and fluid phase. The General feature of the process спекания. Spekanie in hard phase. Rekristallizaciya.
The Uniformity and degree of the pulverizing crystalline reagent render the influence on the following parameters of the processes first of all, running in hard phase: on area of the surfaces and value to surrface energy зерен; on velocity of the dissolution, the sublimations, диссоциации and chemical interaction with the other reagent, on product layer thickness, образующегося on grain in process of the chemical interaction, and on velocity of the diffusions through this layer.
In practice reactions in crystalline mixture usually run under gradual increasing of the temperature. Under such passing of the process probable his(its) transition from one area (the stage) in another, for instance from area of the chemical kinetics in диффузионную.
Gas and fluid phase. Presence fluid and gas phases renders the essential influence upon протекание reaction in hard phase, mainly enlarging area to surfaces of the interaction between reagent. If process runs at presence of the gas or liquids, that they wash grain, in connection with than area to reactionary surface is (or close) area to surfaces зерен one of the reagents. The Area to surfaces of the chemical interaction, realized under direct contact of the hard particles, in 104 usually . 107 once less, than at interaction, realized through gas or fluid phase.
Considering that role gas and fluid phase in process, occurring when heating the hard mixtures, is of great importance for feature their mechanism, these processes possible to divide into the following groups:
1. processes of the direct interaction between grain hard material;
2. processes, running at participation of the gas phase
3. processes, running at participation of the fluid phase;
4. processes, running under simultaneous participation gas and fluid phases.
The General feature of the process спекания. In technologies silicate usually use to compositions, containing several components. Before heating mixture present itself systems with different porosity, in process термообработки changing in more thick body. The Phenomena упрочнения and compactions source, comparatively малосвязанных mixtures зернистых component, occurring to account physico-chemical processes of the carrying material, developing and running with observable velocity at increasing of the temperature (and pressures), is identified спеканием.
The Complex sequence of the processes, occurring under спекании, is divided by YA.E. Geguzinym on geometric sign on three stages. On the first stage occurs mutual припекание particles, being accompanied increase to surfaces of their contact. However total surface contact small, and times are an unceasing phase. On the second stage material changes in utter porous body, in which and hard and поровая phases are practically unceasing. The Third stage is characterized presence disassociated, insulated times, comprised of unceasing harden phase; the compaction of the material on this stage occurs to account of the reduction of the number of the times and their sizes. In real system of these stage in different measure are overlayed, running simultaneously.
The External sign спекания serves the reduction of the sizes (the shrinkage) спекаемого bodies. Carrying material is realized on one or several mechanisms; спекание can occur both in hard phase, and in whitness of fluid phase.
Spekanie in hard phase. Under спекании run two parallel processes - a formation and growing contact between particle and change the form and values поровых channel.
Most often спекание in hard phase is realized on two mechanisms: to account of the carrying material by evaporation - a condensation and to account of the diffusions.
Spekanie to account of the evaporation - a condensations. This type спекания exists in небольшом count;calculate;list systems since for carrying material necessary bounce of the vapour(pair)s, exceeding 10-5 .. 10-6 MPA. Such bounce of the vapour(pair)s is reached, for instance, under 2200 .24000С in system, calculated on reception of the carbide silicon in consequence of which спекание carbide silicon actively runs under this temperature through steam phase.
Spekanie diffusion. If bounce pair small, that more probable is спекание to account three-dementional, and somewhat, surrface diffusion. Diffuzionnyy mechanism of the carrying material exists under спекании majority of the crystalline phases in absence of the fluid phase and typical, for instance, for спекания оксидной (огнеупоры), ферритной (the ferromagnetic material), титанатной (the capacitors) and the other type of the ceramics.
Rekristallizaciya. In suppressing majority of the events диффузионное спекание crystalline tel formation new crystal is accompanied in a certain warm-up interval or growing one зерен to account others. Change amount and (or) of the sizes crystal рекристаллизацией is identified in contrast with source.
Follows to distinguish the main components, composing process рекристаллизации, - primary, secondary and growing зерен.
Primary (true, рекристаллизация processing) рекристаллизация - a process, under which en masse, subject to plastic deformation, are formed centres to crystallizations and grow grain of the new formations.
Secondary (anomalous, collective, прерывистая) рекристаллизация - a process, unconnected with preliminary deforming the body.
At increasing of the temperature in any тонкозернистом unit crystal regardless of that, runs or no primary рекристаллизация, occurs increase the average size crystal; this process is identified the growing зерен.
Лекция № 14 ФХС .
Тема: Спекание в присутствии жидкой фазы. Твердожидкостное спекание.
Спекание в присутствии жидкой фазы, смачивающей твердую, является самым распространенным случаем спекания в технологии силикатов. Такое спекание может происходить как при наличии, так и в отсутствие взаимодействия между жидкой и твердой фазами.
Спекание в отсутствие заметного взаимодействия твердой и жидкой фаз, имеющее место при получении некоторых огнеупоров, сопровождается заполнением жидкой фазы пор между зернами. Если количество жидкой фазы достаточно, то все поры будут заполнены, произойдет перегруппировка зерен и усадка материала. Движущей силой этого вида спекания является поверхностное натяжение расплава, определяющее возникновение в замкнутой округлой поре отрицательного давления, которое приводит к заплыванию поры и сближению зерен.
Поверхностное натяжение силикатных расплавов при нагревании изменяется мало и не оказывает на процесс спекания большого влияния. Вязкость силикатных расплавов в значительной мере зависит от их состава и температуры. Она не должна быть малой, чтобы не произошла деформация материала (изделий) под действием силы тяжести. Например, у типичных натрийкальцийсиликатных стекол в температурном интервале в 1000С вязкость изменяется в тысячу раз и более. Учитывая характер изменения коэффициента вязкости при изменении температуры, режим обжига силикатных изделий тщательно контролируется.
Если при спекании происходит взаимодействие жидкой и твердой фаз, спекание протекает в три стадии. На первой стадии после появления жидкой фазы происходит сближение и перераспределение зерен. На второй стадии протекает процесс растворения твердой фазы в жидкой и по мере ее насыщения – кристаллизация из нее этой же фазы. На третьей стадии заканчивается рекристаллизации и прекращается уплотнение, формируется жесткий каркас тела.
Твердожидкостное спекание. В таких силикатных материалах, как фарфор, портландцементный клинкер и другие, когда в процессе обжига происходит образование новых кристаллических фаз, процессы спекания еще более сложны. В этих случаях процесс спекания слагается из двух групп реакций, часто взаимно накладывающихся, - реакций в твердых фазах и реакций с участием расплава. Г.Куколев назвал такое спекание смешанным твердожидкостным спеканием.
Спекание портландцементного клинкера. При нагревании портландцементных сырьевых смесей отдельные компоненты претерпевают различные физико-химические превращения: глинистые минералы (водные алюмосиликаты) теряют примешанную и адсорбированную влагу, что сопровождается аморфизацией решетки; карбонаты диссоциируют с выделением углекислого газа, кристаллы кварца претерпевают полиморфные превращения.
Реакции в твердом состоянии, происходящие при обжиге портланцементного клинкера характеризуются многоступенчатостью.
Портланцементные сырьевые смеси при температуре 1200….13000С состоят из минералов, образовавшихся в твердых фазах, и непрореагировавшего свободного оксида кальция. Дальнейшее повышение температуры вызывает появление расплава, процесс спекания идет с участием жидкой фазы. Количество и состав жидкости при нагревании изменяются зп счет насыщения эвтектического расплава растворяющимися в нем компонентами смеси. В нормальном по составу клинкере количество жидкой фазы колеблется от 20 до 30%.
При достаточном насыщении жидкой фазы необходимыми компонентами начинается процесс кристаллизации расплава с выделением новой фазы - трехкальциевого силиката. Процесс последовательно проходит в три стадии:
насыщение и пересыщение жидкой фазы необходимыми компонентами;
образование центров кристаллизации новой фазы;
рост кристаллов.
Спекание портландцементного клинкера сопровождается изменением объема. Величина усадки зависит от температуры и времени спекания.
Усадка материала сопровождается изменением пористости, начальная пористость зерен составляет от 30 до 50% в зависимости от способа подготовки сырья (способа производства клинкера).
Lecture № 14 ФХС.
Theme: sintering at the presence of a liquid phase. Твердожидкостное sintering.
The sintering at the presence of a liquid phase moistening firm, is the most widespread case of sintering in technology силикатов. Such sintering can occur both at presence, and in absence of interaction between liquid and firm phases.
The sintering in absence of appreciable interaction of firm and liquid phases having place at reception some огнеупоров, is accompanied by filling of a liquid phase пор between grains. If quantity(amount) of a liquid phase it is enough, all поры will be filled, there will be a regrouping of grains and усадка of a material. Driving force of this kind of sintering is the superficial tension расплава, determining occurrence in closed округлой поре of negative pressure, which results to заплыванию поры and rapproachement of grains.
The superficial tension силикатных расплавов at heating changes a little and does not render on process of sintering of the large influence. The viscosity силикатных расплавов appreciably depends on their structure and temperature. She should not be small, that there was no deformation of a material (products) by gravity. For example, at typical натрийкальцийсиликатных of glasses in a temperature interval in 1000С the viscosity changes in one thousand time and more. Taking into account character of change of factor of viscosity at change of temperature, the mode обжига силикатных of products is carefully supervised.
If at sintering there is an interaction of liquid and firm phases, the sintering proceeds in three stages. At the first stage after occurrence of a liquid phase there is a rapproachement and redistribution of grains. At the second stage the process of dissolution of a firm phase in liquid proceeds and in process of its(her) saturation - кристаллизация from it(her) of same phase. At the third stage comes to an end рекристаллизации and the condensation stops, the rigid skeleton of a body is formed.
Твердожидкостное sintering. In such силикатных materials, as porcelain, портландцементный клинкер and others, when in process обжига there is an education of new crystal phases, the processes of sintering are even more complex(difficult). In these cases the process of sintering is composed from two groups of reactions often mutually imposed, - reactions in firm phases and reactions with participation расплава. Г.Куколев has named such sintering mixed твердожидкостным as sintering.
Sintering портландцементного клинкера. At heating портландцементных of raw mixes the separate components undergo various физико-chemical transformations: the clay minerals (water алюмосиликаты) lose примешанную and адсорбированную a moisture, that is accompanied аморфизацией of a lattice; карбонаты диссоциируют with allocation of carbonic gas, the crystals of quartz undergo polymorphic transformations.
The reactions in a firm condition occurring at обжиге портланцементного клинкера are characterized by multigradualness.
Портланцементные raw mixes at temperature 1200 … .13000С consist of minerals formed in firm phases, and not reacted free оксида кальция. The further increase of temperature causes occurrence расплава, the process of sintering goes with participation of a liquid phase. Quantity(amount) and structure of a liquid at heating change зп the bill of saturation эвтектического расплава растворяющимися in him by components of a mix. In normal on structure клинкере the quantity(amount) of a liquid phase changes from 20 up to 30 %.
At sufficient saturation of a liquid phase by necessary components the process кристаллизации расплава with allocation of a new phase - трехкальциевого силиката begins. The process consistently passes in three stages:
1. Saturation and пересыщение of a liquid phase by necessary components;
2. Education of the centres кристаллизации of a new phase;
3. Growth of crystals.
The sintering портландцементного клинкера is accompanied by change of volume. The size усадки depends on temperature and time of sintering.
Усадка of a material is accompanied by change пористости, initial пористость of grains makes from 30 up to 50 % depending on a way of preparation of raw material (way of manufacture клинкера).
Lecture № 15 НЕТ ФХС.
Лекция № 16 ФХС
Тема: Методы построения диаграмм состояния. Однокомпонентные системы в производстве вяжущих материалов. Элементы строения диаграммы и правило работы с ними.
1. Сущность экспериментальных методов построения диаграмм состояния.
2. Принципы непрерывности и соответствия.
3. Динамический и статистический методы построения диаграмм.
4. Однокомпонентные системы и правило работы с ними.
Сущность экспериментальных методов построения диаграмм состояния сводится к определению опытным путем температур фазовых превращений, характера и состава фаз, находящихся в данной системе в равновесии при различных температурах. Эти исследования проводятся различными методами физического и физико-химического анализа - термическим, микроскопическим, электронно-микроскопическим, рентгенографическим, электронографическим и другими методами.
Правильность построения диаграмм состояния на основе экспериментальных данных контролируются правилом фаз и так называемыми принципами непрерывности и соответствия сформулированные Н.С. Курнаковым, которым диаграмма не должна противоречить.
Принцип непрерывности заключается в том, что при непрерывном изменении параметров, определяющих состояние систем, свойства отдельных фаз и системы в целом изменяются так же непрерывно, но при условии, что не изменяется фазовый состав системы, то есть не возникают новые и не исчезают старые фазы.
Принцип соответствия заключается в том, что каждой фазе или совокупности фаз систем, находящихся в равновесии, соответствует на диаграмме определенный геометрический образ- точка, линия, область. Наиболее распространенным методом экспериментального построения диаграмм состояния являются динамический метод (метод построения кривых охлаждения или нагревания) и статистический метод (метод закалки).
Сущность динамического метода построения диаграмм состояния состоит в построении методом термического анализа кривых охлаждения(или нагревания) образующихся в координатах температура время.
Применение динамического метода построения диаграмм состояния силикатных систем ограничено тем, что скорость достижения равновесия в этих системах часто мало и высоковязкие силикатные расплавы весьма склонные к переохлаждению. В связи с этим метод построения кривых охлаждения для силикатных систем может дать искаженные результаты.
Метод построения диаграмм состояния. Для силикатных систем более приемлемым является оптический метод (метод закалки).
Принцип статического метода заключается в фиксации равновесных при данной температуре фаз в системе и последующего определения их состава содержания в системе. Метод состоит из следующих операций:
проводят отжим;
закалки;
определение состава и содержание фаз в закаленном образце.
Это проводится с помощью метода микроскопического, рентгенографического анализов, или другими методами.
Метод закалки является чрезвычайно трудоемким из – за необходимости исследовать большое число смесей различного состава и при различных температурах.
Однокомпонентные системы.
Однокомпонентные диаграммы состояния строятся в координатах температура (ось абцисс)- давление газообразной фазы или упругость паров над кристаллической или жидкой фазами (ось ординат).В данном случае давление принимается за переменный параметр системы и правило фаз используется для характеристики равновесных состояний однокомпонентных систем в виде:
F= k+2-p
Единственым устойчивым оксидом кремния является кремний SiO2 . Однокомпонентная диаграмма состояния системы построена К Феннером. Эта диаграмма имеет существенное значение для технологии производства динасовых огнеупоров, изделий тонкой керамики, кварцевого стекла и тд, в которых SiO2 является основной и весьма важной составной частью.
В однокомпонентных системах помимо определения температур плавления, очень важно изучить явления полиморфных превращений, наблюдающихся тогда, когда вещество в кристаллическом состоянии образует две или несколько модификаций, различающихся между собой по запасу внутренней энергии и физическим свойствам.
Явление полиморфизма широко распространены среди природных и искусственных силикатов и в ряде имеют большое практическое значение. Превращения полиморфных модификаций могут иметь обратимый или необратимый характер.
Обратимые или энантиотропные превращения наблюдаются при нагревании и охлаждении минерала лейцита K2O* Al2O3*4SiO2
СУществуют однако и так называемые монотропные полиморфные модификации кристаллических веществ, которые неустойчивы или метастабильны вплоть до температуры плавления данного вещества. Например: из трех модификаций двуокиси титана: квадратного рутила, квадратного анатаза и румбического брукита, истинно устойчив только рутил, в который превращаются при нагревании другие разновидности, обратимых же превращений осуществить нельзя.
При всех температурах ниже точки плавления анатаз и брукит оказываются в состоянии ложной устойчивости, ложного равновесия.
Элементы строения диаграммы и правило работы с ними.
К элементам строения диаграммы состояния однокомпонентных систем относятся: координатные оси, линии упругости пара, область стабильного существования отдельных фаз и кратные точки.
Lecture № 16 ФХС
Theme: methods of construction of the diagrams of a condition. Однокомпонентные of system in manufacture of knitting materials. Elements of a structure of the diagram and rule of job with them.
1. Essence of experimental methods of construction of the diagrams of a condition.
2. Principles of a continuity and conformity.
3. Dynamic and statistical methods of construction of the diagrams.
4. Однокомпонентные of system and rule of job with them.
The essence of experimental methods of construction of the diagrams of a condition is reduced to definition by practical consideration of temperatures of phase transformations, character and structure of phases which are taking place in the given system in balance at various temperatures. These researches are spent by various methods of the physical and физико-chemical analysis - thermal, microscopic, электронно-microscopic, рентгенографическим, электронографическим and other methods.
Correctness of construction of the diagrams of a condition on the basis of experimental data are supervised by a rule of phases and so-called principles of a continuity and conformity formulated Н.С. Курнаковым, to which the diagram should not contradict.
The principle of a continuity consists that at continuous change of parameters determining a condition of systems, property of separate phases and the systems as a whole change as continuously, but provided that the phase structure of system does not change, that is do not arise new and the old phases do not disappear.
The principle of conformity consists that to each phase or set of phases of systems which are taking place in balance, there corresponds(meets) on the diagram the certain geometrical image a point, line, area. The most widespread method of experimental construction of the diagrams of a condition are a dynamic method (method of construction of curve cooling or heatings) and statistical method (method закалки).
The essence of a dynamic method of construction of the diagrams of a condition consists in construction by a method of the thermal analysis of curve cooling (or heating) formed in coordinates temperature time.
The application of a dynamic method of construction of the diagrams of a condition силикатных of systems is limited to that speed of achievement of balance in these systems often it is not enough and высоковязкие силикатные расплавы rather inclined to overcooling. In this connection the method of construction of curve cooling for силикатных of systems can give the deformed results.
Method of construction of the diagrams of a condition. For силикатных of systems more acceptable is the optical method (method закалки).
The principle of a static method consists in fixing equilibrium at given temperature of phases in system and subsequent definition of their structure of the contents in system. The method consists of the following operations:
1. Spend отжим;
2. закалки;
3. Definition of structure and contents of phases in закаленном a sample.
It is spent with the help of a method microscopic, рентгенографического of the analyses, or other methods.
The method закалки is extremely labour-consuming of - for necessities to investigate the large number of mixes of various structure and at various temperatures.
Однокомпонентные of system.
Однокомпонентные diagram of a condition are under construction in coordinates temperature (axis абцисс) - pressure газообразной phase or elasticity паров above crystal or liquid phases (axis of ordinates) .В given case pressure is accepted for variable parameter of system and rule of phases is used for characteristic of equilibrium condition однокомпонентных systems as:
F = k+2-p
Единственым steady оксидом of silicon the silicon SiO2 is. Однокомпонентная the diagram of a condition of system is constructed To Феннером. This diagram has essential meaning(importance) for the "know-how" динасовых огнеупоров, products of thin ceramics, quartz glass and тд, in which SiO2 is the basic and rather important component.
In однокомпонентных systems besides definition of temperatures плавления, it is very important to study the phenomena of polymorphic transformations observed then, when the substance in a crystal condition forms of two or several updatings differing among themselves on a stock of internal energy and physical properties.
The phenomenon полиморфизма are widely distributed among natural and artificial силикатов and in a number(line) have the large practical meaning(importance). The transformations of polymorphic updatings can have convertible or irreversible character.
Convertible or энантиотропные of transformation are observed at heating and cooling of a mineral лейцита K2O* Al2O3*4SiO2
EXIST however and so-called монотропные polymorphic updatings of crystal substances, which are unstable or метастабильны down to temperature плавления of the given substance. For example: from three updatings двуокиси титана: square рутила, square анатаза and румбического брукита, is true is steady only рутил, to which turn at heating other versions the convertible transformations cannot be carried out.
At all temperatures the points плавления анатаз are lower and брукит are able to of false stability, false balance.
Elements of a structure of the diagram and rule of job with them.
To elements of a structure of the diagram of a condition однокомпонентных of systems concern: coordinate axes, line of elasticity pair, area of stable existence of separate phases and multiple points.
Лекция 17 ФХС
Тема: Явление полиморфизма и изоморфизма. Изоморфные замещения в силикатах. Твердые растворы в силикатах. Диаграмма SiO2. Последовательность фазовых превращений и характеристика полиморфных форм.
При исследовании равновесных систем конечной целью физико-химического анализа является установление зависимости между параметрами системы характеризующими ее, состояние и в частности определение составов равновесных фаз при тех или иных параметрах состояния.
Термодинамическая диаграмма представляет собой диаграмму на которой по оси координат откладывают значения термодинамических параметров или функции состояния. Такие диаграммы позволяют описать изменение свойств системы при изменении ее параметров.
Особенность диаграмм состояния заключается в том, что любая точка на диаграмме имеет строгий физико-химический смысл. Другими словами каждое состояние системы изображается на диаграмме некоторой точкой, которая называется фигуративной точкой.
Диаграммы состояния имеют исключительно важное значение для многих областей промышленности, в частности микроэлектроники, химической технологии, технологии силикатных и тугоплавких неметаллических материалов.
Эти диаграммы позволяют решать ряд и важных практических и теоретических проблем связанных с получением разнообразных веществ с различным сочетанием свойств.
Диаграмма состояния во многих случаях дает возможность объяснить и усовершенствовать процессы, протекающие при образовании данного материала, установить и объяснить влияние фазового состава продукта на его свойства для получения материала заранее заданными свойствами.
Следует отметить, что непосредственно в процессе обжига многих силикатных продуктов при высоких температурах, когда образуется жидкая фаза их состояния приближается к равновесному. Это равновесие нарушается обычно только в процессе слишком быстрого охлаждения, которое имеет место при изготовлении многих силикатных продуктов.
Полиморфизмом называется способность вещества одного и того же состава существовать в зависимости от внешних условий в нескольких кристаллических формах (полиморфных модификациях) с различной структурой (для простых веществ это явление иногда называют аллотропией).
К внешним условиям, определяющим полиморфизм, относятся температура и давление.
Твердыми растворами замещения называются такие растворы, которые образуются в результате статического замещения атомов или ионов в структуре какого-либо кристаллического вещества (растворителя или матрицы) атомами или ионами другого (растворенного) вещества, занимающими в результате этого регулярные узлы кристаллической решетки.
Диаграмма SiO2. Последовательность фазовых превращений и характеристика полиморфных форм.
Однокомпонентная система SiO2 является системой со сложным полиморфизмом. Насчитывается 10 кристаллических и две стеклообразные формы SiO2 .
Превращение модификаций SiO2 подчиняется следующей схеме (по Феннеру):
870 1470 1728
![]()
 кварц
тридимит
кристаболит
расплав
кварц
тридимит
кристаболит
расплав

![]() 575
575
167 230
![]() кварц
тридимит
кристаболит
кварц
тридимит
кристаболит
120
![]() тридимит
тридимит
Главными модификациями SiO2 является кварц, тридимит, кристаболит. Модификационные превращения кристаллических разновидностей кремнезема можно разделить на две группы: быстро протекающие и медленно протекающие.
К первой группе относятся превращения модификаций в пределах 1 минеральной разновидности:
кварц кварц ;
тридимит тридимит тридимит ;
кристаболит кристаболит
Эти превращения сопровождаются небольшими изменениями в решетки кремнезема.
Ко второй группе относятся превращения из одной минеральной разновидности в другую:
кварц тридимит кристаболит
Эти превращения сопровождаются глубокой перестройкой решетки. Устойчивыми модификациями в этой системе являются четыре твердые фазы:
кварц , кварц , тридимит , кристаболит .
Она жидкая фаза – расплав, одна газообразная фаза – пар.

Линия 0 – 1 – 3 – 5 –М – 8 делит плоскость между координатными осями на две части.
В I части все точки отображают такие условия: температура, давление, при которых SiO2 находится в виде пара.
Область II поле кварца.
Область III поле кварца.
Область IV поле тридимит.
Область VI поле расплава.
При этом линия 1– 2 представляет условие равновесного состояния между кварцем и кварцем, а линия 3 – 4 между кварцем и тридимитом.
Тройные точки 1 – 3 – 5 характеризуют равновесное состояние двух твердых фаз и пара SiO2 .
Точка М – равновесное состояние кристаболита расплава SiO2 и пара SiO2 .
Превращение кварца в тридимит и тридимит в кристаболит совершается медленно и для полного завершения требуется длительность времени. Поэтому при быстром превращении кварца выше 870 0С он не успевает перейти в тридимит и кристаболит и может существовать некоторое время в модификации кварца в неустойчивом или метастабильном состояниях вплоть до 1600 С. выше этой температуры кварц превращается в расплав.
Если расплав SiO2 охлаждать быстро, то он не успевает закристаллизоваться и застывает в виде стеклообразной массы (кварцевого песка)
Во всех этих кодификационных превращениях изменяется плотность. Общее увеличение плотности составляет 16,5%. Это имеет большое значение в производстве. Кроме этих модификаций кремнезема открыто еще 4 новых модификации : коэсит, китит, стишовит, волокнистый SiO2 . все полиморфные модификации SiO2 отличаются друг от друга оптическими свойствами плотностью, коэффициентом линейного расширения , строением кристаллической решетки и другими.
Полиморфные модификации SiO2 .
кварц широко распространен в природе как составная часть горных пород. В природе кварц встречается в виде горного хрусталя (прозрачная разновидность кварца), жильного кварца, кварцевых песков, халцедона, агата, яшмы, кремния.
Природные разновидности кварца применяются при изготовлении оптических и электрических приборов, в ювелирном деле, производстве тонкой и грубой керамики.
кварц близок по структуре кварцу. В природных условиях не встречается.
Тридимит содержится в кислых породах. Кристабалит найден в стеклах, горных породах.
Lecture 17 ФХС
Theme: the phenomenon полиморфизма and изоморфизма. Изоморфные of replacement in силикатах. Firm solutions in силикатах. The diagram SiO2. Проследовательность of phase transformations and characteristic of the polymorphic forms.
At research of equilibrium systems a ultimate goal of the физико-chemical analysis is the establishment of dependence between parameters of system describing her(it), condition and in particular definition of structures of equilibrium phases at those or other parameters of a condition.
The thermodynamic diagram represents the diagram on which on an axis of coordinates postpone meanings(importance) of thermodynamic parameters or functions of a condition. Such diagrams allow to describe change of properties of system at change of its(her) parameters.
The feature of the diagrams of a condition consists that any point on the diagram has strict физико-chemical sense. In other words each condition of system is represented on the diagram by some point, which is called as a figurative point.
The diagrams of a condition have the extremely important meaning(importance) for many areas of an industry, in particular of microelectronics, chemical technology, technologies силикатных and refractory not metal materials.
These diagrams allow to decide(solve) a number(line) both important practical and theoretical problems of the various substances, connected to reception, with a various combination of properties.
The diagram of a condition in many cases enables to explain and to improve processes proceeding at education of the given material, to establish and to explain influence of phase structure of a product on his(its) properties for reception of a material beforehand by given properties.
It is necessary to note, that is direct in process обжига many силикатных of products at high temperatures, when the liquid phase of their condition is formed comes nearer to equilibrium. This balance is broken usually only in process of too fast cooling, which takes place at manufacturing many силикатных of products.
Полиморфизмом the ability of substance of the same structure is called to exist depending on external conditions in the several crystal forms (polymorphic updatings) with various structure (for simple substances this phenomenon sometimes name аллотропией).
To external conditions determining полиморфизм, concern temperature and pressure.
As firm solutions of replacement such solutions are called which are formed as a result of static replacement of atoms or ions in structure any of crystal substance (solvent or matrix) atoms or ions of other (dissolved) substance borrowing(occupying) as a result of it regular units of a crystal lattice.
The diagram SiO2. Проследовательность of phase transformations and characteristic of the polymorphic forms.
Однокомпонентная the system SiO2 is system with complex(difficult) полиморфизмом. Is totaled 10 crystal and two стеклообразные of the form SiO2.
The transformation of updatings SiO2 submits to the following circuit (on Феннеру):
870 1470 1728
кварц тридимит кристаболит расплав
575
167 230
кварц тридимит кристаболит
120
тридимит
The main updatings SiO2 is the quartz, тридимит, кристаболит. Модификационные the transformations of crystal versions кремнезема can be divided(shared) into two groups: quickly proceeding and slowly proceeding.
The transformations of updatings concern to the first group within the limits of 1 mineral version:
кварц кварц ;
тридимит тридимит тридимит ;
кристаболит кристаболит
These transformations are accompanied by small changes in lattices кремнезема.
The transformations from one mineral version in another concern to the second group:
кварц тридимит кристаболит
These transformations are accompanied by deep reorganization of a lattice. Steady updatings in this system are four firm phases:
Quartz, quartz, тридимит, кристаболит.
She a liquid phase - расплав, one газообразная a phase - pairs.
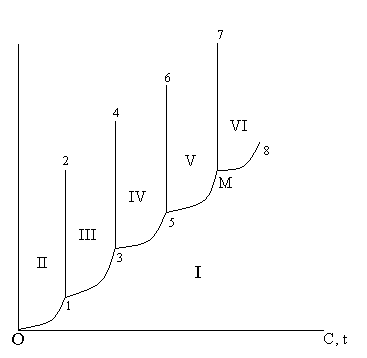
The line 0 - 1 - 3 - 5 -М - 8 divides a plane between coordinate axes into two parts.
In I parts all points display such conditions: temperature, pressure, at which SiO2 is as pair.
Area II a field of quartz.
Area III a field of quartz.
Area IV a field тридимит.
Area VI a field расплава.
Thus the line 1- 2 represents a condition of an equilibrium condition between quartz and quartz, and line 3 - 4 between quartz and тридимитом.
The threefold points 1 - 3 - 5 characterize an equilibrium condition of two firm phases and pair SiO2.
Point М - equilibrium condition кристаболита расплава SiO2 and pair SiO2.
The transformation of quartz in тридимит and тридимит in кристаболит is made slowly and complete end needs duration of time. Therefore at fast transformation of quartz he is higher 870 0С has not time to proceed(pass) in тридимит and кристаболит and there can be some time in updating quartz in unstable or метастабильном condition down to 1600 С. above than this temperature the quartz turns in расплав.
If расплав SiO2 to cool quickly, he has not time закристаллизоваться and stiffens as стеклообразной of weight (quartz sand)
In all these кодификационных transformations density changes. The general(common) increase of density makes 16,5 %. It has the large meaning(importance) in manufacture. Except for these updatings кремнезема 4 new updatings are open: коэсит, китит, стишовит, fibrous SiO2. all polymorphic updatings SiO2 differ from each other by optical properties of density, factor of linear expansion, structure of a crystal lattice and others.
Polymorphic updatings SiO2.
The quartz is widely distributed in a nature as a component of mountain breeds. In a nature the quartz meets as mountain crystal (transparent version of quartz), жильного of quartz, quartz sand, халцедона, агата, яшмы, silicon.
The natural versions of quartz are applied at manufacturing optical and electrical devices, in jeweller business, manufacture of thin and rough ceramics.
The quartz is close on structure to quartz. Naturally does not meet.
Тридимит contains in sour breeds. Кристабалит is found in glasses, mountain breeds.
Лекция №18 ФХС .
Тема: Кристаллические разновидности диоксида кремния. Аморфные разновидности диоксида кремния.
Известны три агрегатных состояния вещества: жидкое, газообразное, твердое. Вещество в твердом состоянии сохраняет форму и объем, в жидком состоянии только объем. У вещества в газообразном состоянии отсутствует упругость формы, а упругость объема имеет односторонний характер.
Твердое состояние имеет две формы: кристаллическую и аморфную. В настоящее время с аморфной отождествляют и стеклообразную форму. В кристаллах расположение ионов атомов или молекул (вернее центров их колебаний) упорядоченно, то есть имеет вид кристаллической решетки. Физические свойства кристаллов не одинаковы в разных направлениях (анизотропность свойств). Вещество в форме кристаллов обладает меньшей энергией чем, вещество того же химического состава в аморфном состоянии и, поэтому последнее менее устойчиво. В аморфном веществе расположение частиц неупорядоченно и его физические свойства в любых направлениях одинаковы.
Аморфная форма, как менее устойчивая при соответствующих температурах, может быть превращена в кристаллические. Стекла так же при умеренном направлении стремятся с выделением тепла перейти в устойчивую кристаллическую форму и обладают постоянством свойств по любым направлениям. В тоже время стекла характеризуются большой плотностью и некоторой упорядоченностью в расположении частиц.
Стеклом называются все аморфные тела получаемые путем переохлаждения расплава независимо от их химического состава и температурной области затвердевания и обладающие в результате постепенного увеличения вязкости механическими свойствами твердых тел, причем процесс перехода жидкого состояния в стеклообразное должен быть обратимым.
Кристаллические разновидности диоксида кремния.
Кристаллическая структура природных модификаций диоксида кремния, за исключением стишовита и китита, представляет собой каркас из тетраэдров [SiO4] 4- .
Известны две полиморфные модификации кварца – тригональный кварц и гексагональный кварц.
Тридимит, тридимит, тридимит , тридимит кристаллизуются (низкотемпературный тридимит) в ромбической (псевдогексагональной)сингонии. Искусственный тридимит имеет большое значение как составная часть динасового кирпича.
Кристаболит диморфен , кристаболит кристаллизуется в тетрагональной (псевдокубической ) сингонии.
Существуют разновидности кристаболита:
-люссатит (волокнистые кристаллы со слегка деформированной решеткой);
- люссатин и псевдолюссатин;
-коэсит;
- меланофлогит (лейкофлогит);
- стишовит (стиповерит);
- китит;
- волокнитсый кремнезем, полученный синтетическим путем.
Аморфные разновидности диоксида кремния.
В природе кварцевое стекло встречается в виде лешательерита. Искусственное кварцевое стекло получают переохлаждением расплавов кремнезема. Различают несколько видов кварцевого песка:
Особо чистое;
прозрачное (оптическое и техническое);
непрозрачное.
Порошкообразный аморфный диоксид кремния имеет высокую химическую активность. В природе существуют такие разновидности аморфного кремнезема, как различные опаловые породы – гейзерит, диатомит трепел, опока, опаловые породы биогенного происхождения – скелеты радиоляры.
Lecture №18 ФХС.
Theme: crystal versions диоксида of silicon. Аморфные of a version диоксида of silicon.
Three modular condition of substance are known: liquid, газообразное, firm. The substance in a firm condition saves the form and volume, in a liquid condition only volume. The substance in газообразном a condition does not have elasticity of the form, and the elasticity of volume has unilateral character.
The firm condition has two forms: crystal and аморфную. Now with аморфной identify and стеклообразную the form. In crystals the arrangement of ions of atoms or molecules (is more correct than the centres of their fluctuations) is ordered, that is looks like a crystal lattice. The physical properties of crystals are not identical in different directions (анизотропность of properties). The substance in the form of crystals has smaller energy than, substance of the same chemical structure in аморфном a condition and, therefore last is less steady. In аморфном substance the arrangement of particles is disorder also his(its) physical properties in any directions are identical.
Аморфная the form, as less steady at the appropriate temperatures, can be transformed in crystal. The glasses as at a moderate direction aspire with allocation of heat to proceed(pass) in the steady crystal form and have a constancy of properties on any directions. In too time of a glass are characterized in large density and some упорядоченностью in an arrangement of particles.
As glass are called all аморфные of a body received by overcooling расплава irrespective of their chemical structure and temperature area of hardening and having as a result of gradual increase of viscosity by mechanical properties of firm bodies, and the process of transition of a liquid condition in стеклообразное should be convertible.
Crystal versions диоксида of silicon.
The crystal structure of natural updatings диоксида of silicon, behind exception стишовита and китита, represents a skeleton from тетраэдров [SiO4] 4-.
Two polymorphic updatings of quartz - тригональный quartz and гексагональный quartz are known.
Тридимит, тридимит, тридимит , тридимит crystallize (низкотемпературный тридимит) in rhombic (псевдогексагональной) сингонии. Artificial тридимит has the large meaning(importance) as a component динасового of a brick.
Кристаболит диморфен, кристаболит crystallizes in тетрагональной (pseudo-cubic) сингонии.
There are versions кристаболита:
-люссатит (fibrous crystals with the slightly deformed lattice);
- люссатин and псевдолюссатин;
-коэсит;
- меланофлогит (лейкофлогит);
- стишовит (стиповерит);
- китит;
- волокнистый кремнезем, received by a synthetic way.
Аморфные of a version диоксида of silicon.
In a nature the quartz glass meets as лешательерита. Artificial quartz glass receive by overcooling расплавов кремнезема. Distinguish some kinds of quartz sand:
Especially pure(clean);
Transparent (optical and technical);
Opaque.
Порошкообразный аморфный диоксид of silicon has high chemical activity. In a nature there are such versions аморфного кремнезема, as various опаловые of breed - гейзерит, диатомит трепел, опока, опаловые of breed биогенного of an origin - skeletons радиоляры.
Лекция №18 ФХС .
Тема: Кристаллические разновидности диоксида кремния. Аморфные разновидности диоксида кремния.
Известны три агрегатных состояния вещества: жидкое, газообразное, твердое. Вещество в твердом состоянии сохраняет форму и объем, в жидком состоянии только объем. У вещества в газообразном состоянии отсутствует упругость формы, а упругость объема имеет односторонний характер.
Твердое состояние имеет две формы: кристаллическую и аморфную. В настоящее время с аморфной отождествляют и стеклообразную форму. В кристаллах расположение ионов атомов или молекул (вернее центров их колебаний) упорядоченно, то есть имеет вид кристаллической решетки. Физические свойства кристаллов не одинаковы в разных направлениях (анизотропность свойств). Вещество в форме кристаллов обладает меньшей энергией чем, вещество того же химического состава в аморфном состоянии и, поэтому последнее менее устойчиво. В аморфном веществе расположение частиц неупорядоченно и его физические свойства в любых направлениях одинаковы.
Аморфная форма, как менее устойчивая при соответствующих температурах, может быть превращена в кристаллические. Стекла так же при умеренном направлении стремятся с выделением тепла перейти в устойчивую кристаллическую форму и обладают постоянством свойств по любым направлениям. В тоже время стекла характеризуются большой плотностью и некоторой упорядоченностью в расположении частиц.
Стеклом называются все аморфные тела получаемые путем переохлаждения расплава независимо от их химического состава и температурной области затвердевания и обладающие в результате постепенного увеличения вязкости механическими свойствами твердых тел, причем процесс перехода жидкого состояния в стеклообразное должен быть обратимым.
Кристаллические разновидности диоксида кремния.
Кристаллическая структура природных модификаций диоксида кремния, за исключением стишовита и китита, представляет собой каркас из тетраэдров [SiO4] 4- .
Известны две полиморфные модификации кварца – тригональный кварц и гексагональный кварц.
Тридимит, тридимит, тридимит , тридимит кристаллизуются (низкотемпературный тридимит) в ромбической (псевдогексагональной)сингонии. Искусственный тридимит имеет большое значение как составная часть динасового кирпича.
Кристаболит диморфен , кристаболит кристаллизуется в тетрагональной (псевдокубической ) сингонии.
Существуют разновидности кристаболита:
-люссатит (волокнистые кристаллы со слегка деформированной решеткой);
- люссатин и псевдолюссатин;
-коэсит;
- меланофлогит (лейкофлогит);
- стишовит (стиповерит);
- китит;
- волокнитсый кремнезем, полученный синтетическим путем.
Аморфные разновидности диоксида кремния.
В природе кварцевое стекло встречается в виде лешательерита. Искусственное кварцевое стекло получают переохлаждением расплавов кремнезема. Различают несколько видов кварцевого песка:
Особо чистое;
прозрачное (оптическое и техническое);
непрозрачное.
Порошкообразный аморфный диоксид кремния имеет высокую химическую активность. В природе существуют такие разновидности аморфного кремнезема, как различные опаловые породы – гейзерит, диатомит трепел, опока, опаловые породы биогенного происхождения – скелеты радиоляры.
Lecture №18 ФХС.
Theme: crystal versions диоксида of silicon. Аморфные of a version диоксида of silicon.
Three modular condition of substance are known: liquid, газообразное, firm. The substance in a firm condition saves the form and volume, in a liquid condition only volume. The substance in газообразном a condition does not have elasticity of the form, and the elasticity of volume has unilateral character.
The firm condition has two forms: crystal and аморфную. Now with аморфной identify and стеклообразную the form. In crystals the arrangement of ions of atoms or molecules (is more correct than the centres of their fluctuations) is ordered, that is looks like a crystal lattice. The physical properties of crystals are not identical in different directions (анизотропность of properties). The substance in the form of crystals has smaller energy than, substance of the same chemical structure in аморфном a condition and, therefore last is less steady. In аморфном substance the arrangement of particles is disorder also his(its) physical properties in any directions are identical.
Аморфная the form, as less steady at the appropriate temperatures, can be transformed in crystal. The glasses as at a moderate direction aspire with allocation of heat to proceed(pass) in the steady crystal form and have a constancy of properties on any directions. In too time of a glass are characterized in large density and some упорядоченностью in an arrangement of particles.
As glass are called all аморфные of a body received by overcooling расплава irrespective of their chemical structure and temperature area of hardening and having as a result of gradual increase of viscosity by mechanical properties of firm bodies, and the process of transition of a liquid condition in стеклообразное should be convertible.
Crystal versions диоксида of silicon.
The crystal structure of natural updatings диоксида of silicon, behind exception стишовита and китита, represents a skeleton from тетраэдров [SiO4] 4-.
Two polymorphic updatings of quartz - тригональный quartz and гексагональный quartz are known.
Тридимит, тридимит, тридимит , тридимит crystallize (низкотемпературный тридимит) in rhombic (псевдогексагональной) сингонии. Artificial тридимит has the large meaning(importance) as a component динасового of a brick.
Кристаболит диморфен, кристаболит crystallizes in тетрагональной (pseudo-cubic) сингонии.
There are versions кристаболита:
-люссатит (fibrous crystals with the slightly deformed lattice);
- люссатин and псевдолюссатин;
-коэсит;
- меланофлогит (лейкофлогит);
- стишовит (стиповерит);
- китит;
- волокнистый кремнезем, received by a synthetic way.
Аморфные of a version диоксида of silicon.
In a nature the quartz glass meets as лешательерита. Artificial quartz glass receive by overcooling расплавов кремнезема. Distinguish some kinds of quartz sand:
Especially pure(clean);
Transparent (optical and technical);
Opaque.
Порошкообразный аморфный диоксид of silicon has high chemical activity. In a nature there are such versions аморфного кремнезема, as various опаловые of breed - гейзерит, диатомит трепел, опока, опаловые of breed биогенного of an origin - skeletons радиоляры.
Лек №19 ФХС
Тема : Однокомпонентная системы SiO2, Al2O3, .MgО, ZnO2
Окись алюминия широко распространена в составе многих природных алюмосиликатах как водных так и безводных. В свободном состоянии встречается в природе в формах минерала корунда, представляющего наиболее устойчивую форму - модификацию Al2O3 .
Кроме него были получены исключительно синтетическим путем еще 2 формы : γ- Al2O3 и - Al2O3
Твердость корунда по шкале твердости равна 9. Как природная так и плавленая окись алюминия используется для изготовления абразивных материалов. Высокая температура плавления корунда 2050С обуславливает применение его в огнеупорном деле в составе высокоогнеупорных материалов типа : динамидона, коракса и зинтеркорунда.
В больших масштабах окись алюминия используется для получения металлического алюминия путем элетролиза расплава глинозема в криолите.
Весьма интересная отрасль химической технологии – это производство синтетических рубинов и сапфиров, представляющее собой драгоценные разновидности корунда, окрашенные примесями небольших количеств окиси хрома ( красные рубины), окисью титана и окисью железа (синие сапфиры).
Искусственные рубины вследствие своей высокой твердости применяются в качестве опорных камней в часовых механизмах и других точных измерительных приборах. Первоначально производство рубинов осуществлялось по методу разработанному Вернейлем.
Мрожно получать кристаллы корунда, окрашенные в самые разнообразные цвета. По этому же способу при соответственной шихтовке синтезируеся монокристальная шпинель MgO·Al2O3 , также обладающая большой твердостью.
В настоящее время по этому методу также получают монокристаллы синтетического рутила, которые благодаря высокому светопреломлению и оптической дисперсии являются при соответствующей огранке заменителями бриллиантов.
В дальнейшем метод получения монокристальных рубинов был значительно усовершенствован Поповым, разработавшим способ получения игольчатых кристаллов длиной до полуметра при поперечнике в 3-5 мм.
Заготовки, получаемые по способу Попова, значительно легче поддаются механической обработке и сильно увеличивают производительность аппаратов для синтеза рубинов. Кроме того, по способу Попова можно получить рубины, обладающие определенной кристаллографической ориентировкой, что облегчает дальнейшую их обработку и применение.
-модификация глинозема – гексагональной системы отличается от корунда значительно меньшей плотностью, хорошей спайностью и меньшей, сравнительно с корундом, твердостью, равной 5,5-6,0 по шкале твердости.
- глинозем получают в значительных количествах при выплавке в электрических печах искусственного белого корунда, коракса, из технической окиси алюминия, обычно содержащей примеси щелочей.
Кристаллы - глинозема обычно содержат примеси растворенных в них основных окислов, чаще всего окиси натрия, содержание которой может доходить до 7 %. Поэтому - Al2O3 не может рассматриваться как полиморфная модификация окиси алюминия, а в действительности так называют некоторые алюминаты с большим содержанием Al2O3 .
Кристаллы - Al2O3 недостаточно тверды и способны раскалываться в тонкие пластинки по плоскости спайности, поэтому нежелательно образование его в плавленом корунде, употребляемом для изготовления абразивных материалов.
Более рационально применять литые огнеупорные кирпичи из -глинозема для работы в печных пространствах с высоким содержанием щелочей в парообразном состоянии, как например, ванных печах для варки стекла и тому подобное. Подобного рода плавленые огнеупоры из
-глинозема называются монофраксом А, монофраксом H. При прокаливании -глинозем првращается в корунд, при этом удаляются содержащиеся в нем щелочи.
Низкая плотность -глинозема, проистекающая из малоуплотненной структуры его кристаллической решетки, приводит к тому, что основания
( Na2O, K2O), стабилизирующие эту решетку, вступают в реакции катионного обмена, если обрабатывать кристаллы -глинозема при высокой температуре расплавами солей других металлов, например BaCl2. SrCl2 CaCl2.
Характерно, что все алюминаты имеют совершенно тождественный тип гексагональной пространственной решетки.
Третья кубическая форма окиси алюминия получается при прокаливании до 900-9500С водного глинозема. При более высоких температурах происходит перерождение γ- глинозема в корунд. Оно сопровождается значительным уплотнением материала, понижением его растворимости в кислотах и повышением светопреломления. При прокаливании рыхлого, гигроскопического γ- глинозема перерождение его в корунд обычно наступает ранее полной его перекристаллизации.
В 1933 году Белянкин доказал, что γ- глинозем получается в температурном интервале 700-10000С при нагревании ряда огнеупорных глин, при обжиге бокситов, кальцинации технических гидратов окиси алюминия и имеет большое практическое значение.
Система Al2O3 имеет существенное значение для технологии высокоогнеупорных абразивных, химически стойких и других керамических материалов.
Лек №19 FCS
Theme: Однокомпонентная system SiO2, Al2O3, .MgО, ZnO2
Окись of aluminium is widely distributed in structure many natural алюмосиликатах both water and waterless. In a free condition meets in a nature in the forms of a mineral корунда, representing the steadiest form - updating Al2O3.
Except for him(it) 2 forms were received by an extremely synthetic way:? - Al2O3 and - Al2O3
The hardness корунда on a scale of hardness is equal 9. As natural and плавленая окись of aluminium is used for manufacturing абразивных of materials. High temperature плавления корунда 2050С causes application it(him) in fire-resistant business in structure высокоогнеупорных of materials of a type: динамидона, коракса and зинтеркорунда.
In the large scales окись of aluminium is used for reception of metal aluminium by элетролиза расплава глинозема in криолите.
The rather interesting branch of chemical technology is manufacture of synthetic rubies and sapphires representing precious versions корунда, painted by impurity of small quantities(amounts) окиси хрома (red rubies), окисью титана and окисью of iron (dark blue sapphires).
The artificial rubies owing to the high hardness are applied as basic stones in hour mechanisms and other exact measuring devices. Originally manufacture of rubies was carried out on a method developed Вернейлем.
Мрожно to receive crystals корунда, painted in the diversified colours. On the same way at respective шихтовке синтезируеся monocrystalline шпинель MgO·Al2O3, also having the large hardness.
Now on this method also receive monocrystals synthetic рутила, which due to high светопреломлению and optical дисперсии are at appropriate огранке substitutes of brilliants.
In the further method of reception of monocrystalline rubies was considerably advanced Поповым, developed a way of reception of needle crystals of length up to полуметра at a diameter in 3-5 mm.
The preparations received on a way Попова, give in much more easy to machining and strongly increase productivity of devices for synthesis of rubies. Besides on a way Попова it is possible to receive the rubies having certain(determined) кристаллографической orientation, determined, that facilitates their further processing and application.
The updating глинозема - гексагональной of system differs from корунда considerably in smaller density, good спайностью and smaller, compared with корундом, hardness equal 5,5-6,0 till scales to hardness.
- глинозем receive in significant quantities(amounts) at melt in electrical furnaces artificial white корунда, коракса, from technical окиси of aluminium usually containing impurity of alkalis.
The crystals - глинозема usually contain impurity of the basic oxides, dissolved of them, more often окиси натрия, which contents can reach 7 %. Therefore - Al2O3 can not be considered(examined) as polymorphic updating окиси of aluminium, and actually so some name алюминаты with the large contents Al2O3.
The crystals - Al2O3 are unsufficiently firm and are capable to break up in a thin plate on a plane спайности, education it(him) in плавленом корунде, used for manufacturing абразивных of materials therefore is undesirable.
It is more rational to apply cast fire-resistant bricks from -глинозема to job in oven spaces with the high contents of alkalis in парообразном a condition, as for example, ванных furnaces for cooking a glass and so forth. Similar sort плавленые огнеупоры from
-глинозема are called монофраксом And, монофраксом H. At прокаливании -глинозем првращается in корунд, thus the alkalis, contained in him leave.
Low density -глинозема, проистекающая from малоуплотненной of structure of his(its) crystal lattice, results that the bases
( Na2O, K2O), stabilizing this lattice, enter in reaction катионного of an exchange if to process crystals -глинозема at high temperature расплавами of salts of other metals, for example BaCl2. SrCl2 CaCl2.
Is characteristic, that all алюминаты have a completely identical type гексагональной of a spatial lattice.
The third cubic form окиси of aluminium turns out at прокаливании up to 900-9500С water глинозема. At higher temperatures there is a regeneration? - глинозема in корунд. It is accompanied by significant condensation of a material, downturn of his(its) solubility in acids and increase светопреломления. At прокаливании friable, гигроскопического? - глинозема the regeneration it(him) in корунд usually comes before complete it(him) перекристаллизации.
In 1933 Белянкин has proved, what? - глинозем it turns out in a temperature interval 700-10000С at heating a number(line) fire-resistant глин, at обжиге бокситов, кальцинации technical гидратов окиси of aluminium and has the large practical meaning(importance).
The system Al2O3 has essential meaning(importance) for technology высокоогнеупорных абразивных, chemically proof and other ceramic materials.
Лекция № 20
Тема : Двухкомпонентные системы. Элементы строения и правило работы с диаграммами состояния двухкомпонентных систем.
Диаграммы двухкомпонентных систем с эвтектикой без твердых растворов и химических соединений с расслоением в жидкой фазе с полиморфными превращениями компонентов и образование твердых растворов.

Рисунок. Диаграмма состояния двухкомпонентной системы с эвтектикой.
На
рисунке представлен тип диаграммы
состояния двухкомпонентной системы
А-В с эвтектикой (без бинарных химических
соединений и твердых растворов).
Рассмотрим путь кристаллизации расплава
состава а. Конечными фазами кристаллизации
любого бинарного состава в этой системе
будут компоненты А и В , а кристаллизация
будет заканчиваться при эвтектической
температуре, то есть в точке эвтектике.
При понижении температуре от точки а
до в будет происходить только охлаждение
расплава, при достижении температуры
ликвидуса tB
жидкая фаза
(расплав)состава В окажется насыщенным
по отношению к компоненту А (в области
tА
, tе
- Е) в
равновесии с жидкостью находятся
кристаллы А. Состав жидкой фазы будет
изменятся при этом по кривой ликвидуса
от точки в до Е (система моловариантна).
В точке Е одновременно выделяются
кристаллы А и В, следовательно жидкость
состава Е насыщена по отношению к обоим
компонентам. Таким образом, для состава
точки а путь изменения состава жидкой
фазы при охлаждении можно схематически
изобразить следующим образом:
![]()
Рассмотрим путь изменения состава твердой фазы при кристаллизации того же расплава. Первые кристаллы компонента А начинают выделяться при температуре от tB до tе , твердая фаза будет состоять только из кристаллов А. при кристаллизации эвтектической жидкости состав твердой фазы начинает обогащаться компонентом В.
Правило определения путей кристаллизации в двухкомпонентных системах с химическими соединениями разлагающимися конгруэнтно и инконгруэнтно.

На рисунке приведена диаграмма состояния двухкомпонентной системы с индивидуальным химическим соединением АВ плавящимся без разложения (конгруэнтно). В соответствии с правилом определения конечных фаз кристаллизации все составы, лежащие влево от вертикали tАВ – АВ заканчивается кристаллизоваться Е1, а лежащее в право в точке Е2. Поскольку соединение АВ является индивидуальным химическим соединением состав точно отвечающий этому соединению полностью закристаллизуется или расплавиться при постоянной tАВ .
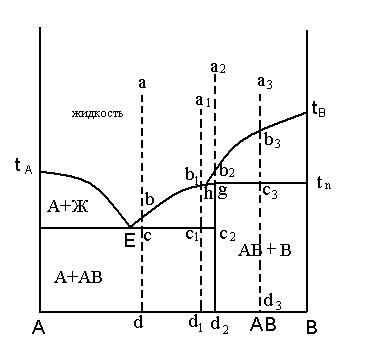
На
рисунке приведена диаграмма состояния
двухкомпонентной системы с химическим
соединением АВ плавящимся с разложением
(инконгруэнтно). Характерной точкой
этой диаграммы является инвариантная
точка n
(точка перитектики). Рассмотрим пути
кристаллизации некоторых расплавов в
этой системе. Состав а1.
При охлаждении состава а1
на участке
а1 в1
происходит
понижение его температуры. При температуре
соответствующей точке в1
на кривой
ликвидуса начинается кристаллизация
компонента В, а состав жидкой фазы будет
изменяться по кривой ликвидуса в1
n
при одновременной кристаллизации В. В
точке перитектики n
при постоянной tn
происходит
перитектическая реакция:![]() в результате которой выделяется АВ. Для
данного исходного состава расплава
кристаллизация в точке перитектики
закончится не может, так как конечными
фазами кристаллизации а1
является
соединение А и АВ. Вертикаль состава а1
d1
попадает
между точками состава соединений А и
АВ, а компонент А в продуктах кристаллизации
при перитектической температуре
отсутствует. Поэтому в результате
перитектической реакции полностью
исчезает компонент В, а жидкость остается.
В дальнейшем состав жидкой фазы изменяется
по кривой ликвидус Е с выделением
кристаллов АВ и наконец в точке Е
кристаллизация заканчивается с
одновременным выделением конечных фаз
кристаллизации кристаллов А и АВ. Ниже
эвтектической точки будет происходить
при понижении температуры только
охлаждении смеси кристаллов А и АВ по
поверхности состава с1d1
. Таким
образом путь изменения жидкой фазы при
охлаждении расплава а1
можно
изобразить следующим образом: а1
- в1
– n
– Е
в результате которой выделяется АВ. Для
данного исходного состава расплава
кристаллизация в точке перитектики
закончится не может, так как конечными
фазами кристаллизации а1
является
соединение А и АВ. Вертикаль состава а1
d1
попадает
между точками состава соединений А и
АВ, а компонент А в продуктах кристаллизации
при перитектической температуре
отсутствует. Поэтому в результате
перитектической реакции полностью
исчезает компонент В, а жидкость остается.
В дальнейшем состав жидкой фазы изменяется
по кривой ликвидус Е с выделением
кристаллов АВ и наконец в точке Е
кристаллизация заканчивается с
одновременным выделением конечных фаз
кристаллизации кристаллов А и АВ. Ниже
эвтектической точки будет происходить
при понижении температуры только
охлаждении смеси кристаллов А и АВ по
поверхности состава с1d1
. Таким
образом путь изменения жидкой фазы при
охлаждении расплава а1
можно
изобразить следующим образом: а1
- в1
– n
– Е
Для состава а2 : а2 – в2 – n .
Для состава а3 : а3 – в3 – n
