
- •Оглавление
- •Тема 1. Основные классы неорганических соединений 8
- •3.2. Решение задач 39
- •6.4 Индивидуальные задания 76
- •Введение
- •Тема 1. Основные классы неорганических соединений
- •1.1 Основные понятия и законы химии
- •1.2 Основные классы неорганических соединений
- •1.3 Решение типовых задач
- •В) определение количества молекул в образце.
- •1.4 Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Определить количество кальция в основном компоненте простого суперфосфата (Ca(н2ро4)2 ×2 CaS04).
- •Вариант 9
- •Определить количество азота в основном компоненте аммонийной селитры (нитрате аммония).
- •Вариант 10
- •Определить количество кальция в основном компоненте двойного суперфосфата (дигидрофосфате кальция).
- •Вариант 11
- •Определить количество оксида кальция в основном компоненте двойного суперфосфата (дигидрофосфате кальция).
- •Вариант 12
- •Определить содержание калия в основном компоненте поташа (карбонате калия).
- •Вариант 13
- •Определить содержание оксида калия в основном компоненте поташа (карбоната калия).
- •Вариант 14
- •Определить количество аммиака в основном компоненте аммофоса (дигидрофосфате аммония).
- •Вариант 15
- •Определить количество азота в основном компоненте аммофоса (дигидрофосфате аммония).
- •Вариант 16
- •Определить количество кальция в основном компоненте преципитата (СаНро4 ×2 н2о).
- •Вариант 17
- •Определить количество оксида кальция в основном компоненте преципитата (СаНро4 ×2 н2о).
- •Вариант 18
- •Определить количество оксида кальция в основном компоненте простого суперфосфата (Ca(н2ро4)2 ×2 CaS04).
- •Вариант 19
- •Вариант 20
- •Определить количество фосфора в основном компоненте аммофоса (дигидрофосфате аммония).
- •1.5 Лабораторная работа. Основные классы неорганических соединений.
- •1.6 Контрольные вопросы для самопроверки
- •Тема 2. Строение атома и периодический закон д.И. Менделеева
- •2.1. Квантовые представления о строении атома
- •2.2 Периодический закон д.И. Менделеева
- •2.3 Решение задач
- •2.4 Индивидуальные задания
- •2.5 Контрольные вопросы для самопроверки
- •Тема 3. Химическая связь и строение вещества
- •3.1. Закономерности изменения характеристик и свойств химической связи
- •3.2. Решение задач
- •3.2. Индивидуальные задания
- •3.3 Контрольные вопросы для самопроверки
- •Тема 4. Закономерности химических процессов
- •4.1 Термодинамика
- •4.2 Химическая кинетика и химическое равновесие
- •4.3 Решение задач
- •4.4. Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Лабораторная работа: Химическая кинетика.
- •Методика выполнения опыта:
- •4.6 Контрольные вопросы для самопроверки
- •Тема 5. Дисперсные системы
- •5.1. Понятие о дисперсных системах
- •5.2 Коллоидные системы
- •5.3 Поверхностные явления в дисперсных системах
- •5.4 Решение задач
- •5.5 Индивидуальные задания
- •5.6 Лабораторная работа: Получение и свойства коллоидных
- •5.7 Контрольные вопросы для самопроверки
- •Тема 6. Растворы
- •6.1 Способы выражения концентрации растворов
- •6.2 Свойства разбавленных растворов неэлектролитов
- •6.3 Решение задач
- •Tзам. - ? Расчет ведем по законам Рауля:
- •6.4 Индивидуальные задания вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •6.5 Лабораторная работа: Приготовление растворов
- •Методика выполнения работы:
- •6.6 Контрольные вопросы для самопроверки
- •Тема 7. Свойства разбавленных растворов электролитов
- •7.1 Электролитическая диссоциация
- •7.2 Реакции ионного обмена
- •7.3 Водородный показатель, рН. Среда растворов.
- •7.4 Гидролиз солей
- •7.5 Индивидуальные задания
- •7.6 Лабораторная работа: Теория электролитической диссоциации
- •7.7 Лабораторная работа: Гидролиз солей
- •7.8 Контрольные вопросы для самопроверки
- •Тема 8. Окислительно-восстановительные реакции
- •8.1 Правила нахождения степеней окисления
- •8.2. Решение задач
- •8.3. Индивидуальные задания
- •8.4 Лабораторная работа: Окислительно-восстановительные реакции
- •8.5 Контрольные вопросы для самопроверки
- •Тема 9. Электрохимические процессы
- •9.1 Гальванический элемент
- •9.2 Коррозия металлов
- •9.3 Решение задач
- •9.4 Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •9.5 Лабораторная работа: Гальванические элементы
- •9.6 Лабораторная работа: Коррозия металлов
- •9.7 Контрольные вопросы для самопроверки
- •Тема 10. Биогенные химические элементы
- •10.1 Важнейшие элементы агрономического значения
- •10.2 Индивидуальные задания Вариант 1
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вычислите массовые доли железа в соединениях: FeO, Fe2o3, Fe3o4. В каком из этих соединений массовая доля железа наибольшая?
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •10.3 Лабораторная работа: Свойства соединений биогенных элементов
- •10.4 Контрольные вопросы для самопроверки по теме «s-элементы»
- •10.5 Контрольные вопросы для самопроверки по теме «р-элементы»
- •10.6 Контрольные вопросы для самопроверки по теме «d-элементы»
- •Тест для самоконтроля Вариант 1
- •Вариант 2
- •Приложение 1 приложение 2 Номенклатура важнейших кислот и солей
- •Приложение 3
- •Приложение 4 Стандартные термодинамические потенциалы
- •Приложение 5 Ряд стандартных электродных потенциалов
- •Литература
5.4 Решение задач
Пример 1. Напишите формулу мицеллы CrCl3 (избыток) + NH4OH →. Укажите: а) знак заряда коллоидной частицы; б) электролит-коагулятор, обладающий меньшим порогом коагуляции (Na2SO4, КNO3 или CuCl2).
Решение.
В основе процесса образования коллоида лежит реакция
CrCl3 + 3NH4OH →. Cr(ОН)3↓ + 3NH4Сl
Функцию стабилизатора выполняет компонент, взятый в избытке (CrCl3). Формула мицеллы имеет следующий вид:
{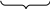
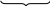
 [m
Cr(OH)3]nCr3+(n-x)Cl-}x+xCl-
[m
Cr(OH)3]nCr3+(n-x)Cl-}x+xCl-
Ядро адсорбционный слой
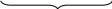 Заряд
гранулы мицеллы
Заряд
гранулы мицеллы
гранула
Заряд гранулы (коллоидной частицы) положительный, следовательно, коагуляцию будет вызывать анион, имеющий наибольший отрицательный заряд (правило Шульца-Гарди). Наибольшей коагулирующей способностью в нашей задаче обладает ион SO42-.. Следовательно, электролит-коагулятор, обладающий меньшим порогом коагуляции - Na2SO4.
5.5 Индивидуальные задания
Определите дисперсионную среду и дисперсную фазу в следующих дисперсных системах:
1 |
Туман, сливочное масло, клей ПВА |
11 |
Взбитые сливки, лимфа, строительные растворы |
2 |
Зубная паста, плазма крови, дым |
12 |
Гель для волос, керамика, цветные стекла |
3
|
Газированные напитки, почва, мармелад |
13 |
Резиновый клей, желе, чистящий порошок |
4 |
Облака, пищеварительный сок, поролон |
14 |
Минеральная вода с газом, тущь, студень |
5 |
Смог, майонез, кирпич |
15 |
Томатный сок, стиральный порошок, гуашь |
6 |
Торт «Птичье молоко», пенопласт, освежитель воздуха |
16 |
Крем для рук, текстильные ткани, пыль в воздухе |
7 |
Пена монтажная, кисель, помада |
17 |
Нефть, мазь, апельсиновый сок |
8 |
Горные породы, тело медузы, водоэмульсионная краска |
18 |
Известь для побелки, минеральная руда, кондитерский крем |
9 |
Песчаная буря, шампунь, маргарин |
19 |
Ингалипт, простокваша, пемза |
10 |
Лак для волос, цитоплазма, пористый шоколад |
20 |
Пена для бритья, рубин, мазь |
Построить мицеллу:
1 |
Na2SiO3(изб) + MgCl2→ |
11 |
Ca(NO3)2 (изб) + Na2CO3→ |
2 |
CuCl2 + Na2CrO4 (изб)→ |
12 |
FeSO4 + Ba2S ( избыток )→ |
3 |
Na3PO4 (изб) + AgNO3→ |
13 |
CaCl2 (изб) + K3PO4→ |
4 |
NaOH+CuCl2 (избыток)→ |
14 |
Co(NO3)2+ NaOH (изб)→ |
5 |
NaCl (изб) +Pb(NO3)2→ |
15 |
MgSO4 (изб) + BaBr2 → |
6 |
NH4Br+ AgNO3 (изб)→ |
16 |
CuCl2 (изб) + Na2CrO4 → |
7 |
ZnCl2 (избыток) + KOH→ |
17 |
Ca(NO3)2 + Na2CO3(изб) → |
8 |
Bi(NO3)3 + NaOH (изб)→ |
18 |
Na3PO4 + AgNO3(изб) → |
9 |
HgCl2 (избыток) + FeI2→ |
19 |
ZnCl2 + KOH(избыток) → |
10 |
MgSO4 + BaBr2 (изб) → |
20 |
Na2SiO3+ MgCl2(изб) → |
Для мицеллы из задания 2 определить заряд коллоидной частицы. Расположить электролиты в ряд по возрастанию коагулирующей способности:
1 |
ZnBr2, Na3PO4, Bi2 (SO4)3 |
11 |
Ca(NO3)2,Na3[Fe(CN)6],K2SiO3 |
2 |
BaBr2, K3PO4, Fe2 (SO4)3 |
12 |
NaI, K3 PO4, ZnSO4 |
3 |
NH4NO3, AlCl3, MgBr2 |
13 |
ZnBr2, Na3PO4, Na2SO4 |
4 |
ZnBr2, Na3PO4, Na2 CO3 |
14 |
AlCl3, CaS, NaCl |
5 |
CoCl3, NaOH, CuSO4 |
15 |
Na2SO3, ZnCl2, Na3PO4 |
6 |
NaNO3, K3PO4, BaS |
16 |
BaBr2, K3PO4, Fe2 (SO4)3 |
7 |
Na3PO4, CuSO4, Ba(OH)2 |
17 |
Ca(NO3)2,Na3[Fe(CN)6], K2SiO3 |
8 |
(NH4)2S, FeCl3, MgSO4 |
18 |
NH4NO3, AlCl3, MgBr2 |
9 |
NaI, K3 PO4, ZnSO4 |
19 |
Na3PO4, CuSO4, Ba(OH)2 |
10 |
Na2SO3, ZnCl2, Na3PO4 |
20 |
ZnBr2, Na3PO4, Bi2 (SO4)3 |
