
- •Оглавление
- •Тема 1. Основные классы неорганических соединений 8
- •3.2. Решение задач 39
- •6.4 Индивидуальные задания 76
- •Введение
- •Тема 1. Основные классы неорганических соединений
- •1.1 Основные понятия и законы химии
- •1.2 Основные классы неорганических соединений
- •1.3 Решение типовых задач
- •В) определение количества молекул в образце.
- •1.4 Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Определить количество кальция в основном компоненте простого суперфосфата (Ca(н2ро4)2 ×2 CaS04).
- •Вариант 9
- •Определить количество азота в основном компоненте аммонийной селитры (нитрате аммония).
- •Вариант 10
- •Определить количество кальция в основном компоненте двойного суперфосфата (дигидрофосфате кальция).
- •Вариант 11
- •Определить количество оксида кальция в основном компоненте двойного суперфосфата (дигидрофосфате кальция).
- •Вариант 12
- •Определить содержание калия в основном компоненте поташа (карбонате калия).
- •Вариант 13
- •Определить содержание оксида калия в основном компоненте поташа (карбоната калия).
- •Вариант 14
- •Определить количество аммиака в основном компоненте аммофоса (дигидрофосфате аммония).
- •Вариант 15
- •Определить количество азота в основном компоненте аммофоса (дигидрофосфате аммония).
- •Вариант 16
- •Определить количество кальция в основном компоненте преципитата (СаНро4 ×2 н2о).
- •Вариант 17
- •Определить количество оксида кальция в основном компоненте преципитата (СаНро4 ×2 н2о).
- •Вариант 18
- •Определить количество оксида кальция в основном компоненте простого суперфосфата (Ca(н2ро4)2 ×2 CaS04).
- •Вариант 19
- •Вариант 20
- •Определить количество фосфора в основном компоненте аммофоса (дигидрофосфате аммония).
- •1.5 Лабораторная работа. Основные классы неорганических соединений.
- •1.6 Контрольные вопросы для самопроверки
- •Тема 2. Строение атома и периодический закон д.И. Менделеева
- •2.1. Квантовые представления о строении атома
- •2.2 Периодический закон д.И. Менделеева
- •2.3 Решение задач
- •2.4 Индивидуальные задания
- •2.5 Контрольные вопросы для самопроверки
- •Тема 3. Химическая связь и строение вещества
- •3.1. Закономерности изменения характеристик и свойств химической связи
- •3.2. Решение задач
- •3.2. Индивидуальные задания
- •3.3 Контрольные вопросы для самопроверки
- •Тема 4. Закономерности химических процессов
- •4.1 Термодинамика
- •4.2 Химическая кинетика и химическое равновесие
- •4.3 Решение задач
- •4.4. Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Лабораторная работа: Химическая кинетика.
- •Методика выполнения опыта:
- •4.6 Контрольные вопросы для самопроверки
- •Тема 5. Дисперсные системы
- •5.1. Понятие о дисперсных системах
- •5.2 Коллоидные системы
- •5.3 Поверхностные явления в дисперсных системах
- •5.4 Решение задач
- •5.5 Индивидуальные задания
- •5.6 Лабораторная работа: Получение и свойства коллоидных
- •5.7 Контрольные вопросы для самопроверки
- •Тема 6. Растворы
- •6.1 Способы выражения концентрации растворов
- •6.2 Свойства разбавленных растворов неэлектролитов
- •6.3 Решение задач
- •Tзам. - ? Расчет ведем по законам Рауля:
- •6.4 Индивидуальные задания вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •6.5 Лабораторная работа: Приготовление растворов
- •Методика выполнения работы:
- •6.6 Контрольные вопросы для самопроверки
- •Тема 7. Свойства разбавленных растворов электролитов
- •7.1 Электролитическая диссоциация
- •7.2 Реакции ионного обмена
- •7.3 Водородный показатель, рН. Среда растворов.
- •7.4 Гидролиз солей
- •7.5 Индивидуальные задания
- •7.6 Лабораторная работа: Теория электролитической диссоциации
- •7.7 Лабораторная работа: Гидролиз солей
- •7.8 Контрольные вопросы для самопроверки
- •Тема 8. Окислительно-восстановительные реакции
- •8.1 Правила нахождения степеней окисления
- •8.2. Решение задач
- •8.3. Индивидуальные задания
- •8.4 Лабораторная работа: Окислительно-восстановительные реакции
- •8.5 Контрольные вопросы для самопроверки
- •Тема 9. Электрохимические процессы
- •9.1 Гальванический элемент
- •9.2 Коррозия металлов
- •9.3 Решение задач
- •9.4 Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •9.5 Лабораторная работа: Гальванические элементы
- •9.6 Лабораторная работа: Коррозия металлов
- •9.7 Контрольные вопросы для самопроверки
- •Тема 10. Биогенные химические элементы
- •10.1 Важнейшие элементы агрономического значения
- •10.2 Индивидуальные задания Вариант 1
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вычислите массовые доли железа в соединениях: FeO, Fe2o3, Fe3o4. В каком из этих соединений массовая доля железа наибольшая?
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •10.3 Лабораторная работа: Свойства соединений биогенных элементов
- •10.4 Контрольные вопросы для самопроверки по теме «s-элементы»
- •10.5 Контрольные вопросы для самопроверки по теме «р-элементы»
- •10.6 Контрольные вопросы для самопроверки по теме «d-элементы»
- •Тест для самоконтроля Вариант 1
- •Вариант 2
- •Приложение 1 приложение 2 Номенклатура важнейших кислот и солей
- •Приложение 3
- •Приложение 4 Стандартные термодинамические потенциалы
- •Приложение 5 Ряд стандартных электродных потенциалов
- •Литература
5.2 Коллоидные системы
Коллоидные системы (золи) – это высокодисперсные системы с жидкой дисперсионной средой. в отличие от истинных растворов, образующихся самопроизвольно, для образования коллоидных систем необходима затрата внешней энергии (химической, механической, электрической и др).
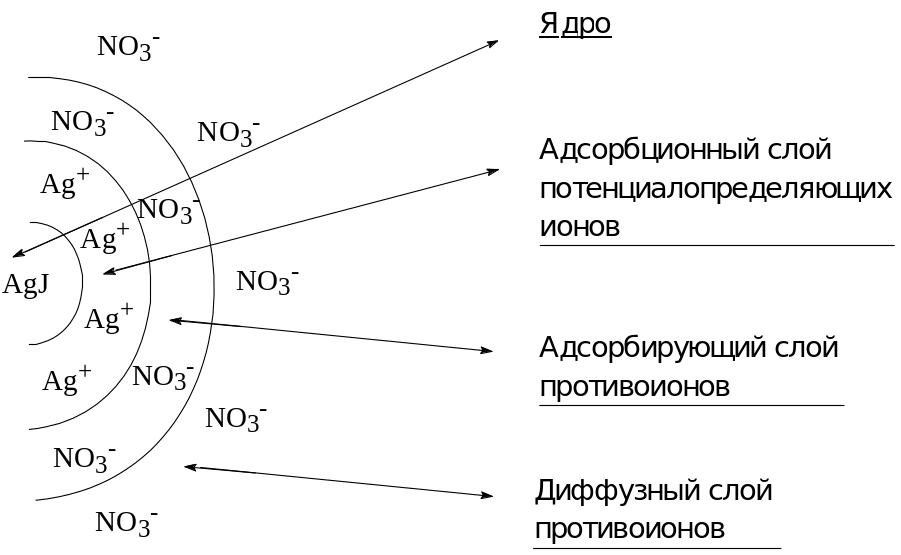
Отдельные частицы коллоидных систем называют мицеллами. Мицелла имеет следующее строение. В центре ее находится ядро - это кристаллик или комочек нерастворимого вещества. На поверхности ядра мицеллы располагается слой специфически адсорбированных ионов, которые называются потенциалоопределяющими ионами. К слою потенциалопределяющих ионов электростатическими силами (значительно более слабыми, чем валентные) притягиваются противоположно заряженные ионы, называемые противоионами. Строение мицеллы того или иного золя выражают схемой и формулой При этом ядро мицеллы записывают в виде формулы коллоидного вещества, взятой в квадратные скобки, буквой m обозначают число молекул нерастворимого вещества, образующих ядро мицеллы. Через n выражают и число потенциалопределяющих ионов и число противоионов. Через х обозначают число противоионов подвижного слоя, а через (n-х) - число противоионов неподвижного слоя. Гранулу (т.е. ядро с адсорбционным слоем) выделяют фигурными скобками, вверху правой скобки ставят знак заряда гранулы.
Устройство мицеллы рассмотрим на некоторых примерах.
Схема и формула мицеллы золя иодида серебра (+)
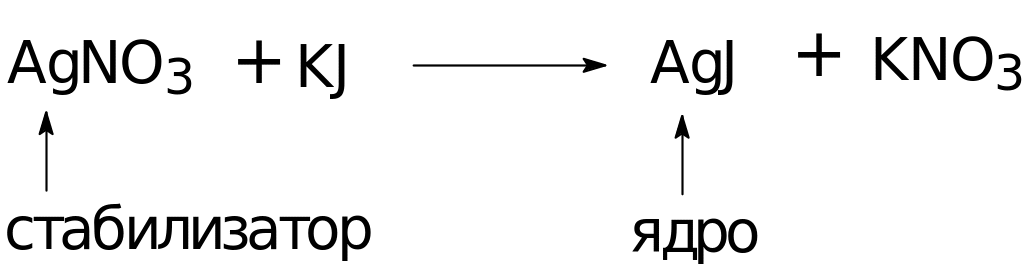
Схема
Формула мицеллы золя иодида серебра (+)
{[mAgJ] nAg+(n-х)NO3-}-х хNO3-
Формула мицеллы золя иодида серебра (-)
{[mAgJ] nJ-(n-х)К+}-х хК+
Наличие одноименного заряда у всех гранул данного коллоидного раствора (золя) является важным фактором его устойчивости. Заряд препятствует слипанию и укрупнению коллоидных частиц.
Коллоидные растворы обладают следующими свойствами:
1) по отношению к дисперсионной среде золи разделяют на лиофильные (устойчивые, характеризуются сильным взаимодействием с дисперсионной средой – пена, образующаяся при взаимодействии мыла с водой) и лиофобные (неустойчивые, взаимодействуют с дисперсионной средой только при добавлении стабилизатора – золь золота взаимодействует с водой только при добавлении желатина).
2) диффузия золей протекает медленно из-за их больших размеров.
3) эффект Тиндаля – явление светорассеивания при пропускании лучей света через коллоидный раствор.
4) при добавлении в золям электролитов происходит уменьшение зарядов гранул, что приводит к слипанию частиц и выпадение их в осадок, т.е. коагуляция.
5) при изменении условий хранения, например, температуры, золь может превратиться в гель – желеобразную массу. Вследствие ячеистой структуры гели проявляют некоторые свойства твердых тел.
Наименьшая концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции (ПК). Величина, обратная порогу коагуляции, называется коагулирующей силой электролита (КС).
КС=1/ПК (5.1)
Коагулирующая сила различных электролитов различна. Основной закономерностью коагуляции золей электролитами является правило знака и валентности – правило Шульце-Гарди, согласно которому:
А) коагуляцию вызывают не оба иона прибавляемого электролита, а главным образом один - тот, который имеет заряд, противоположный заряду гранулы;
Б) коагулирующее действие иона тем выше, чем выше его заряд.
