
- •Оглавление
- •Тема 1. Основные классы неорганических соединений 8
- •3.2. Решение задач 39
- •6.4 Индивидуальные задания 76
- •Введение
- •Тема 1. Основные классы неорганических соединений
- •1.1 Основные понятия и законы химии
- •1.2 Основные классы неорганических соединений
- •1.3 Решение типовых задач
- •В) определение количества молекул в образце.
- •1.4 Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Определить количество кальция в основном компоненте простого суперфосфата (Ca(н2ро4)2 ×2 CaS04).
- •Вариант 9
- •Определить количество азота в основном компоненте аммонийной селитры (нитрате аммония).
- •Вариант 10
- •Определить количество кальция в основном компоненте двойного суперфосфата (дигидрофосфате кальция).
- •Вариант 11
- •Определить количество оксида кальция в основном компоненте двойного суперфосфата (дигидрофосфате кальция).
- •Вариант 12
- •Определить содержание калия в основном компоненте поташа (карбонате калия).
- •Вариант 13
- •Определить содержание оксида калия в основном компоненте поташа (карбоната калия).
- •Вариант 14
- •Определить количество аммиака в основном компоненте аммофоса (дигидрофосфате аммония).
- •Вариант 15
- •Определить количество азота в основном компоненте аммофоса (дигидрофосфате аммония).
- •Вариант 16
- •Определить количество кальция в основном компоненте преципитата (СаНро4 ×2 н2о).
- •Вариант 17
- •Определить количество оксида кальция в основном компоненте преципитата (СаНро4 ×2 н2о).
- •Вариант 18
- •Определить количество оксида кальция в основном компоненте простого суперфосфата (Ca(н2ро4)2 ×2 CaS04).
- •Вариант 19
- •Вариант 20
- •Определить количество фосфора в основном компоненте аммофоса (дигидрофосфате аммония).
- •1.5 Лабораторная работа. Основные классы неорганических соединений.
- •1.6 Контрольные вопросы для самопроверки
- •Тема 2. Строение атома и периодический закон д.И. Менделеева
- •2.1. Квантовые представления о строении атома
- •2.2 Периодический закон д.И. Менделеева
- •2.3 Решение задач
- •2.4 Индивидуальные задания
- •2.5 Контрольные вопросы для самопроверки
- •Тема 3. Химическая связь и строение вещества
- •3.1. Закономерности изменения характеристик и свойств химической связи
- •3.2. Решение задач
- •3.2. Индивидуальные задания
- •3.3 Контрольные вопросы для самопроверки
- •Тема 4. Закономерности химических процессов
- •4.1 Термодинамика
- •4.2 Химическая кинетика и химическое равновесие
- •4.3 Решение задач
- •4.4. Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Лабораторная работа: Химическая кинетика.
- •Методика выполнения опыта:
- •4.6 Контрольные вопросы для самопроверки
- •Тема 5. Дисперсные системы
- •5.1. Понятие о дисперсных системах
- •5.2 Коллоидные системы
- •5.3 Поверхностные явления в дисперсных системах
- •5.4 Решение задач
- •5.5 Индивидуальные задания
- •5.6 Лабораторная работа: Получение и свойства коллоидных
- •5.7 Контрольные вопросы для самопроверки
- •Тема 6. Растворы
- •6.1 Способы выражения концентрации растворов
- •6.2 Свойства разбавленных растворов неэлектролитов
- •6.3 Решение задач
- •Tзам. - ? Расчет ведем по законам Рауля:
- •6.4 Индивидуальные задания вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •6.5 Лабораторная работа: Приготовление растворов
- •Методика выполнения работы:
- •6.6 Контрольные вопросы для самопроверки
- •Тема 7. Свойства разбавленных растворов электролитов
- •7.1 Электролитическая диссоциация
- •7.2 Реакции ионного обмена
- •7.3 Водородный показатель, рН. Среда растворов.
- •7.4 Гидролиз солей
- •7.5 Индивидуальные задания
- •7.6 Лабораторная работа: Теория электролитической диссоциации
- •7.7 Лабораторная работа: Гидролиз солей
- •7.8 Контрольные вопросы для самопроверки
- •Тема 8. Окислительно-восстановительные реакции
- •8.1 Правила нахождения степеней окисления
- •8.2. Решение задач
- •8.3. Индивидуальные задания
- •8.4 Лабораторная работа: Окислительно-восстановительные реакции
- •8.5 Контрольные вопросы для самопроверки
- •Тема 9. Электрохимические процессы
- •9.1 Гальванический элемент
- •9.2 Коррозия металлов
- •9.3 Решение задач
- •9.4 Индивидуальные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •9.5 Лабораторная работа: Гальванические элементы
- •9.6 Лабораторная работа: Коррозия металлов
- •9.7 Контрольные вопросы для самопроверки
- •Тема 10. Биогенные химические элементы
- •10.1 Важнейшие элементы агрономического значения
- •10.2 Индивидуальные задания Вариант 1
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вычислите массовые доли железа в соединениях: FeO, Fe2o3, Fe3o4. В каком из этих соединений массовая доля железа наибольшая?
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •10.3 Лабораторная работа: Свойства соединений биогенных элементов
- •10.4 Контрольные вопросы для самопроверки по теме «s-элементы»
- •10.5 Контрольные вопросы для самопроверки по теме «р-элементы»
- •10.6 Контрольные вопросы для самопроверки по теме «d-элементы»
- •Тест для самоконтроля Вариант 1
- •Вариант 2
- •Приложение 1 приложение 2 Номенклатура важнейших кислот и солей
- •Приложение 3
- •Приложение 4 Стандартные термодинамические потенциалы
- •Приложение 5 Ряд стандартных электродных потенциалов
- •Литература
Вариант 5
Рассчитать теплоту сгорания этилена в кДж/м3. Вода выделяется в газообразном состоянии.
Можно ли при стандартных условиях осуществить синтез аммиака:
N2(г) + 3Н2(г) ↔ 2NH3(г)?
При какой температуре наступит термодинамическое равновесие?
Пользуясь значениями Нобр. и Sобр., вычислить G реакции:
С(гр) + О2(г) ↔ СО2(г).
Пойдет ли реакция при стандартных условиях и при 1000С?
Как изменится скорость прямой реакции 2NO +С12 = 2NOCl(г) при увеличении концентрации оксида азота (II) в три раза?
В каком направлении сместится равновесие в системе
4НС1 + 02 = 2Cl2 + 2Н20(ж) + Q,
а) при повышении давления;
б) при понижении температуры;
в) при увеличении концентрации исходных веществ;
г) при уменьшении концентрации конечных продуктов реакции;
д) при введении катализатора?
Вариант 6
Рассчитать стандартную энтальпию образования оксида железа (III). Реакция протекает по уравнению: 8Al(кр) + 3Fe3O4(кр) = 4Al2O3(кр) + 9Fe(кр) + 3353,5 кДж.
Определить, при какой температуре Т установится термодинамическое равновесие реакции: Fe2О3(кр) + 3С(гр) ↔ 2Fe(кр) + 3СO(г).
Устойчива ли при стандартных условиях и при 100С смесь из H2S и О2? В реакции образуется Н2О(г) и SO2(г)
Как изменится скорость прямой реакции 2NO +С12 = 2NOCl(г) при увеличении концентраций оксида азота (II) и хлора в три раза?
В каком направлении сместится равновесие в системе
2Н20(г) = 2Н2 + 02 - Q
а) при повышении давления;
б) при понижении температуры;
в) при увеличении концентрации исходных веществ;
г) при уменьшении концентрации конечных продуктов реакции;
д) при введении катализатора?
Вариант 7
Обосновать устойчивость оксидов СО и СО2, вычислив тепловой эффект реакции превращения СО в СО2 при стандартных условиях.
При какой температуре наступит термодинамическое равновесие в системе: 2СН4(г) ↔ С2Н2(г) + 3Н2(г)?
При какой температуре устойчив на воздухе алюминий?
2Al(кр) + 3/2O2(г) ↔Al2O3(кр). Возможно ли окисление при 100С?
Как изменится скорость обратной реакции 2N2O5(г)
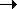 4NO2(г) +
O2(г)
при увеличении концентрации кислорода
в три раза?
4NO2(г) +
O2(г)
при увеличении концентрации кислорода
в три раза?В каком направлении сместится равновесие в системе
N2 + 02 = 2NO, ∆Н = 180 кДж;
а) при повышении давления;
б) при понижении температуры;
в) при увеличении концентрации исходных веществ;
г) при уменьшении концентрации конечных продуктов реакции;
д) при введении катализатора?
Вариант 8
Рассчитать теплоту сгорания бензола в кДж/кг. Примеси составляют 25%. Вода выделяется в газообразном состоянии. Реакция идет по схеме: С6Н6(г) + 15/2О2(г) = 6СО2(г) + 3Н2О(г).
При какой температуре установится термодинамическое равновесие в системе: SO2(г) + 2Н2S(г) ↔ 3S(к) + 2Н2О(ж)?
Какой оксид SO2 или SO3 более устойчив при стандартных условиях? Ответ подтвердите расчетом G0298 реакции.
Как изменится скорость прямой реакции 2NO +Сl2 = 2NOCl(г) при уменьшении давления в три раза?
В каком направлении сместится равновесие в системе
2Н20(Г) + С(|графит) = С02 +2Н2, ∆Н >0;
а) при повышении давления;
б) при понижении температуры;
в) при увеличении концентрации исходных веществ;
г) при уменьшении концентрации конечных продуктов реакции;
д) при введении катализатора?
