
- •Курс лекций по дисциплине
- •270800.62 – Строительство
- •26.08.2011 Г. Протокол №1
- •Выписка из плана учебного процесса
- •Тематический план дисциплины
- •Введение
- •Классы неорганических соединений
- •Строение атома
- •Периодический закон и периодическая система химических элементов менделеева д. И.
- •Структура периодической системы элементов
- •Изменение свойств элементов и их соединений в периодах и главных подгруппах
- •Определение степени окисления
- •Химическая связь и межмолекулярные взаимодействия
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Водородная связь
- •2 Реакционная способность веществ Классификация химических реакций
- •I. По числу и составу исходных веществ и продуктов реакции различают:
- •II. По изменению степени окисления атомов элементов, входящих в состав реагирующих веществ, реакции подразделяются на:
- •Определение и основные положения теории окислительно-восстановительных реакций
- •Вопросы взаимного влияния атомов в молекуле органического соединения были подробно изучены учеником а. М. Бутлерова в. В. Марковниковым.
- •Элементы химической термодинамики
- •Химическая кинетика. Химическое равновесие. Катализ
- •Растворы. Реакции в жидком состоянии вещества
- •Коллоидные и дисперсные системы
- •Электрохимические процессы
- •Элементы органической химии
- •Химическая идентификация и анализ веществ
- •Химические свойства материалов, применяемых в строительстве Общие сведения о производстве и свойствах цемента
- •Портландцементный клинкер
- •Список литературы
Водородная связь
Образование водородной связи обусловлено спецификой водорода как элемента, состоящего из протона и электрона. В соединениях водорода с резко электроотрицательными элементами (фтор, кислород, азот), атом водорода приобретает положительную степень окисления. Такой водород обладает уникальными свойствами, очень малым размером и отсутствием электронов. Поэтому он может проникать в электронное облако электроотрицательного атома соседней молекулы, в результате между атомами возникает дополнительная водородная связь.
Водородная – это связь которая образуется между атомом водорода одной молекулы и атомом сильно электроотрицательного элемента другой молекулы. Возникновение водородной связи приводит к ассоциации (соединению) молекул. Она характерна для веществ в жидком и твердом состояниях.
H–F– + +H–F = H–F _ _ _ H–F или H–F • • • H–F
водородная связь
Обозначают водородную связь тремя точками или тремя пунктирами.
Наличие водородных связей объясняет отклонение свойств некоторых соединений. Например, вследствие ассоциации фтороводородная кислота более слабая кислота по сравнению с другими галогеноводородными кислотами, температура кипения HF выше температуры кипения НС1. Способностью к ассоциации обладают вода, спирты, аммиак и другие соединения.
Энергия водородной связи составляет 8–40 кДж/моль, т.е. значительно меньше энергии ковалентной связи. Чем больше электроотрицательность элемента, с которым образует соединение водород, тем больше энергия водородной связи. Водородная связь, как и ковалентная, имеет направленность в пространстве и насыщаемость. Длина ее больше, чем у обычной ковалентной связи.
2 Реакционная способность веществ Классификация химических реакций
Химические реакции классифицируют различными способами:
I. По числу и составу исходных веществ и продуктов реакции различают:
1 – реакции соединения – это реакции, в результате которых из двух или нескольких простых или сложных веществ образуется одно новое вещество:
Fe
+ S
![]() FeS;
CaO
+ Н2О
Са(ОН)2
FeS;
CaO
+ Н2О
Са(ОН)2
2 – реакции разложения – это реакции, в которых из одного сложного вещества образуется два или несколько других веществ:
2 HgO 2 Hg + О2; Cu(OH)2 CuO + Н2О
3 – реакции замещения – это реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе:
Fe + CuSO4 Cu + FeSO4; 2 KI + C12 I2 + 2 KC1
4 – реакции обмена – это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями:
№2SO4 + BaCl2 BaSO4+ 2 NaCl; Na2SiO3 + 2 HCl Н2SiO3 + 2 NaCl
II. По изменению степени окисления атомов элементов, входящих в состав реагирующих веществ, реакции подразделяются на:
Не окислительно-восстановительные, протекающие без изменения степени окисления атомов:
![]()
Окислительно-восстановительные, протекающие с изменением степени окисления всех или некоторых атомов элементов, входящих в состав реагирующих веществ:
![]()
III. По направлению протекания процесса реакции делят на необратимые и обратимые.
IV. По тепловому эффекту различают экзо- и эндотермические реакции.
V. По агрегатному состоянию реагирующих веществ реакции делят на гомогенные и гетерогенные.
VI. По использованию катализаторов различают каталитические и некаталитические реакции (см. § 6).
Пример. На основании классификации химических реакций дайте характеристику следующей реакции:
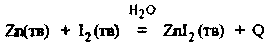
1. Это реакция соединения.
2. Каталитическая (Н2О – катализатор).
3. Окислительно-восстановительная.
4. Экзотермическая.
5. Необратимая.
6. Гетерогенная.
