
- •Общие методические указания
- •Программа Введение
- •Контрольное задание № 1
- •Периодическая система элементов д.И.Менделеева.
- •Задача 41
- •Задача 43
- •Задача 47
- •Твердые тела и минералы.
- •Растворы. Концентрация растворов.
- •Физико-химйческие свойства растворов
- •Энергетика химических процессов. Энтальпия
- •Энергия гиббса. Энтропия
- •Химическая кинетика и равновесие
- •Окислительно-восстановительные реакции
- •Электродные потенциалы и электродвижущие силы
- •Электролиз. Коррозия металлов
- •Комплексные соединения.
- •Реферат.
- •Список литературы к рефератам.
- •Варианты контрольных заданий
- •Приложение.
Контрольное задание № 1
Основные понятия и законы химии.
Все вещества состоят из химических элементов. Химический элемент - вид атомов, характеризующийся определенной совокупностью свойств, или вид атомов с одинаковым зарядом ядра.
Атом - наименьшая частица элемента, сохраняющая его свойства. Атомной массой называется масса атома, выраженная в а.е.м. (атомная единица массы). 1 а.е.м. = 1,6610-27 кг. Атомная масса элемента указана в периодической таблице.
Молекула - наименьшая частица простого или сложного вещества, сохраняющая его свойства.
Моль - это количество простого или сложного вещества, которое содержит столько структурных единиц (атомов, молекул, ионов, электронов), сколько их находится в 12 г изотопа углерода 12С, а именно 6,02 1023 (число Авогадро).
Молярная масса - это масса числа Авогадро структурных единиц вещества. Молярную массу выражают в г/моль, кг/моль.
Для проведения расчетов часто необходимо знать массу нескольких молей или, наоборот, найти, сколько молей заключено в данной массе вещества. Количество молей простого или сложного вещества n находят из отношения массы m этого вещества к его молярной массе М:
![]() .
.
Пример 1. Сколько молей заключено в 90 г воды?
Решение: МH2О = 18 г/моль, m = 90 г.
![]()
Для вывода простейшей формулы вещества достаточно знать его состав и атомные массы образующих данное вещество элементов.
Пример 2. Найти простейшую формулу соединения, содержащего 12 % углерода, 40 % кальция, 48 % кислорода.
Решение. Обозначим числа атомов углерода, кальция и кислорода в простейшей формуле соединений через x, y и z. Атомные массы этих элементов равны 12, 40 и 16. Поэтому массы углерода, кальция и кислорода относятся как 12x : 40у : 16 z. По условию задачи это отношение равно 12 : 40 : 48. Следовательно, 12x : 40y : 16 z = 12 : 40 : 48, откуда
X : Y : Z =12/12 : 40/40 : 48/16 = 1: 1 : 3.
Таким образом, простейшая формула соединения CaCO3.
Абсолютные массы атомов и молекул могут быть найдены через число Авогадро. Если в моле любого вещества содержится 6,02∙1023 молекул или атомов, то, зная массу моля (молярную массу), можно найти массу атома или молекулы. Пример 3. 1) Какова масса атома кремния; 2) молекулы гипса.
Решение.1) МSi = 28г/моль;
mSi
=![]() = 4.15∙10-23
г
= 4.15∙10-23
г
2) МCaSO4∙2H2O = 172 г/моль;
mCaSO4∙2H2O
=
![]() .
.
Закон Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Следствие из закона Авогадро: моль любого газа при нормальных условиях (температура 273К и давление 101,325 кПа) занимает объем 22,4 д. Этот объем называется молярным объемом (Vm).
Пример 4. Вычислить объем, занимаемый при н.у. 64 г кислорода. 2 моль = 44,8 л,
![]() ;
V=
Vm
∙n
= 22,4г/моль∙2 моль = 44,8г.
;
V=
Vm
∙n
= 22,4г/моль∙2 моль = 44,8г.
Решение
M
O![]() =32 г/моль.
=32 г/моль.
Если газ измерен в условиях, отличных от нормальных, то для расчета молярной массы можно воспользоваться уравнением Менделеева - Клапейрона:
PV=![]() RT,
RT,
где P-давление газа, Па; V - объем газа, м3. m - масса газообразного вещества, г; М - молярная масса газа, г/моль; Т - абсолютная температура, К; R - универсальная газовая достоянная, равная в системе СИ 8,314 Дж/моль∙K
Эквивалентом вещества (э) называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой (Эm) называется масса 1 эквивалента вещества.
Пример 5. Определить эквивалент и эквивалентные массы элементов в соединениях HJ, H2S, NН3.
Решение. В указанных соединениях с 1 молем атомов водорода соединяется 1 моль атомов йода, 1/2 моля атомов серы и 1/3 моля атомов азота.
Следовательно, согласно определению, эквиваленты йода, серы и азота соответственно равны: 1 молю, 1/2 и 1/3 моля. Исходя из мольных масс атомов этих элементов, находим, что эквивалентная масса йода равна 126,9 г/моль, серы - 32 . 1/2= 16 г/моль, азота - 14∙1/3 = 4,67 г/моль. Эквивалентный объем (Э\/) - это объем, занимаемый одним эквивалентом данного газообразного вещества при данных условиях.
Закон эквивалентов: массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объемам):
![]() (1)
(1)
Пример 6. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л, водорода (н.у.) Вычислить эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Решение. Согласно закону эквивалентов:
![]()
![]() .
(2)
.
(2)
Эквивалентный объем водорода Vmэ(H2) , молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4 : 2 =11,2 л. В формуле (1) - отношение mH2/mэ(H2). Заменяем равным ему отношением VH2/Vmэ(H2) , где VH -объем водорода: Vтэ(Н2) - эквивалентный объем водорода:
![]() . (3)
. (3)
Из
уравнения (2) находим эквивалентную
массу оксида металла m![]() :
:
![]() ;
;
![]() г/моль
г/моль
Согласно
закону эквивалентов m![]() = m
= m![]() + m
+ m![]() ,
отсюда
,
отсюда
m = m - m = 35,45 – 8 = 27,45 г/моль. Молярная масса металла определяется из соотношения mэ =А/В, где mэ - эквивалентная масса, А - мольная масса металла, В - стехиометрическая валентность элемента; А =mэ ∙ B =27,45∙2 = 54,9 г/моль. Так как атомная масса в а.е.м. численно равна молярной массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 7. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см3 кислорода (н.у.)?
Решение. Так как молярная масса О2 (32 г/моль) при н.у. занимает объем 22,4 м, то объем эквивалентной массы кислорода (8 г/ моль) будет 22,4 : 4 = 5,6 л = 5600 см3. По закону эквивалентов
 ,
или
,
или
![]()
откуда mme = 12,16∙310/5600= 0,673 г.
Пример
8.
Вычислите эквиваленты и эквивалентные
массы H
SO![]() и Al(OH)3
в реакциях, выраженных уравнениями:
и Al(OH)3
в реакциях, выраженных уравнениями:
H2SO4 + KOH = KHSO4 + H2O (1)
H2SO4 + Mg = MgSO4 + H2 (2)
Al(OH)3 + HCl = Al(OH)2Cl + H2O (3)
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O (4)
Решение.
Эквивалент (эквивалентная масса) сложного
вещества, как и эквивалент (эквивалентная
масса) элемента, может иметь различные
значения и зависит от того, в какую
реакцию обмена вступает это вещество.
Эквивалентная масса кислоты (основная)
равна молярной массе (M),
деленной на число атомов водорода,
замещенных в данной реакции на металл
(на число вступающих в реакцию
гидроксильных групп). Следовательно,
эквивалентная масса H2SО4
в
реакции (1) МH2SO4
= 98 г/моль, а в реакции (2) MH2SO4
/
2 = 49 г/моль. Эквивалентная масса Al(OH)3
в
реакции (3) МAl(OH)![]() =
78 г/моль, а в реакции (4) MAL(OH)
/
3 = 26 г/моль.
=
78 г/моль, а в реакции (4) MAL(OH)
/
3 = 26 г/моль.
Задачу можно решить и другим способом. Так как H2SO4 взаимодействует с одной эквивалентной массой КОН и двумя эквивалентными массами магния, то ее эквивалентная масса равна в реакции (1) M/1 г/ моль и в реакции (2) М/2 г/ моль. Al(OH)3 взаимодействует с одной эквивалентной массой НСl и тремя эквивалентными массами HNO3, поэтому его эквивалентная масса в реакции (3) равна м/1 г/моль, в реакции (4) М/3 г/моль. Эквиваленты Н2S04 в уравнениях (1) и (2) соответственно равны 1 моль и 1/2 моль; эквиваленты AL(ОН)3 в уравнениях (3) м (4) соответственно равны 1 моль и 1/3 моль.
Задача 1
Выразить в молях: а) 6,02·I021 молекул С02; б) 1,2·1024 атомов кислорода; в) 2,0·1023 молекул воды. Чему равна молярная масса указанных веществ?
Задача 2
Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РН3 , H2O, HB2.
Задача 3
Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла.
Ответ: 9 г/моль.
Задача 4
В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН?
Ответ: 100 г.
Задача 5
Химическим анализом установлено наличие в веществе: 40% меди, 20% серы и 40 % кислорода. Определить его простейшую формулу.
Задача 6
Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношений масс 1: 3: 4: 7 .
Задача 7
При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла?
Задача 8
Вывести формулу кристаллогидрата хлорида кальция, зная, что 7,3 г кристаллогидрата теряет при обезвоживании 3,6 г воды.
Ответ: CaCl2 ∙ 6H2O
Задача 9
Определить массу и число атомов железа в сульфате железа (III).
Задача 10
Определить массу натрия, которая потребуется для реакции с кислородом, содержащим 6 ,02∙1023 молекул.
Задача 11
В состав 1 моль оксида серы входит 6,02∙1023 атомов серы и 18,06∙1023 атомов кислорода. Определить формулу оксида, а также массу серы в 8 г железа.
Задача 12
Сколько необходимо малахита (СuОН)2СО3, чтобы при его полном разложении получилось: а) 0,25 моль Сu0 (оксида меди); б) 0,2 моль воды; в) 224 л С02 (диоксида углерода) (н. у.).
Ответ: 2220 г.
Задача 13
Вычислить массу 1 м3 воздуха при 17°С и давлении 83,2 кПа.
Ответ: 1 кг.
Задача 14
Вычислить эквиваленты и эквивалентные массы Al(OH)3 в реакциях, выраженных уравнениями: Al(OH)3+HCl=Al(OH)2Cl+H2O
Al(OH)3+3HNO3=Al(NO3)3+3H2O
Ответ: 78 г/моль,
26г/моль.
Задача 15
Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите - уравнение реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы.
Задача 16
При 17°С и давлении 104 кПа масса 624 мл газа равна 1,56 г. Вычислить молекулярную массу газа.
Ответ: 49,0 г/моль,
Задача 17
Вычислить мольную массу газа, если масса 600 мл его при нормальных условиях равна 1,714 г.
Ответ: 64,0 г/моль.
Задача 18
При окислении 4,08 г металла образовалось 14,06 г оксида. Определить эквивалентную массу металла.
Ответ: 3,27 г/моль,
Задача 19
При растворении 0,03 г металла в кислоте выделилось 28 мл водорода, измеренного при н.у. Определить эквивалентную массу металла и его атомную массу, если металл двухвалентен.
Ответ: 12 г/моль;
24 а.е.м.
Задача 20
В каком количестве сероуглерода содержится столько же молекул, сколько их в 3·10-3 м3 воды?
Ответ: 12,64 кг,
СТРОЕНИЕ АТОМА.
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение. Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, m).Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Состояние электрона в атоме, отвечающее определенным значениям квантовых чисел n, l и m, называется атомной электронной орбиталью. .
Энергия
электрона в атоме достаточно точно
определяется для так называемых
разрешенных (допустимых) состояний,
которым соответствует конкретный набор
значений трех квантовых чисел. Такое
разрешенное состояние называют орбиталью.
Обозначение орбитали производят при
помощи комбинации цифр и букв. Главное
квантовое число n
обозначается целым числом 1,2,3 и т.д. Оно
определяет энергию электрона на орбитали
и ее размер (среднее расстояние от ядра
до периферии орбитали). Орбитальное
квантовое число, обозначающееся
при
помощи букв s,
р, d,
f
и т.д., соответствующих значениям
l=0,1,2,3...,
определяет форму орбитали. Магнитное
квантовое число m
указывает ориентацию орбитали в
пространстве. Например, p
- орбитали ориентированы вдоль осей
координат x
, y
, z
-
Рx
, P![]() ,
Рz
. Значение трех квантовых чисел и их
зависимость (l
от
n
и m
от l)
определяют разрешенные уровни и подуровни
(оболочки и подоболочки). Согласно
принципу Паули, в атоме не может быть
двух электронов, характеризующихся
одинаковым набором квантовых чисел,
поэтому в АО могут находиться не более
двух электронов, отличающихся своими
спинами (ms=±
1/2).
,
Рz
. Значение трех квантовых чисел и их
зависимость (l
от
n
и m
от l)
определяют разрешенные уровни и подуровни
(оболочки и подоболочки). Согласно
принципу Паули, в атоме не может быть
двух электронов, характеризующихся
одинаковым набором квантовых чисел,
поэтому в АО могут находиться не более
двух электронов, отличающихся своими
спинами (ms=±
1/2).
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Атомные орбитали, которым отвечают значения l, равные 0,1,2 и 3, называются соответственно s-, p-, d- и f- орбиталями. В графических схемах электронного строения атомов каждая орбиталь обозначается символом . При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он имеет наименьшую энергию - меньшую сумму n+l (правило Клечковского).
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов № 16 (сера) и № 22 (титан) электронные формулы имеют вид:
S
1s![]() 2s
2p
2s
2p![]() 3s
3p
3s
3p![]()
Ti 1s 2s 2p 3s 3p 3d 4s
Графически схема заполнения электронами этих орбиталей имеет следующий вид:
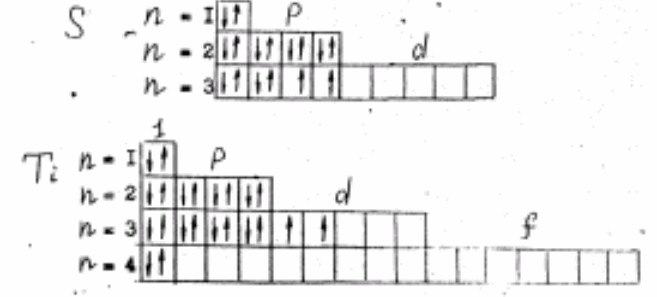
Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда).
Пример 3. Вычислите квант энергии желтого света (λ=589 нм), поглощающего или выделяемого физическим телом.
Решение. Квант энергии - мельчайшая порция энергии, выделяемая или поглощаемая при энергетических переходах внутри атома. Согласно теории Планка: Δ Е= h·ν , где h - постоянная Планка, равная 6 ,63·10-34 Дж·с; -частота излучения , вычисляется по формуле:ν=c \ = 5,09·1014 c-1, значит
ΔE=h··ν
= (6,63·10![]() Дж·с)(5.09·10
Дж·с)(5.09·10![]() с
с![]() )
= 3,37·10-19
Дж.
)
= 3,37·10-19
Дж.
Согласно теории Планка, атом или молекула, излучающие или поглощающие энергию с длиной волны 589 нм, могут терять или приобретать энергию только порциями, кратными величине 3,37 · 10-19 Дж. Например, могут получить энергию 6,74 · 10-19 Дж, но не 5,22 · 10-19 Дж.
Пример. 4. Какова характерная длина волны электрона, имеющего скорость 5,97·106 м/с (масса электрона 9,11·10-28 г)?
Решение. Длина волны электрона вычисляется по формуле
λ=![]() ,
,
где h- - постоянная Планка; m - масса частицы, кг; V - скорость движения электрона, м/с.
λ=![]()
Пример 5. Вычислите частоту линии в спектре атомарного водорода, которая соответствует переходу электрона из состояния с n = 4 в состояние с n = 2.
Решение:
Δ
Е =h
·
ν
= R![]() (
(
![]() ,
,
где RH - постоянная Ридберга, Дж.
Отсюда частота линии равна:
=

Отрицательный знак величины указывает на то, что атом испускает свет. Полученные значения ν можно использовать для вычисления длины волны излучения.
![]() .
.
Задача 21.
Квантовые числа для электронов внешнего энергетического уровня, атомов некоторого элемента имеют следующие значения: n = 4; l = 0; m = 0; ms = ±1/2. Напишите электронную формулу атома этого элемента и определите, сколько свободных 3 d –орбиталей содержит.
Задача 22
Структура валентного электронного слоя атома элемента выражается формулой: a) 5s2 5р4; б) 3d54s1 . Определите порядковый номер и название элемента.
Задача 23
Какое число электронов содержит атом, если следующий электрон должен сделать выбор между 5s- и 4d- АО? Какую из них и почему он предпочтет? Атом какого элемента при этом образуется?
Задача 24
В атоме элемента находится 5 электронных слоев и 7 внешних электронов. Какими квантовыми числами они характеризуются?
Задача 25
Сколько электронных слоев и какое число электронов содержит атом с внешним электронным слоем: а) 4s24p2; б)5s25p6 ?
Задача 26
Для скольких АО сумма n + l = 8? Есть ли такие орбитали у электронов периодической системы? Атомы каких элементов имеют наибольшее значение суммы n+l?
Задача 27
Каковы значения квантовых чисел n , l , m для орбиталей 4f подоболочки?
Задача 28
Желтый свет, испускаемый при внесении солей натрия в пламя горелки, имеет длину волны 589 нм. Какова частота этого излучения?
Ответ: 5,09 ·1014 с-1
Задача 29
Скорость движения электрона равна 2·108 м/с. Рассчитайте длину волны электрона.
Задача 30
Масса фотона равна массе электрона (9,108·10-3 кг). Какая длина волны соответствует этому фотону?
Задача 31
Чему равна энергия кванта света с длиной волны 5,7·10-7 м?
Ответ: 3,4410-9Дж
Задача 32.
Длина волны электрона 0,242·10-7 м. Вычислите скорость движения электрона.
Ответ: 3,0·104 м/ с.
Задача 33
Чему равна энергия перехода между 4-м и 3-м энергетическими уровнями в атоме водорода?
Задача 34.
Сколько и какие значения может принимать магнитное квантовое число m при орбитальном числе l= 0,1,2 и 3 ? Какие элементы в периодической системе называют s- , р- , d- и f-элементами? Приведите примеры.
Задача 35.
Один квант света (фотон) несет энергию, равную 3,06´10-19Дж. Какой длине волны, частоте колебании это соответствует?
Ответ: 649 нм; 4,62´1014с-1 .
Задача 36
Вычислите энергию фотона в пучке желтого цвета, для которого λ = 589 нм.
Ответ: 3,37·10-19 Дж.
Задача 37
Какой энергии (ΔЕ) соответствует линия в спектре неона, если ее λ = 185 нм?
Ответ: 1,07·10-18 Дж.
Задача 38.
Определите энергию кванта излучения атома ртути (эВ) при длине волны излучения 253,7 и 185,0 нм.
Ответ: 4,89 и 6,69 эВ.
Задача 39.
Разница двух энергетических состояний электрона (ΔЕ) равна 195,25 кДж/моль. Какой в этом случае должна быть частота поглощаемого или излучаемого света?
Ответ: 4,84 · 1014 с-1
Задача 40
Какую энергию несут кванты света с длиной волны 550 и 500 нм? Первые соответствуют желтой, а вторые - зеленой области видимой части спектра электромагнитного излучения.
Ответ: 3,611· 10-19 и
3,972 · 10-19 Дж
