
- •Общая и неорганическая химия учебно-методическое пособие
- •Введение
- •Основные теории и законы химии
- •Часть I общая химия
- •1. Основные закономерности протекания химических процессов
- •1.1. Энергетика, направление и глубина протекания химических реакций. Химическое равновесие.
- •1.2. Окислительно-восстановительные реакции
- •1.2.1. Типы окислительно-восстановительных реакций.
- •1.2.2. Направление самопроизвольного протекания окислительно-восстановительных реакций
- •1.3. Учение о растворах
- •1.3.1.Растворимость газов
- •1.3.2. Коллигативные свойства растворов
- •1.3.3. Теория электролитической диссоциации.
- •1.3.4. Теория растворов сильных электролитов.
- •1.3.5. Равновесие между раствором и осадком малорастворимого сильного электролита.
- •1.3.6. Ионизация воды. Ионное произведение воды. Водородный показатель. РН растворов сильных кислот и оснований.
- •1.3.7. Растворы слабых электролитов.
- •1.3.8. Теории кислот и оснований.
- •2. Строение вещества
- •2.1. Строение атома
- •2.1.1. Распределение электронов по орбиталям.
- •2.1.2 Периодический закон.
- •Основные характеристики атомов элементов.
- •Химическая связь.
- •Квантово-механическое описание химической связи.
- •2.2. Комплексные соединения
- •2.2.1. Международная (Женевская) номенклатура комплексных соединений
- •2.2.2. Классификация комплексных соединений.
- •2.2.3. Изомерия комплексных соединений.
- •2.2.4. Свойства комплексных соединений.
- •2.2.5. Образование комплексных соединений.
- •2.2.6. Разрушение комплексных соединений.
- •Часть II химия элементов
- •3.1. Водород
- •3.1.1 Вода как важнейшее соединение водорода.
- •4.1.1. Общая характеристика элементов iiiб группы.
- •4.1.2. Общая характеристика элементов ivб и vб групп.
- •Хром и его соединения.
- •Молибден и вольфрам.
- •4.2.3. Биологическая роль d-элементов VI группы и применение в медицине.
- •4.3.1. Марганец и его соединения.
- •4.4.1. Железо и его соединения.
- •4.4.2. Кобальт и никель.
- •4.4.3. Семейство платины (общая характеристика).
- •4.4.4. Биологическая роль d-элементов VIII группы и применение в медицине.
- •4.5.1. Медь и ее соединения.
- •4.5.2. Серебро и его соединения.
- •4.5.3. Золото и его соединения.
- •4.5.4. Биологическая роль d-элементов I группы и применение в медицине.
- •4.6.1. Цинк и его соединения.
- •4.6.2. Кадмий и его соединения.
- •4.6.4. Ртуть и ее соединения.
- •4.6.4. Биологическая роль d-элементов II группы и применение в медицине.
- •Бор и его соединения.
- •Алюминий и его соединения.
- •Биологическая роль р-элементов III группы и применение в медицине.
- •5.2.1. Углерод и его соединения.
- •5.2.2. Кремний.
- •5.2.3. Элементы подгруппы германия и их соединения.
- •5.2.4. Биологическая роль р-элементов IV группы и применение в медицине.
- •5.3.1. Азот и его соединения.
- •5.3.2. Фосфор и его соединения.
- •5.3.3. Химические свойства важнейших соединений мышьяка, сурьмы и висмута.
- •5.3.4. Биологическая роль р-элементов V группы и применение в медицине.
- •5.4.1. Кислород.
- •5.4.2. Сера и ее соединения.
- •5.4.3. Селен и теллур.
- •5.4.4. Биологическая роль р-элементов VI группы и применение в медицине.
- •5.5.1. Галогены и их соединения.
- •5.5.2. Биологическая роль р-элементов VII группы и применение в медицине.
- •Рекомендуемая литература Основная:
- •Дополнительная:
- •Содержание
5.2.4. Биологическая роль р-элементов IV группы и применение в медицине.
По содержанию в организме человека [21,15 %] углерод — это макроэлемент. С биологической точки зрения углерод является органогеном №1. Он входит в состав всех тканей и клеток в форме белков, жиров, углеводов, витаминов, гормонов.
В медицине применяются многие соединения углерода (см. другие разделы). Широкое применение находит активированный уголь, который имеет развитую пористую структуру и по этой причине является прекрасным адсорбентом (вещество, на поверхности которого может происходить поглощение различных веществ). Это свойство используется для очистки крови от вредных компонентов (кровь пропускается через слой угля), а также для поглощения вредных веществ из желудочно-кишечного тракта (таблетки активированного угля).
Минеральные воды, содержащие СО2 и гидрокарбонаты (нарзан, боржоми), рекомендуются при лечении гастритов, колитов, язвенной болезни и др.
К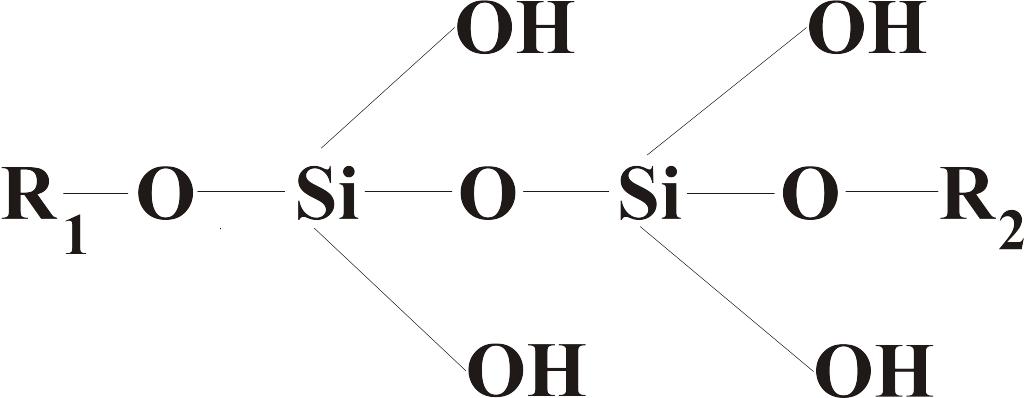 ремний,
по содержанию в организме человека
[10–3 %]
относится к примесным микроэлементам.
Больше всего кремния в печени,
надпочечниках, волосах. С нарушением
обмена кремния связывают возникновение
гипертонии, ревматизма, язвенной болезни,
малокровия.
ремний,
по содержанию в организме человека
[10–3 %]
относится к примесным микроэлементам.
Больше всего кремния в печени,
надпочечниках, волосах. С нарушением
обмена кремния связывают возникновение
гипертонии, ревматизма, язвенной болезни,
малокровия.
Недавно было установлено, что кремний содержится в коже, хрящах, связках млекопитающих и входит в состав мукополисахаридов, где прочно связан эфирными связями, возникающими при взаимодействии ортокремниевой кислоты с гидроксильными группами углеводов.
В отличие от углерода, в составе биомолекул кремний связан только с атомами кислорода [связь Si–O], так как энергия этой связи существенно выше энергии связей Si‑C, Si–H, Si–S и др.
Биологическая роль кремния состоит в том, что он способен обеспечивать образование поперечных связей в молекулах.
Однако, кремний может оказывать крайне негaтивное влияние на человека. Так, например, пыль, состоящая из частиц кремния диоксида SiO2, угля, алюминия при систематическом воздействии на лёгкие вызывает заболевания — пневмокониозы. Действие угольной пыли вызывает антракоз — профессиональное заболевание шахтёров. При вдыхании пыли, содержащей SiO2, возникает силикоз, при действии алюминиевой пыли — алюминоз.
Механизм воздействия пневмокониозов во многом неясен. Предполагается, что при длительном контакте силикатных песчинок с биологическими жидкостями образуется гелеобразная поликремниевая кислота, отложение которой в клетках ведёт к их гибели.
В медицинской практике применяют кремний (IV) карбид SiC — карборунд — для шлифовки пломб и пластмассовых протезов. Кремний диоксид SiO2 входит в состав силикатных цементов. Фарфоровые массы, применяемые в ортопедической стоматологии, состоят из кварца SiO2 [15–35 %] и алюмосиликатов: полевого шпата Э2О · Al2O3 · 6SiO2, где Э — К, Na или Са [60–75 %], и каолина Al2O3 · 2SiO2 · 2H2O [3–10 %]. Соотношение компонентов может меняться в зависимости от назначения фарфоровой массы.
Полевой шпат K2О · Al2O3 · 6SiO2 — основной материал для получения стоматологических фарфоровых масс. При плавлении он превращается в вязкую массу. Чем больше полевого шпата, тем прозрачнее фарфоровая масса после отжига. При отжиге фарфоровых масс полевой шпат, как более легкоплавкий, понижает температуру плавления смеси. Каолин [белая глина] — необходимая часть стоматологического фарфора. Добавка каолина уменьшает текучесть стоматологической массы. Кварц, входящий в состав стоматологического фарфора, упрочняет керамическое изделие, придаёт ему большую твёрдость и химическую стойкость.
Кварцевое стекло [почти чистый кремнезём] переносит резкие изменения температуры, почти не задерживает ультрафиолетовые лучи. Такое стекло используют для изготовления ртутно-дуговых ламп, которые широко применяют в физиотерапии и для стерилизации операционных.
По содержанию в организме человека [10–5–10–6 %] германий относится к микроэлементам. Биологическая роль окончательно не выяснена. Соединения германия усиливают процессы кроветворения в костном мозге. Известно также, что соединения германия малотоксичны.
По содержанию в организме человека [10–4 %] олово относится к микроэлементам. Сведения о биологической роли олова противоречивы. Олово попадает в организм человека с кислыми продуктами, консервированными в жестяных банках, покрытых слоем олова. В кислой среде олово растворяется и в форме соли поступает в кровь, оказывая токсическое действие:
Sn + 2HA SnA2 + H2
Однако в опытах на крысах установлено что олово в малых количествах стимулирующе действует на рост крыс. Это даёт основание предполагать его необходимость и для человека. Безусловно, выяснение биологической роли этого микроэлемента требует дополнительного изучения.
При ингаляции паров олова или пыли металлического олова в производственных условиях развивается пневмокониоз [станноз], острые отравления не наблюдаются.
В атмосферном воздухе временно допускается концентрация SnO, SnO2 и SnSO4 0,05 мг/м3. ПДК олова в пищевых продуктах: в рыбных, мясных продуктах и овощах — 200 мг/кг; в молочных продуктах, фруктах и соках — 100 мг/кг.
Неорганические соединения олова (II) не очень ядовиты в противоположность органическим соединениям олова.
В медицинской практике находят применение различные материалы, в частности пломбировочные, содержащие олово. Так, олово входит в состав серебряной амальгамы [28 %] для изготовления пломб.
Применение олова фторида как средства против кариеса зубов основано на превращении гидроксилапатита в Sn2PO4(OH).
Биологическая активность свинца определяется его способностью проникать в организм и накапливаться в нём. Свинец и его соединения относятся к ядам, действующим преимущественно на нервную, сосудистую систему и непосредственно на кровь.
Химизм токсического действия свинца весьма сложен. Ионы Pb2+ являются сильными комплексообразователи по сравнению с катионами остальных р-элементов IVA группы. Они образуют прочные комплексы с биолигандами.
Ионы Pb2+ способны взаимодействовать и блокировать сульфгидрильные SH‑группы белков, в частности, ферментов, участвующих в синтезе порфиринов, регулирующих синтез гема и других биомолекул:
2R–SH + Pb2+ RS—Pb—SR + 2H+
Часто ионы Pb2+ вытесняют естественные ионы М2+, ингибируя металлоферменты ЕМ2+:
ЕМ2+ + Pb2+ EPb2+ + M2+
Вступая в реакции с цитоплазмой микробных клеток и тканей, ионы свинца образуют гелеобразные альбуминаты. В небольших дозах соли свинца оказывают вяжущее действие, вызывая гелефикацию белков. Образование гелей затрудняет проникновение микробов внутрь клеток и снижает воспалительную реакцию. На этом основано действие свинцовых примочек.
По мере увеличения концентрации ионов Pb2+ образование альбуминатов приобретает необратимый характер, накапливаются альбуминаты белков R–COOH поверхностных тканей:
Pb2+ + 2R–COOH Pb(R–COO)2 + 2H+
Поэтому препараты свинца (II) оказывают преимущественно вяжущее действие на ткани. Их назначают исключительно для наружного применения, поскольку, всасываясь в желудочно-кишечном тракте или дыхательных путях, они проявляют высокую токсичность.
В медицинской практике нашли применение наружные вяжущие антисептические средства: свинец ацетат Pb(CH3COO)2 · 3H2O [примочки] и свинец (II) оксид PbO [входит в состав свинцового пластыря].
Свинец и его соединения, особенно органические, влияют на синтез белка, энергетический баланс клетки и её генетический аппарат. Свинец является слабым мутагеном. Pb4+ окисляет Fe2+ в Fe3+ и нарушает синтез гемоглобина. Многие факторы говорят в пользу денатурационного механизма. Установлено, что свинец — один из элементов, присутствие которых в продуктах питания влияет на развитие кариеса.
Массовая доля свинца в организме человека 10–6 %.
Безопасным для человека считают суточное поступление 0,2–2 мг свинца.
Токсическое действие свинца известно человечеству очень давно. Использование свинца для изготовление посуды и водопроводных труб приводило к массовому отравлению людей. В настоящее время свинец продолжает быть одним из основных загрязнителей окружающей среды, так как выброс соединений свинца в атмосферу составляет свыше 400 000 тонн ежегодно. Свинец накапливается в основном в скелете в форме малорастворимого фосфата Pb3(PO4)2, а при деминерализации костей оказывает регулярное токсическое действие на организм. Поэтому свинец относится к кумулятивным ядам.
Важной областью применения свинца является его использование в качестве защиты от рентгеновского и γ-излучения, а также от - и -частиц.
Вопросы для самоконтроля:
Какие степени окисления проявляют элементы IVA группы?
Кислотно-основные свойства оксидов и гидроксидов элементов IVA группы.
Окислительно-восстановительная характеристика соединений элементов IVА группы.
Чем можно объяснить аллотропные модификации углерода?
Почему при гидролизе карбидов различных металлов образуются различные углеводороды?
Чем объяснить несолеобразующий характер СО и его инертность в химических реакциях?
Каковы: механизм гипоксии при отравлении угарным газом и меры противоядия?
Какие смеси оксидов используются для защиты от угарного газа в противогазах?
Каков характер оксида С(IV)? Подтвердите уравнениями реакций.
Какие соли угольной кислоты и почему используются при ацидозе? Являются ли эти соли лучшими средствами или нет? Почему?
Почему кремний является микроэлементом, несмотря на большое содержание его в земной коре?
Какова биологическая роль кремния в организме?
Почему элементы Ge, Sn, Pb объединяют в подгруппу германия?
Как изменяются кислотно-основные свойства оксидов подгруппы германия?
Как изменяются окислительно-восстановительные свойства подгруппы германия?
Чем объясняется токсичность соединений свинца?
Какие свинецсодержащие препараты используются в медицине?
Каков механизм использования ЭДТА как противоядия соединений свинца?
5. 3. р-элементы V группы
В VA-группу периодической системы Д. И. Менделеева входят азот, фосфор, мышьяк, сурьма, висмут, способные образовывать три и максимально пять ковалентных связей. Исключение составляет атом азота, который не может образовывать больше четырех ковалентных связей (три за счет неспаренных р-электронов и одну по донорно-акцепторному механизму за счет неподеленной пары электронов на 2s-подуровне). В соединениях элементы этой группы проявляют степени окисления +1, +2, + 3, +4, +5, —3. Для азота наиболее характерны степени окисления +3, +5, —3, а также +2 и +4. С увеличением радиусов атомов от азота к висмуту закономерно уменьшается энергия ионизации и относительная электроотрицательность. Этим обсуловлено ослабление неметаллических свойств в ряду N — Р — As — Sb — Bi. Азот и фосфор — типичные неметаллы, мышьяк и сурьма амфотерны, висмут - металл. С ростом порядкового номера в образовании химических связей у элементов VA-группы начинают играть d- и f орбитали, поэтому значения устойчивых координационных чисел в ряду N—Р—As—Sb - Bi возрастают.
