
- •Общая и неорганическая химия учебно-методическое пособие
- •Введение
- •Основные теории и законы химии
- •Часть I общая химия
- •1. Основные закономерности протекания химических процессов
- •1.1. Энергетика, направление и глубина протекания химических реакций. Химическое равновесие.
- •1.2. Окислительно-восстановительные реакции
- •1.2.1. Типы окислительно-восстановительных реакций.
- •1.2.2. Направление самопроизвольного протекания окислительно-восстановительных реакций
- •1.3. Учение о растворах
- •1.3.1.Растворимость газов
- •1.3.2. Коллигативные свойства растворов
- •1.3.3. Теория электролитической диссоциации.
- •1.3.4. Теория растворов сильных электролитов.
- •1.3.5. Равновесие между раствором и осадком малорастворимого сильного электролита.
- •1.3.6. Ионизация воды. Ионное произведение воды. Водородный показатель. РН растворов сильных кислот и оснований.
- •1.3.7. Растворы слабых электролитов.
- •1.3.8. Теории кислот и оснований.
- •2. Строение вещества
- •2.1. Строение атома
- •2.1.1. Распределение электронов по орбиталям.
- •2.1.2 Периодический закон.
- •Основные характеристики атомов элементов.
- •Химическая связь.
- •Квантово-механическое описание химической связи.
- •2.2. Комплексные соединения
- •2.2.1. Международная (Женевская) номенклатура комплексных соединений
- •2.2.2. Классификация комплексных соединений.
- •2.2.3. Изомерия комплексных соединений.
- •2.2.4. Свойства комплексных соединений.
- •2.2.5. Образование комплексных соединений.
- •2.2.6. Разрушение комплексных соединений.
- •Часть II химия элементов
- •3.1. Водород
- •3.1.1 Вода как важнейшее соединение водорода.
- •4.1.1. Общая характеристика элементов iiiб группы.
- •4.1.2. Общая характеристика элементов ivб и vб групп.
- •Хром и его соединения.
- •Молибден и вольфрам.
- •4.2.3. Биологическая роль d-элементов VI группы и применение в медицине.
- •4.3.1. Марганец и его соединения.
- •4.4.1. Железо и его соединения.
- •4.4.2. Кобальт и никель.
- •4.4.3. Семейство платины (общая характеристика).
- •4.4.4. Биологическая роль d-элементов VIII группы и применение в медицине.
- •4.5.1. Медь и ее соединения.
- •4.5.2. Серебро и его соединения.
- •4.5.3. Золото и его соединения.
- •4.5.4. Биологическая роль d-элементов I группы и применение в медицине.
- •4.6.1. Цинк и его соединения.
- •4.6.2. Кадмий и его соединения.
- •4.6.4. Ртуть и ее соединения.
- •4.6.4. Биологическая роль d-элементов II группы и применение в медицине.
- •Бор и его соединения.
- •Алюминий и его соединения.
- •Биологическая роль р-элементов III группы и применение в медицине.
- •5.2.1. Углерод и его соединения.
- •5.2.2. Кремний.
- •5.2.3. Элементы подгруппы германия и их соединения.
- •5.2.4. Биологическая роль р-элементов IV группы и применение в медицине.
- •5.3.1. Азот и его соединения.
- •5.3.2. Фосфор и его соединения.
- •5.3.3. Химические свойства важнейших соединений мышьяка, сурьмы и висмута.
- •5.3.4. Биологическая роль р-элементов V группы и применение в медицине.
- •5.4.1. Кислород.
- •5.4.2. Сера и ее соединения.
- •5.4.3. Селен и теллур.
- •5.4.4. Биологическая роль р-элементов VI группы и применение в медицине.
- •5.5.1. Галогены и их соединения.
- •5.5.2. Биологическая роль р-элементов VII группы и применение в медицине.
- •Рекомендуемая литература Основная:
- •Дополнительная:
- •Содержание
Бор и его соединения.
Бор — бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора. В природе в свободном виде не встречается.
По твёрдости бор занимает второе [после алмаза] место среди всех природных веществ. Химически бор довольно инертен [особенно кристаллический]. Кислоты, не являющиеся окислителями, с бором не реагируют; концентрированная HNO3 и царская водка окисляют его до борной кислоты Н3ВО3.
При сплавлении со щелочами на воздухе либо при взаимодействии с расплавленным Na2O2 или смесью KNO3 и Na2CO3 бор образует бораты.
С F2, Cl2, Br2, I2 бор образует тригалогениды BHal3 — бесцветные, дымящие на воздухе летучие соединения, которые легко гидролизуются водой, склонны к образованию комплексных соединений типа H[BHal4].
Бор взаимодействует элементами IV, V и VI групп, главных подгрупп с образованием соответствующих соединений; при взаимодействии с кремнием выше 1000С — образуются силициды B6Si, B3Si и B12Si — не разлагаемые водой огнеупоры для защиты ядерных реакторов.
С большинством металлов при высоких температурах бор образует бориды. Один металл может образовывать несколько боридов разного состава: М3В, М2В, М3В2, МВ, М3В4, МВ4, МВ6, МВ12 и др. Бориды устойчивы к действию воды [кроме низших боридов Ве и Mg], соляной, фтористоводородной и карбоновых кислот, но легко разлагаются HNO3 и H2SO4 при нагревании. При окислении на воздухе образуют оксиды металла и бора.
С Н2 бор непосредственно не взаимодействует, бороводороды [бораны] получают косвенным путём. Бораны [бороводороды, гидриды бора] — соединения общей формулы BnHm, где n находится в пределах от 2 до 20, а m обычно равно n+4 или n+6.
Для молекул боранов характерен дефицит электронов, высокие координационные числа атома В [до 7], наличие мостиковых [трёхцентровых] связей В—Н—В, существование кластерных группировок из соединённых друг с другом атомов В. Атомы бора в молекулах объединены в полиэдрические группировки — фрагменты икосаэдра [В12] или октаэдра [В6].
Напрмер: в молекуле В4Н10 шесть двухцентровых связей В—Н, четыре трёхцентровые В—Н—В, образующимися в результате перекрывания sp3-гибридных орбиталей двух атомов В и s-орбитали атома Н и одна двухцентровая В—В. Молекулы В5Н9 и В10Н14, помимо связей описанных типов, содержат трёхцентровые связи В—В—В.
Бораны бесцветны, обладают резким неприятным запахом и высоко токсичны (вызывают головную боль и рвоту). С водой образуют Н3ВО3 и Н2, со спиртами — алкилбораты и Н2.
В2Н6 + 6Н2О → 2Н3ВО3 + 6Н2
Бораны весьма склонны к образованию соединений, содержащих анионы [BH4]–, [B3H8]– и др. Бораны с гидридами металлов дают комплексные гидриды [борогидриды, гидридобораты], например: В2Н6 + 2LiH 2Li[BH4]
Характерная реакция боранов — расщепление связи В—Н—В:
2В4Н10 + 2R2O 2В3Н7·OR2 + В2Н6
На воздухе бор сгорает при 700С, образуя борный ангидрид В2О3 — аморфную, бесцветную стекловидную гигроскопичную массу горького вкуса.
Бора оксид В2О3 имеет кислотный характер и растворяется в воде с образованием ортоборной кислоты:
В2О3 + 3Н2О 2Н3ВО3 – 10 кДж
Ортоборная кислота Н3ВО3 — белое кристаллическое вещество, относится к очень слабым кислотам [KаI = 7,3·10–10 ммоль/л].
В отличие от других кислот, её протолитические свойства связаны не с отщеплением протонов, а с присоединением ионов ОН–:
Н3ВО3 + Н2О [B(OH)4]– + Н+
Ортоборная кислота при нагревании легко теряет воду и превращается в метаборную кислоту HBO2, затем в тетраборную кислоту Н2В4О7 и, наконец, в оксид В2О3.
При нейтрализации Н3ВО3 щелочью образуются комплексные анионы, например:
Н3ВО3 + ОН– [B(OH)4]–
При избытке щелочи получаются полибораты, выделяющиеся из растворов в виде кристаллогидратов, например:
4Н3ВО3 + 2NaOH + 3Н2О Na2B4O7 ∙ 10H2O
Ортобораты даже щелочных металлов не образуются, так как кислота Н3ВО3 очень слабая и её соли подвергаются гидролизу.
В водном растворе с многоатомными спиртами и полифенолами борная кислота реагирует по схеме [биологически важная реакция]:
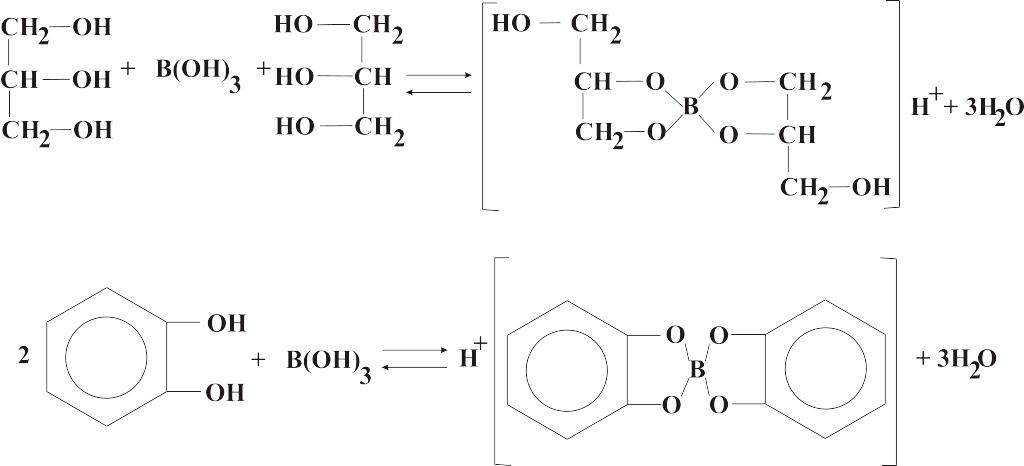
Борная кислота — слабая кислота: Kа1 = 7,3 ∙ 10–10; Kа2 = 4 ∙ 10–13; Kа3 = 4 ∙ 10–14.
В водных растворах предполагается существование полиборных кислот общей формулы H3m–2nBmO3m–n.
Бораты неорганические [оксобораты] — соли борных кислот: метаборной НВО2, ортоборной Н3ВО3 и не выделенных в свободном состоянии полиборных кислот.
Структуры боратов включают борокислородные группировки — «блоки», содержащие от 1 до 6, а иногда и 9 атомов бора. Координационное число атомов бора 3 [борокислородные треугольные группировки] или 4 [тетраэдрические группировки].
Со спиртами [метиловым, этиловым и др.] в присутствии концентрированной H2SO4 борная кислота образует эфиры.
Основным методом определения бора является отгонка борнометилового эфира В(OCH3)3 из кислых растворов. Бор можно также отогнать в виде фторида. Качественно бор открывают по буро-красному окрашиванию куркумовой бумаги, а также по зелёному окрашиванию пламени при сгорании В(OCH3)3.
Гравиметрически бор определяют по реакции борнометилового эфира с гашёной известью. Титриметрически — в виде маннито-борной кислоты [борная кислота не может быть оттитрована обычным методом из-за низкой константы диссоциации, поэтому её титруют в присутствии многоатомных спиртов — глицерина или маннита, образующих комплекс с Н3ВО3, усиливающий кислотные свойства].
