
- •Общая и неорганическая химия учебно-методическое пособие
- •Введение
- •Основные теории и законы химии
- •Часть I общая химия
- •1. Основные закономерности протекания химических процессов
- •1.1. Энергетика, направление и глубина протекания химических реакций. Химическое равновесие.
- •1.2. Окислительно-восстановительные реакции
- •1.2.1. Типы окислительно-восстановительных реакций.
- •1.2.2. Направление самопроизвольного протекания окислительно-восстановительных реакций
- •1.3. Учение о растворах
- •1.3.1.Растворимость газов
- •1.3.2. Коллигативные свойства растворов
- •1.3.3. Теория электролитической диссоциации.
- •1.3.4. Теория растворов сильных электролитов.
- •1.3.5. Равновесие между раствором и осадком малорастворимого сильного электролита.
- •1.3.6. Ионизация воды. Ионное произведение воды. Водородный показатель. РН растворов сильных кислот и оснований.
- •1.3.7. Растворы слабых электролитов.
- •1.3.8. Теории кислот и оснований.
- •2. Строение вещества
- •2.1. Строение атома
- •2.1.1. Распределение электронов по орбиталям.
- •2.1.2 Периодический закон.
- •Основные характеристики атомов элементов.
- •Химическая связь.
- •Квантово-механическое описание химической связи.
- •2.2. Комплексные соединения
- •2.2.1. Международная (Женевская) номенклатура комплексных соединений
- •2.2.2. Классификация комплексных соединений.
- •2.2.3. Изомерия комплексных соединений.
- •2.2.4. Свойства комплексных соединений.
- •2.2.5. Образование комплексных соединений.
- •2.2.6. Разрушение комплексных соединений.
- •Часть II химия элементов
- •3.1. Водород
- •3.1.1 Вода как важнейшее соединение водорода.
- •4.1.1. Общая характеристика элементов iiiб группы.
- •4.1.2. Общая характеристика элементов ivб и vб групп.
- •Хром и его соединения.
- •Молибден и вольфрам.
- •4.2.3. Биологическая роль d-элементов VI группы и применение в медицине.
- •4.3.1. Марганец и его соединения.
- •4.4.1. Железо и его соединения.
- •4.4.2. Кобальт и никель.
- •4.4.3. Семейство платины (общая характеристика).
- •4.4.4. Биологическая роль d-элементов VIII группы и применение в медицине.
- •4.5.1. Медь и ее соединения.
- •4.5.2. Серебро и его соединения.
- •4.5.3. Золото и его соединения.
- •4.5.4. Биологическая роль d-элементов I группы и применение в медицине.
- •4.6.1. Цинк и его соединения.
- •4.6.2. Кадмий и его соединения.
- •4.6.4. Ртуть и ее соединения.
- •4.6.4. Биологическая роль d-элементов II группы и применение в медицине.
- •Бор и его соединения.
- •Алюминий и его соединения.
- •Биологическая роль р-элементов III группы и применение в медицине.
- •5.2.1. Углерод и его соединения.
- •5.2.2. Кремний.
- •5.2.3. Элементы подгруппы германия и их соединения.
- •5.2.4. Биологическая роль р-элементов IV группы и применение в медицине.
- •5.3.1. Азот и его соединения.
- •5.3.2. Фосфор и его соединения.
- •5.3.3. Химические свойства важнейших соединений мышьяка, сурьмы и висмута.
- •5.3.4. Биологическая роль р-элементов V группы и применение в медицине.
- •5.4.1. Кислород.
- •5.4.2. Сера и ее соединения.
- •5.4.3. Селен и теллур.
- •5.4.4. Биологическая роль р-элементов VI группы и применение в медицине.
- •5.5.1. Галогены и их соединения.
- •5.5.2. Биологическая роль р-элементов VII группы и применение в медицине.
- •Рекомендуемая литература Основная:
- •Дополнительная:
- •Содержание
4.4.2. Кобальт и никель.
Кобальт и никель менее реакционноспособны, чем Fe. При обычной температуре они устойчивы к коррозии на воздухе, в воде и в различных растворах. При нагревании реагируют с О2, Н2О(пар), галогенами, S, P, Sr, C, B. Причем кобальт в полученных соединениях проявляет степени окисления и +2, и +3, а никель практически только +2. У Cо (III) тысячи комплексных соединений (аквакомплексы, аммиакаты, ацидокомплексы и др.). Ni также легко образует комплексы, но степень его окисления в них +2.
Разбавленная соляная и серная кислоты легко растворяют кобальт, а никель лишь при нагревании. HNO3(к) пассивирует оба металла.
Оксиды Со (II), Cо (III) и Ni(II) получаются при взаимодействии металлов с кислородом. Гидроксиды Со (II) и Ni (II) получаются действием щелочей на соответствующие соли:
CoSO4+2NaOH→Co(OH)2↓+Na2SO4,
NiCl2+2NaOH→Ni(OH)2↓+2NaCl.
На воздухе в присутствии влаги гидроксид Со (II) (как и соли Со (II)) медленно, под действием сильных окислителей быстро окисляется до гидроксида Со (III):
Co(OH)2+2H2O+O2 = Co(OH)3
2Co(OH)2+NaClO+H2O = 2Co(OH)2↓+NaCl.
Соли Co(II) и Ni(II) выпадают из растворов при выпаривании кристаллогидратов:
CoSO4·7H2O, CoCl2·6H2O (красного цвета), Ni(NO3)2·6H2O, NiSO4·7H2O (зеленого цвета разных оттенков).
Восстановительные свойства у Со2+ выражены незначительно, у Ni2+ - практически отсутствуют, а Со3+ обладает довольно сильными окислительными свойствами. Он окисляет даже воду:
2Co2(SO4)3+2H2O = 4CoSO4+2H2SO4+O2↑.
Оксиды и гидроксиды Со и Ni проявляют слабо выраженные амфотерные свойства с преобладанием основных, особенно в случае двухвалентного состояния, когда взаимодействие идет только с концентрированными растворами щелочей и при нагревании:
Co(OH)2+2NaOH(к) = Na2[Co(OH)4].
Гидроксид кобальта (III) теряет воду и переходит в более устойчивую форму:
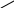 ОН
ОН
С
 о
ОН →Н2О+СоО(ОН),
который проявляет сильные
о
ОН →Н2О+СоО(ОН),
который проявляет сильные
ОН
окислительные свойства:
4СоООН+4H2SO4 = 4CoSO4+O2↑+H2O
и взаимодействует с растворами щелочей: CoOOH+3NaOH+H2O = Na[Co(OH)6].
4.4.3. Семейство платины (общая характеристика).
Элементы подгруппы платины (Ru, Rh, Pd, Os, Jr, Pt) по строению электронной оболочки и по аналогии физико-химических свойств делятся на три подгруппы:
1. Ru – Os; 2. Rh – Ir; 3. Pd – Pt.
По плотности их можно разделить на легкие (Ru, Rh, Pd) и тяжелые (Os, Ir, Pt) платиновые металлы.
Ru и Os наиболее устойчивы к действию кислот, слитки не растворяются даже в царской водке. H2[RuCl6] образуется при растворении в ней сплава Ru с Pt. Os легко реагирует с О2 с образованием OsO4.
Порошок Os реагирует с концентрированной HNO3 и H2SO4, расплавленным K2S2O7 . Рутений реагирует с фтором c образованием RuF6, а Os –OsF7, С хлором – RuCl3, OsCl3 и OsCl4 (смесь), с бромом – OsBr4.
Для платиноидов в целом характерны комплексные соединения, гидриды, кластеры. Они проявляют высокие степени окисления вплоть до +8 (OsO4). Устойчивость высоких степеней окисления сверху вниз возрастает. При движении слева направо по периоду по мере увеличения числа валентных электронов и их спаривания происходит стабилизация d-подуровня, понижение устойчивости высоких степеней окисления. Они наиболее устойчивы у Fe(+6), Ru(+8), Os(+8). Элементы семейства платины являются хорошими комплексообразователями. Они образуют катионы, анионы и нейтральные комплексы с координационным числом 4 или 6: [Pt(NH3)4]Cl2, Na2[Pt(OH)6], [Pt(NH3)4Cl4].
Все платиновые металлы в ряду активности стоят после водорода.
Из платиноидов лишь Os при нагревании взаимодействует с O2 и только Pd вступает в реакцию с концентрированной HNO3.
Их оксиды и гидроксиды проявляют амфотерность, выраженную в разной степени.
В обычных условиях платиновые металлы химически малоактивны, что объясняется большой энергией связи в кристаллической решетке. Только платина растворяется без нагревания в смеси HCl и HNO3, или в HCl в присутствии кислорода:
3Pt+18HCl+4HNO3 = 3H2[PtCl6]+4NO+8H2O
Pt+6HCl+O2 = H2[PtCl6]+2H2O.
П
t
Pt+2NaCl+2Cl2→Na2[PtCl6].
