
- •11 Клас
- •1) Cfve-z я садіага-а -вссооо—я
- •Короткий нарис розвитку біології
- •Методи біології
- •IVhtichihii.I.C проміння і іімма-проміння
- •Тема 1. Єдність хімічного складу організмів §1. Хімічний склад живих організмів
- •Живі організми і нежива природа утворені одними й тими самими хімічними елементами. Це говорить про єдність живої і неживої природи.
- •Хімічні сполуки клітини
- •§2. Неорганічні сполуки: вода і мінеральні солі
- •Внутрішньоклітинна вода
- •§3. Органічні сполуки живих організмів. Вуглеводи
- •Органі чиї сполуки
- •Будова молекул вуглеводів
- •Функції вуглеводів
- •Значення жироподібних речовин
- •§5. Будова, склад, властивості білків
- •Будова мономерів молекул білків
- •§6. Функції білків. Ферменти
- •§7. Будова, властивості і значення нуклеїнових кислот
- •Будова нуклеїнових кислот
- •Аг*, її будова і функції
- •Тема 2. Структурна складність і впорядкованість організмів
- •§8. Клітина - основна структурно-функціональна одиниця живої природи. Історія вивчення клітини. Методи цитологічних досліджень
- •Методи цитологічних досліджень
- •Клітинна теорія на сучасному етапі:
- •Основні положення клітинної теорії
- •Загальна характеристика клітин
- •§9. Будова клітин прокаріот і еукаріот Основні терміни і поняття: прокаріоти, еукаріоти.
- •§10. Клітинні мембрани. Хімічний склад, молекулярна організація. Роль мембран у поділі клітини на функціональні відсіки (компартменти). Поверхневий апарат клітини, його функції
- •Функції плазматичної мембрани
- •Піноцитоз
- •Будова і функції клітинної оболонки
- •§11. Основні компоненти цитоплазми. Гіалоплазма. Основні процеси, що відбуваються в гіалоплазмі. Цитоскелет
- •§12. Одномембранні органоїди клітини
- •§13. Двомембранні органоїди: мітохоидрії і пластиди. Подібність будови і функцій
- •Фотосинтез
- •§14. Органоїди, які не мають мембранної будови. Клітинний центр. Рибосоми. Органоїди руху
- •§15. Фотосинтез
- •§16. Дихання. Синтез атф у мітохондріях як наслідок дихання
- •§17. Біосинтез білка
- •Поняття про ген
- •Генетичний код
- •§18. Ядро. Його компоненти. Біологічна роль ядра Основні терміни і поняті я: ядро, ядерний матрикс. Каріоплазма. Хроматин, ядерце. І Ядро - невід'ємний органоїд еукаріотичних клітин.
- •§19. Життєвий цикл клітини. Мітоз
- •Фази мітозу
- •§20. Будова хромосом. Каріотип
- •Будова хромосом
- •§21. Обмін речовин і енергії в клітині. Клітина - відкрита система. Клітина - цілісна система
- •§22. Одноклітинні організми. Явище колоніальності. Взаємодія клітин у багатоклітинних організмів
- •Колоніальні організми
- •Багатоклітинні організми
- •5. Заповніть таблицю. Зробіть висновок. (10 балів) Риси схожості вольвоксу з одно- і багатоклітинними організмами
- •§23. Неклітинні форми життя - віруси. Будова і властивості вірусів
- •Життєвий цикл вірусу
- •Будова вірусних частинок
- •§24. Роль вірусів у природі та житті людини
- •§25. Будова тканин рослинного організму
- •Види рослинних тканин
- •§26. Тканини тваринного організму
- •Епітеліальна тканина
- •M' язова тканина
- •Нервова тканина
- •§27. Багатоклітинний організм - інтегрована система.
- •Рослина - цілісний організм
- •§28. Організація багатоклітинних тварин і регуляція їхніх функцій
- •Травна система
- •Види травлення
- •Гили травної системи
- •Кровоносна система
- •Тили кровоносної системи
- •Органи дихання тварин
- •Органи виділення тварин
- •Статева (репродуктивна) система
- •Статева система тварин
- •Рослини Тварини
- •Тема 3. Спадковість і мінливість організмів
- •§1. Генетика як наука. Методи генетичних досліджень. Основні поняття генетики
- •Генетика як наука
- •§2. Однаковість гібридів першого покоління. Закон розщеплення. Статистичний характер закону розщеплення. Гіпотеза чистоти гамет
- •Гіпотеза чистоти гамет
- •2/3 (Аа) - гетерозиготи.
- •2/3 (Аа) - гетерозиготи.
- •§3. Дигібридне схрещування та його цитологічні основи Основні терміни і поняття: дигібридне і по.Пігібридне схрещування, розщеплення. Третій закон г. Менделя. Закон незалежного розподілу генів
- •Решітка Пеннета
- •§4. Відхилення від типових кількісних співвідношень, встановлених г. Менделем
- •§5. Явище зчепленого успадкування. Генетичні карти хромосом. Хромосомна теорія спадковості т.Х. Моргана
- •Явище зчепленого успадкування
- •Закономірності при кросинговері
- •Генетичні карти хромосом
- •Основні положення хромосомної теорії
- •§6. Генетика статі. Успадкування, зчеплене зі статтю
- •§7. Взаємодія генів. Відношення ген - ознака. Множинна дія генів. Позаядерна спадковість
- •Види генів
- •1 Ознака (г. Мендель);
- •§8. Роль генотипу та умов довкілля у формуванні фенотипу. Модифікаційна мінливість та її властивості. Норма реакції. Статистичні закономірності модифікаційної мінливості
- •Мінливість
- •Модифікаційна мінливість
- •Властивості модифікацій
- •Значення модифікацій
- •Норма реакції
- •§9. Мутаційна мінливість. Основні положення мутаційної теорії. Закон гомологічних рядів спадкової мінливості
- •Теорія мутацій X. Гуго Де Фріза
- •§10. Генетика популяцій 1 *аїЛ
- •Генофонд популяцій
- •Формула Харді-Ваинберга
- •§11. Генетичні основи селекції тварин, рослин та мікроорганізмів. Форми штучного добору
- •Завдання селекції
- •Основні методи селекції
- •Форми штучного добору
- •§12. Схеми схрещування організмів та їхні генетичні наслідки
- •§13. Особливості селекції рослин, тварин та мікроорганізмів
- •Методи селекції рослин:
- •Особливості селекції тварин:
- •Особливості селекції мікроорганізмів
- •§14. Біотехнологія та її основні напрямки.
- •Тема 4. Розмноження та індивідуальний розвиток організмів
- •§15. Нестатеве і статеве розмноження організмів.
- •Форми розмноження організмів
- •Статеве
- •Біологічне значення нестатевого і вегетативного розмноження:
- •§16. Статеве розмноження одно- та багатоклітинних організмів. Особливості будови статевих клітин
- •Сперматозоїд ссавця
- •§17. Мейоз та утворення статевих клітин. Гаметогенез. Біологічне значення статевого розмноження
- •Порівняння мітозу і мейозу
- •§18. Запліднення, генетичні наслідки та біологічне значення. Штучне запліднення. Утворення зиготи
- •Запліднення
- •Особливості запліднення рослин
- •§19. Онтогенез, його періоди у рослин та тварин. Біогенетичний закон
- •Онтогенез
- •Постембріональний розвиток у тварин
- •Етапи онтогенезу у рослин
- •§20. Органогенез. Вплив зовнішніх умов на формування V і розвиток зародка
- •3. Шкідливий вплив алкоголю і нікотину на розвиток зародка людини.
- •Постембріональний розвиток
- •Непрямий розвиток, або метаморфоз
- •Біологічні функції непрямого розвитку
- •Ріст організмів
- •Регенерація у_тварин
- •§22. Життєвий цикл у рослин і тварин
- •Тема 4. Надорганізмові системи
- •§23. Вид та його основні критерії. Поняття про екологічну нішу. Структура виду
- •Популяційна структура виду
- •§24. Популяція. Структура популяції.
- •Сезонні Несезонні
- •Приріст
- •§25. Понятия про середовище існування.
- •Наземно-повітряне середовище
- •Водне середовище
- •Екологічні групи жителів водойм
- •§26. Екологія як наука. Методи екологічних досліджень
- •Екологія як наука має
- •Напрями екологічних досліджень
- •Грибів рослин тварин
- •§27. Екологічні фактори, їхня характеристика.
- •§28. Біологічні адаптивні ритми організмів: добові, сезонні, річні
- •§29. Екосистеми. Взаємодія організмів в екосистемах
- •Структура екосистеми
- •Характеристика (показники) екосистеми
- •Властивості екосистеми
- •Топічні зв'язки
- •§30. Колообіг речовин та потік енергії в екосистемах
- •Ланцюги живлення
- •§31. Зміни в екосистемах
- •§32. Загальна характеристика біосфери. Планетарна роль живої речовини. Біогенні міграції речовин
- •Межі біосфери
- •Тема 5. Основи еволюційного вчення
- •§33. Розвиток еволюційних поглядів
- •§34. Основні положення еволюційного вчення Чарльза Дарвіна
- •Праці Дарвіна
- •Передумови еволюції за ч. Дарвіном. Мінливість (загальна властивість живих організмів)
- •Рушійні сили еволюції (за ч. Дарвіном)
- •Основні положення вчення ч. Дарвіна
- •§35. Синтетична теорія еволюції.
- •Гіпотеза пангенезису
- •Синтетична теорія еволюції
- •§36. Мікроеволюція. Фактори еволюційного процесу
- •Елементарні фактори еволюції
- •Хвилі життя (популяційні хвилі)
- •Дрейф генів
- •Ізоляція
- •Мікроеволюція
- •§37. Природний добір
- •Природний добір
- •§38. Адаптації (пристосування) як результат еволюційного процесу
- •§39. Макроеволюція. Дивергенція, конвергенція, паралелізм
- •Основні напрямки макроеволюції
- •Напрямки макроеволюції
- •§40. Біогенетичний закон. Палеонтологія. Докази еволюції органічного світу
- •Біогенетичний закон
- •Палеонтологічні докази еволюції
- •Тема 6. Історичний розвиток та різноманітність органічного світу
- •§41. Система органічного світу як відображення його історичного розвитку
- •Різноманітність органічного світу
- •Принципи класифікації організмів
- •§42. Гіпотези виникнення життя на Землі
- •Гіпотези виникнення життя Абіогенез
- •§43. Еволюція прокаріот
- •Розвиток життя в архейську еру
- •Особливості еволюції прокаріот
- •Зміна газового складу атмосфери
- •§44. Гіпотеза виникнення еукаріот. Виникнення зелених
- •Розвиток життя в протерозойську еру
- •Гіпотеза виникнення еукаріот
- •Значення перших багатоклітинних тварин
- •§45. Формування наземних екосистем
- •Умови існування в силурійських морях
- •Передумови виходу тварин на суходіл
- •Девон палеозою
- •§46. Повне освоєння суходолу живими організмами. Виші спорові рослини, різноманітні голонасінні. Різноманітність летючих комах
- •Різноманітність видів комах
- •§47. Розвиток наземних хребетних: розквіт земноводних, поява перших плазунів
- •§48. Вимирання одних таксонів, виникнення
- •Основні закономірності еволюції
- •§49. Виникнення людини та її роль у біосфері. Утворення ноосфери - єдина можливість збереження життя на Землі
- •Створення ноосфери - єдина можливість збереження життя на Землі
- •Ноосфера
§5. Будова, склад, властивості білків
Основні терміни і поняття: біяки-полшери, протеїни, протеїди, денатурація, ре-патурація, деструкція.
Вміст білків у різних органах тваринного організму (у % до сухої маси):
у м'язах - 80 у печінці - 57 у мозку - 45
у шкірі - 63 у кістках - 28
Молекулярна
маса
молекул
білків
- від
5 тисяч
до
150 тисяч
дальтон
і
більше.
Наприклад,
молекулярна
маса
одного
з
білків
яйця
дорівнює
36000 дальтон,
а
одного
з
білків
Структурні
формули
деяких
амінокислот
На
білому
фоні
показано
частину
молекули,
спільну
для
всіх
амінокислот.
На
сірих
плашках
зображені
бокові
групи,
що
розрізняються
у
різних
амінокислот.
Зверніть
увагу
на
те,
що
деякі
бокові
групи
містять
Сульфур,
Нітроген,
кільцеві
структури
або
угруповання,
що
несуть
електричний
заряд.
Зверніть
увагу
на
функціональні
групи
на
білому
фоні.
Тому
амінокислоти
мають
амфотерні
властивості.

Будова мономерів молекул білків
![]() глщин
глщин
\н
І
-СООІ1
-соон
ЦИСТЕЇН
т
ФЕНІЛАЛАНІН І №
f \ ГН. ( СООІІ
-(II. Г —
ГЛУТАММІ К»:
С C/Ij Cllf—C coon
It
Г ЛУТАМ1НОВА
КИСЛОТА
coon
ЛУТАМ1НОВА
КИСЛОТА
coon
м'язів -1500000 дальтон.
За величезні розміри і велику масу білки відносять до макромолекуляр-них сполук - полімерів. Наприклад, формула гемоглобіну СзоиНшбОї^тиЗвРе,. Ця білкова молекула нижче середньої величини.
Молекули білків мають вигляд довгих ланцюгів, які складаються з 5 -1500 амінокислотних ланок лише двадцятьох амінокислот.
Білки
Прості (протеїни) Складаються тільки з амінокислот
Складні (протеїди) Крім амінокислот, входять речовини небілкової природи
19
Рівні структурної організації білкових молекул
 Структура
білка
Структура
білка
Чим характеризується
Первинна
ліз-глу-тре-ала-ала-ала-ліз-фен-
глу-арг-глн-гіс-мет-асп-сер-сер-
тре-сер-ала-ала-сер-сер-сер-асн-
тир-цис-асн-глу-мет-мет-ліз-сер-
арг-асн-лей-тре-ліз-асп-арг-цис-
ліз-про-вал-асн-тре-фен-вал-гіс-
глу-сер-лей-ала-асп-вал-глн-ала-
вал-цис-сер-глн-ліз-асн-вал-ала-
цис-ліз-асн-глі-глн-тре-асн-цис-
тир-глн-сер-тир-сер-тре-мет-сер-
иле—тре-асп-цис-арг-глу-тре-гли-
сер-сер-лиз-тир-прс—асн-цис-ала-
тир-ліз-тре-тре-глн-ала-асн-ліз-
гіс-іле-іле-вал-ала-цис-глу-глі-
асн-про-тир-вал-лро-вал-гіс-фен-
асп-ала-сер-вал
Визначається порядком чергування амінокислот у ланцюзі. Саме це визначає особливі фізико-хімічні і біологічні властивості білка. Амінокислоти з'єднуються між собою міцним ковалентним, пептидним зв'язком (-CO-NH-).
\ І'-
/~Ш"їтгс\
и н ik.h и он
вільна пептидний вільна
аміногрупа зв'язок карбоксильна
група
Вторинна
Являє собою спірально закручений білковий ланцюжок. Витки спіралі утримуються водневими зв'язками, що утворюються між СО-і NH- групами, розташованими на сусідніх витках.
с'
\
І»и
Третинна
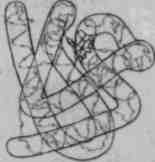
Виникає внаслідок закручування вторинної спіральної структури в клубок (глобулу) як якісно нове утворення. Клубок утримується гідрофобними, іонними, водневими взаємодіями. Особливу роль у стабілізації цієї структури відіграють дисульфідні зв'язки, що виникають між залишками амінокислоти цистеїну.

Формується кількома молекулами білка, які знаходяться в третинній структурі, і, взаємодіючи між собою, утворюють стійку конфігурацію. Утримують цю структуру гідрофобні, електростатичні та інші взаємодії і водневі зв'язки.
![]()
Властивості білка (на прикладі білка курячого яйця)
В'язкий безбарвний розчин, який частково розчиняється у воді, частково - у розчині NaCI.
Вступають у нерозчинні сполуки із солями важких металів. На цьому засноване застосування білків як протиотрути при отруєнні сполуками свинцю і ртуті.
При нагріванні під впливом кислот, фенолу, спирту та інших речовин білки денатуруються - втрачають характерні властивості. Денатурація використовується на практиці в молочній промисловості при виробництві сиру.
I3ana.ii 'япшите! Кількість інформації, що несе молекула, залежить від ступеня неоднорідності її складових частин. Молекули крохмалю, глікогену, клітковини складаються з однакових ланок (А-А-А-...-А) і тому несуть мало інформації. Молекули білків, що складаються з неоднорідних мономерних ланок (А-В-С-А-...-К), містять велику кількість інформації. Тому білки називають інформаційними полімерами.
І Це цікаво Проблема штучного синтезу білка
Це питання принципово розв'язане наукою. У результаті багаторічної копіткої роботи вдалося здійснити повний штучний синтез білків - інсуліну, рибонуклеази. Процес одержання інсуліну складався з 228 окремих стадій, для кожної необхідно було підібрати відповідні реактиви, каталізатори, оптимальні умови. Той самий білок у клітині утворюється за секунди. Цей процес в живих організмах навдивовижу досконалий!
Учнівська сторінка
1. За нашого часу відомо понад 100 природних амінокислот з відомими будовами і функціями Переважна більшість їх знаходиться в організмах у вільному вигляді і лише 20 з них входять до складу білків.
Амінокислоти, що входять до складу білків (основні амінокислоти). Зробіть аналіз
1. Аланін (ала) |
11. Лейцин (лейї |
2. Аргінін (аргі |
12. Лізин (ліз)\' |
3. Аспарагін (асн) |
13. Метіонін (мет) \' |
4. Аспарагінова кислота (асп) |
14. Пролін (про) |
5. Валін (вал) |
15. Серин (сер) |
6. Гістидин (гіс) |
16. Тирозин (тир) |
7. Гліцин (глі) |
17. Тоеонін (тое) |
8. Глутамін (глн) |
18. ТоиптосЬан (три) v |
9. Глутамінова кислота (глу) |
19. Фенілаланін (сЬен) |
10. Ізолейцин (іле) |
20. Цистеїн (цис) |
Не всі амінокислоти рівноцінні в харчовому відношенні. Людина і тварини втратили здатність синтезувати амінокислоти, які називають незамінними. їх 9 (підкреслені), але на практиці доводиться зустрічатися з недостачею у харчовому раціоні трьох (біля них стоїть значок V). їх синтезують рослини, гриби, бактерії.
21
Чому в харчовому раціоні людини повинні бути продукти рослинного походження?
(6 балів)
2 Заміна однієї амінокислоти або заміна послідовності розташування амінокислот в складі молекули білка, як правило, призводить до зміни його функції. Цим досягається ге-.'-ез-а одноманітність первинної структури білкових молекул
Скільки різних поліпептидів можна побудувати з 10 амінокислот, якщо в білку 350 амінокислотних ланок? (5 балів)
Задача.
Розв'язання.
Дано:
m (амінокислот) = 10;
п (амінокислотних ланок) = 350;
k = mn
k (поліпептидів) = ?
k =
Віяповіль. Якщо в білку 10 амінокислот і 350 амінокислотних ланок, то можна побу дувати різних поліпептидів.
3. Поясніть перетворення молекули білка. (8 балів)
Природний Зміна третинної (нативний) і четвертинної структур стан білка ь
ренатурація
Довільне відновлення
Руйнування первинної структури
деструкція
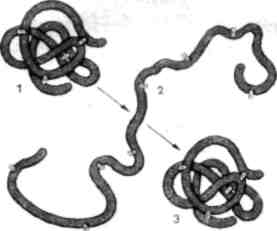
а - ренатурація; б-деструкція; в - іонний зв'язок;
з - ковалентний зв'язок; д - водневий зв'язок; ж - гідрофобні взаємодії.
Структура |
Типи зв'язку |
Зворотність денатурації |
Первинна |
|
|
Вторинна |
|
|
Третинна |
|
|
Четвертинна |
|
- - |
22
