
- •11 Класс
- •Раздел I органические соединения
- •§ 1. Предельные одноатомные спирты
- •§ 2. Глицерин
- •§ 3. Фенол
- •§ 4. Альдегиды
- •§ 5. Предельные одноосновные карбоновые кислоты
- •§ 6. Взаимосвязь между углеводородами, спиртами, альдегидами и карбоновыми кислотами
- •§ 7. Сложные эфиры
- •§ 8. Жиры. Мыло
- •§ 9. Углеводы. Глюкоза
- •§ 10. Сахароза
- •§ 12. Целлюлоза
- •§ 13. Аминокислоты. Белки
- •§ 14. Искусственные и синтетические волокна
- •§ 15. Взаимосвязь между органическими веществами, их многообразие
- •Раздел II роль химии в жизни общества
- •Альдегиды.
- •§ 16. Значение химии в создании
- •§ 17. Значение химии в решении сырьевой проблемы
- •§ 18. Значение химии в решении энергетической проблемы
- •§ 19. Значение химии в повседневной жизни
- •§ 20. Химия и экология
- •§ 21. Место химии среди наук о природе, ее значение для понимания научной картины мира
- •§ 22. Основные понятия химии
- •§ 23. Основные законы химии. Атомно-молекулярное учение
- •§ 24. Химическая связь
- •§ 25. Строение неорганических и органических веществ
- •§ 27. Классификация химических реакций
- •§ 28. Основные закономерности
- •§ 29. Генетическая связь между неорганическими и органическими веществами
- •2. Растворимость кислот, основ и солей в воде
§ 4. Альдегиды
![]()
По сравнению со спиртами в составе молекул альдегидов на два атома водорода меньше. Это отражается в названии «альдегиды», производной от слов «алкоголь» и «дегидри-рование», то есть дегидрированный алкоголь.
Название первого члена гомологического ряда — мета-наль, или формальдегид, или муравьиный альдегид:

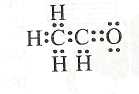
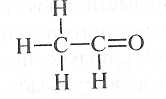
Следующий в гомологическом ряду — этаналь, или ацет-альдегид, или уксусный альдегид.

Традиционные названия альдегидов происходят от назва-ний кислот, в которые превращаются эти альдегиды в резуль-тате окисления (в приведенных примерах — от муравьиной и
уксусной кислот).
Международные названия альдегидов образуются от из-вестных вам названий углеводородов прибавлением суффикса -аль. Таким образом, следующий в гомологическом ряду — пропаналь
![]()
Состав и строение молекул альдегидов. К классу аль-дегидов принадлежат вещества, в молекулах которых функ-
![]()
циональная альдегидная группа
соединена с угле-
водородным радикалом (в простейшем из этих веществ — с атомом водорода).
Общая формула альдегидов
Физические свойства ацетальдегида. Это летучая бес-цветная жидкость, хорошо растворимая в воде, имеет харак-терный резкий запах.
Химические свойства ацетальдегида. Двойная связь между атомами углерода и кислорода в альдегидной группе поляризована за счет оттягивания электронов атомом кисло-рода как более электроотрицательного элемента. На нем воз-
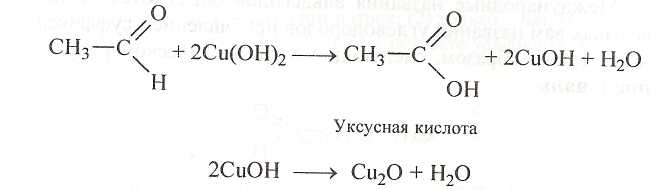
![]()

Именно это определяет химическую активность альдеги-дов. Они легко вступают в реакции окисления. Полное окисление (горение) происходит по схеме:
Частичное окисление ацетальдегида мож-но провести с помощью гидроксида меди(П). К свежеприготовленному осадку гидроксида меди(П), полученному в результате сливания растворов сульфата меди(Н) и гидроксида натрия, добавим раствор ацетальдегида, смесь нагреем. В пробирке образуется желтый оса-док гидроксида меди(1), который быстро раз-лагается на оксид меди(1) красного цвета и воду:
Окислить ацетальдегид можно и другим реактивом — аммиачным раствором оксида серебра(1). В результате нагревания в тщательно вымытой пробирке смеси этого реактива с уксусным альдегидом на стенках посуды выпадает осадок металлического серебра, покрывающего стенки блестящим слоем. По этому признаку реакция называется реакцией «серебряного зеркала».
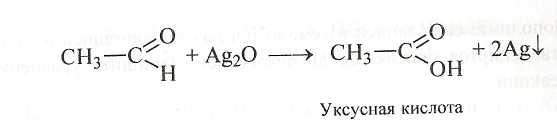
Приведенные реакции являются характерными для альдеги-дов и используются с целью их аналитического определения.
Поскольку альдегидная группа содержит двойную связь, можно предположить, что альдегид будет вступать в реакцию присоединения по месту этой связи.
Для какой группы органических веществ характерны реакции присоединения? Приведите уравнение реакции гидрирования.
Присоединяя водород, ацетальдегид превращается в эти-ловый спирт:
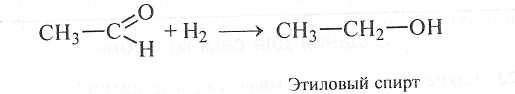
Таким образом можно восстановить альдегид в спирт. С другой стороны, спирт можно окислить до альдегида.
Лабораторная работа 2 Окисление спирта в альдегид
Медную проволочку раскалите в пламени спиртовки. Когда она покроется медной окалиной (СиО), опустите ее в пробирку с этиловым спиртом. Ощущается характерный запах уксусного
альдегида.
Обратите внимание на цвет медной проволочки — окалина восстанавливается до металлической меди. Реакция происхо-дит по уравнению:
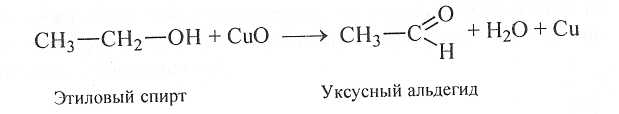
• Дополните свои записи в теме «Спирты» информацией о свойстве спиртов окисляться до альдегидов. Запишите уравнение реакции.
Рассмотренные реакции окисления и восстановления важны для осуществления взаимных превращений веществ различных классов.
Применение уксусного альдегида. Реакция окисления обусловливает применение этого соединения для получения уксусной кислоты. В небольших количествах уксусный альдегид образуется при обмене веществ в организме человека, например в результате метаболизма алкоголя. Избыток ацет-альдегида очень вреден и вызывает неприятные ощущения, которые используются для лечения алкоголизма.
Задания для самоконтроля
Какие соединения называются альдегидами?
Докажите, что наличие функциональной альдегидной груп пы влияет на химическую активность ацетальдегида.
Как химическим путем различить глицерин и уксусный аль дегид?
26. Как химическим путем можно распознать этанол? 27*. Составьте химические уравнения по схеме:
![]()
28*. 40%-й водный раствор формальдегида (формалин) используется как дезинфицирующее и дубильное средство для консервации анатомических препаратов. Какой объем формальдегида (это газ при н. у.) необходимо растворить в воде, чтобы приготовить 200 г формалина?
