
- •11 Класс
- •Раздел I органические соединения
- •§ 1. Предельные одноатомные спирты
- •§ 2. Глицерин
- •§ 3. Фенол
- •§ 4. Альдегиды
- •§ 5. Предельные одноосновные карбоновые кислоты
- •§ 6. Взаимосвязь между углеводородами, спиртами, альдегидами и карбоновыми кислотами
- •§ 7. Сложные эфиры
- •§ 8. Жиры. Мыло
- •§ 9. Углеводы. Глюкоза
- •§ 10. Сахароза
- •§ 12. Целлюлоза
- •§ 13. Аминокислоты. Белки
- •§ 14. Искусственные и синтетические волокна
- •§ 15. Взаимосвязь между органическими веществами, их многообразие
- •Раздел II роль химии в жизни общества
- •Альдегиды.
- •§ 16. Значение химии в создании
- •§ 17. Значение химии в решении сырьевой проблемы
- •§ 18. Значение химии в решении энергетической проблемы
- •§ 19. Значение химии в повседневной жизни
- •§ 20. Химия и экология
- •§ 21. Место химии среди наук о природе, ее значение для понимания научной картины мира
- •§ 22. Основные понятия химии
- •§ 23. Основные законы химии. Атомно-молекулярное учение
- •§ 24. Химическая связь
- •§ 25. Строение неорганических и органических веществ
- •§ 27. Классификация химических реакций
- •§ 28. Основные закономерности
- •§ 29. Генетическая связь между неорганическими и органическими веществами
- •2. Растворимость кислот, основ и солей в воде
§ 23. Основные законы химии. Атомно-молекулярное учение
Вы уже знаете, что первые попытки объяснить устройство окружающего нас материального мира носили чисто философский характер. Еще древнегреческие философы Левкипп и Демокрит (V—IV вв. до н. э.) утверждали, что все вещества состоят из мельчайших частиц — атомов, которые находятся в постоянном и непрерывном движении; атомы разделены пустым пространством. По представлению этих мыслителей, вещества отличаются друг от друга числом и расположением образующих их атомов. Все происходящие в мире изменения они объясняли соединением и разъединением атомов, предполагая, что у атомов существует внутренний источник движения и они сами способны взаимодействовать друг с другом.
Учение древнегреческих философов об атомах выглядит удивительно современно, и нам оно вполне понятно. Но в то время ни одно из его положений не было доказано. И атомистика оставалась просто догадкой, смелым предположением, философской концепцией, не подкрепленной практикой. Это привело к тому, что одна из гениальных догадок человеческого разума постепенно была предана забвению.
Об учении атомистов не вспоминали почти 20 веков. И лишь в первой половине XVII в. учение об атомах вновь возрождается благодаря работам французского философа Пьера Гассенди (1592—1655). Он утверждал, что различные виды
ДЕМОКРИТ (около 460—370 до н. э.)
Величайший представитель древнегреческой философии, основоположник атомистической гипотезы объяснения мира. Ему принадлежат исследования по астрономии, геологии, зоологии, математике, физике, медицине, логике. Наряду с этим он писал сочинения об искусстве, музыке и поэзии.

(1711—1765)
Русский ученый-энциклопедист, первый российский академик Петербургской АН (с 1745), один из основателей современного естествознания. Поражает широта его научных интересов и глубина проникновения в тайны природы. По словам А. С. Пушкина: «Историк, ритор, механик, химик, минералог, художник и стихотворец — он все испытал и все постиг». В своих теоретических представлениях исходил из атомно-молекулярной теории строения
вещества и принципа сохранения вещества и движения. Ввел в химию количественные методы исследования. Заложил основы физической химии.
атомов, которых в природе совсем немного, соединяясь друг с другом, образуют более крупные частицы — молекулы, из которых построены вещества.
М. В. Ломоносов в XVIII в. развил атомно-молекулярные представления в стройную естественнонаучную систему и впервые ввел их в химию. Собственно, современная химия началась с тех пор, когда были поняты и приняты большинством ученых основные положения о внутреннем строении вещества, представления об атомах как носителях свойств элементов и молекулах как носителях химических свойств различных веществ. Эти представления объединяются в атомно-молекулярное учение и помогают установить те законы, которые принято называть основными законами химии.
Закон сохранения массы. Исключительное значение для развития химии имело установление закона сохранения массы, являющегося следствием всеобщего закона сохранения материи и движения, сформулированного М. В. Ломоносовым в 1748 г. как всеобщий естественный закон: «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому: так ежели где убудет несколько материи, то умножится в другом месте... Сей всеобщий закон простирается и в самые правила движения; ибо тело, движущее своей силой другое, столь-

АНТУАН ЛАВУАЗЬЕ
(1743—1794)
Французский ученый, один из основателей современной химии. Экспериментально доказал, что воздух — не простое тело, как считалось в то время, а смесь различных по свойствам газов. Предложил название «кислород» и объяснил его роль в процессах обжига, горения, дыхания. Дал определение химического элемента, установил химический состав воды, оксидов азота, углекислого газа, серной кислоты, ряда минералов. Доказал закон сохра-
нения массы вещества. Один из основателей термохимии. Гильотинирован в период Французской революции.
ко же оныя у себя теряет, сколько сообщает другому, которое от него движение получает».
В 1756 г. М. В. Ломоносов экспериментально подтвердил это положение, высказанное в виде философской концепции, проводя опыты по обжигу металлов в запаянной реторте.
Независимо от Ломоносова, закон сохранения массы был открыт и введен в химию французским ученым Антуаном Лавуазье в 1789 г., который сделал еще один важный вывод, что при химических реакциях сохраняется не только общая масса веществ, но и масса каждого элемента, входящего в состав реагирующих веществ. Следовательно, при химических реакциях элементы не превращаются друг в друга, а сохраняются.
Современная формулировка закона сохранения массы следующая:
I масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате реакции.
Это можно объяснить тем, что в процессе химической реакции происходит только перегруппировка атомов, но число атомов и масса каждого атома остаются постоянными. Если же число атомов каждого элемента, а следовательно их общая масса, не изменяются, то и масса реагентов должна всегда быть равной массе продуктов.

(1754—1826)
Французский химик, член Парижской АН (с 1816). Установил закон постоянства состава химических соединений. Открыл гидроксиды металлов, предложил термин «гидрат». Исследовал ряд оксидов и сульфидов металлов. Работал также в области органической химии, выделил глюкозу, открыл аминокислоту лейцин, исследовал камфару, крахмал, сахар.
Закон сохранения массы сыграл значительную роль в становлении атомно-молекулярного учения и дальнейшем развитии химии как науки.
На основании закона сохранения массы составляются уравнения химических реакций и производятся практически важные расчеты.
Закон постоянства состава. Следующим шагом в развитии химии явилось установление положения о постоянстве состава веществ, выведенного французским ученым Ж. Прустом:
I каждое химически чистое вещество имеет постоянный состав, независимо от условий ш спо-! собов его получения.
Например, воду можно получить любым способом:
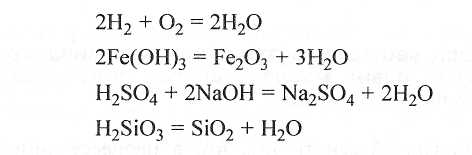
Итак, если вещество представляет собой индивидуальное химическое соединение (без примесей), то состав его постоянен и не зависит от способа получения. Отклонение от указанного состава свидетельствует о присутствии примесей. Однако обратное утверждение — каждому определенному составу отвечает только одно химическое соединение — неверно. Например, диметиловый эфир СН3—О—СН3 и этиловый спирт С2Н5ОН имеют одинаковый химический состав С2Н6О, но являются различными химическими соединениями, отличающимися друг от друга структурой молекул, т. е. порядком соединения в них атомов.
|| Вещества с одинаковым химическим составом и различным строением называются изо-! мерами.
Следовательно, количественный состав сам по себе не определяет специфику вещества.
Правильность высказанного Ж. Прустом положения о постоянстве состава веществ отрицал известный в то время авторитет, французский химик К. Бертолле, считавший, что состав вещества может изменяться в определенных пределах.
Вопрос о постоянстве состава веществ стал предметом семилетнего спора между Ж. Прустом и К. Бертолле. В результате тщательной экспериментальной проверки взглядам Ж. Пруста в то время было отдано предпочтение. Высказанное им положение в 1808 г. было признано законом постоянства состава.
В действительности же взгляды обоих ученых были справедливы. Это доказал русский химик академик Н. С. Курнаков, который в начале XX в. сформулировал представление о веществах постоянного состава — дальтонидах и переменного состава — бертоллидах .
Соотношение атомов водорода и кислорода в молекуле воды всегда 2 : 1, а массовое соотношение 2:16 или 1 : 8 (учитывая, что АГ(Н) = I, а ^4/0) = 16). Массовые доли водорода и кислорода в химически чистом образце воды соответственно составляют 11,12 % и 88,88 %.
Бертоллидами являются оксиды, гидриды, сульфиды, нитриды, карби-ды и другие бинарные соединения й- и /-элементов. Например, соедине-ниями переменного состава являются РеО, *П2О3, 1ЧЬН, ТаЫ, ЦО^ и др., поэтому приведенные формулы являются формальными.


'■* А что вам сегодня известно о составе вещества? Назовите в качестве примера какие-либо частицы, которые, по вашему мнению, входят в состав вещества.
В настоящее время высказанное Ж. Прустом положение законом не считается. Известно, что многие вещества имеют нем.олекулярное строение. Их состав может меняться в определенных пределах в зависимости от условий получения. Кроме того, даже некоторые вещества молекулярного строения, например полимеры, не имеют постоянного состава.
Закон объемных отношений. Известно, что масса веществ при химических реакциях сохраняется постоянной. В отличие от массы объем реагентов может существенно меняться. Это происходит тогда, когда в реакции принимают участие газообразные вещества или образуются газообразные продукты.
Измеряя объемы газов, вступивших в реакцию и образовавшихся в результате ее, французский ученый Ж. Гей-Люссак
ЖОЗЕФ-ЛУИ ГЕЙ-ЛЮССАК
(177»—1850)
Французский химик и физик. Открыл газовые законы, названные его именем. Занимался фундаментальными исследованиями в области физической, неорганической и органической химии. Внес весомый вклад в изучение галогенов, фосфорных кислот, щелочных металлов. Содействовал распространению объемных методов в аналитической химии. Открыл циан (1815), разработал метод приготовления щавелевой кислоты. Сконструировал башню с системой свинцовых камер, которая в технологии серной кислоты носит его имя.
в 1808 г. сформулировал закон объемных отношений, известный как «химический» закон Гей-Люссака:
11 объемы вступивших в реакцию газов относятся 11 друг к другу и к объемам полученных газооб-11 разных продуктов как небольшие целые числа.
При этом считается, что все объемы газов приведены к одинаковым температуре и давлению. Например, при синтезе хлороводорода из простых веществ — водорода и хлора
Н2(г) + С12(г) = 2НС1(г) соотношение объемов газов следующее:
У(Н2) : К(С12) : К(НС1) =1:1:2,
т. е. 1 л водорода соединяется с 1 л хлора и при этом образуется 2 л хлороводорода. Следовательно,
|| в уравнениях химических реакций коэффици-| енты перед формулами газообразных веществ
II соответствуют их объемам.
Как объяснить выявленную закономерность?
Закон Авогадро. Выявленную Ж. Гей-Люссаком закономерность объясняет закон, открытый в 1811 г. итальянским ученым Амедео Авогадро.
АМЕДЕО АВОГАДРО (1776—1856)
Итальянский физик и химик. Заложил основы молекулярной теории, открыл один из газовых законов, названный его именем. Определил состав и относительную молекулярную массу многих веществ. Доказал, что молекулы водорода, кислорода, азота, хлора двухатомны. Его работы способствовали дальнейшему развитию атомно-молекулярной теории.
В равных объемах различных газов при одинаковых условиях (давлении и температуре) содержится одинаковое число молекул.
Из закона Авогадро вытекают два следствия. Следствие первое:
| один моль любого газа при одинаковых усло-I виях занимает одинаковый объем.
При нормальных условиях (давлении в 1 атм (101325 Па) и температуре 273,15 К или О °С) объем 1 моль любого газа будет равен 22,4 л. Постоянная Ут = 22,4 л/моль называется молярным объемом газа при нормальных условиях (н. у.). При любых условиях
| молярный объем газа — это величина, равная отношению объема газа при данных условиях к 11 количеству вещества этого газа
![]()
где Ут — молярный объем газа, м /моль (л/моль); V— объем газа при данных условиях, м (л); п — количество вещества газа, моль.
При стандартных условиях (давлении в 1 атм (101325 Па) и температуре 298,15 К или 25 °С) молярный объем газа равен не 22,4, а 24,4 л/моль.
Молярный объем газа Ут можно вычислить также, зная молярную массу газа М и его плотность.
Молярный объем газа — это величина, равная отношению молярной массы газа к его ! плотности
![]()
где Ут — молярный объем газа, м/моль(л/моль); М—молярная масса газа, кг/моль (г/моль); р — плотность газа,
. кг/м3 (г/л).
Следствие второе: масса одного и того же объема газа тем больше, чем больше масса его молекул. Если в одинаковых объемах газов при одних и тех же условиях содержится одинаковое число молекул, то очевидно, что
отношение масс одинаковых объемов газов при одних и тех же условиях равно отношению их молярных масс
![]()
где П1\ — масса определенного объема первого газа; т2 — масса такого же объема второго газа; М\ и М2 — молярные массы соответственно первого и второго газов.
Отношение массы определенного объема
данного газа к массе такого же объема другого
газа (взятого ори тех же условиях) называется
относительной плотностью первого газа по
I второму:
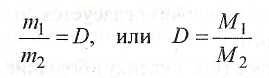
Следовательно, можно утверждать, что
11 плотности различных газов, взятых при оди-| наковых условиях, пропорциональны их моляр-| > ным массам
![]()
Периодический закон. Основываясь на атомно-молеку-лярном учении и химических свойствах элементов, Д. И. Менделеев в 1869 г. открыл периодический закон — один из основных законов природы. Современная формулировка периодического закона:

о Вспомните историю открытия Д. И. Менделеевым периодического закона.
& Расскажите о периодической системе с точки зрения строения атома.
Кроме известной вам так называемой короткой формы изображения периодической системы, используется еще и «длинная» форма, также предложенная самим Менделеевым. Вообще-то существует много вариантов изображения периодической системы и не только в виде таблицы. Но из табличных вариантов в настоящее время наиболее распространенными являются короткая и длинная формы. Они взаимно дополняют друг друга и в целом идентичны. Однако в последнее время длинная форма приобретает большую популярность, поскольку она ярче согласуется со строением атомов химических элементов.
В длинной форме (см. вклейку) большие периоды, так же как и малые, занимают только одну горизонталь, на два ряда не делятся. Слева располагаются 5-элементы, в атомах которых заполняются 5-орбитали; справа—/>-элементы, в атомах которых заполняются р-орбитали. У 5- и /(-элементов заполняется внешний электронный слой. Среднюю часть больших периодов занимают так называемые переходные элементы, в атомах которых заполняются а'-орбитали предвнешнего слоя. Семейства лантаноидов и актиноидов — это/-элементы. У них заполняется третий снаружи слой. Эти семейства, как правило, выносят за пределы таблицы как в короткой, так и в длинной формах. Различие в последовательности заполнения электронных слоев (внешних и более глубоко расположенных) объясняет причину различной длины периодов.
Длинная форма периодической системы включает 16 групп — 8 главных и 8 побочных (подгрупп нет), обозна-
ДМИТРИЙ ИВАНОВИЧ
МЕНДЕЛЕЕВ (1834—1907)
Русский химик, разносторонний ученый, педагог, прогрессивный общественный деятель. Открыл периодический закон химических элементов (1869).. Создал периодическую систему, которую неустанно совершенствовал. Она получила полное признание еще при жизни Менделеева. Поражает широта интересов ученого: он автор многих фундаментальных исследований по химии, химической технологии, физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, народному просвещению и др. Был избран членом Лондонского королевского общества, Римской, Парижской, Берлинской АН, а также почетным членом многих научных обществ России, Западной Европы и Америки.
чаемых буквами А и Б. Положение в группах 5- и/^-элементов определяется общим числом электронов внешнего слоя, а й- элементов — общим числом з-электронов внешнего и й?-электронов предвнешнего слоев. Периодическая повторяемость строения внешних электронных оболочек атомов является причиной периодического изменения свойств химических элементов. В этом заключается физическая сущность периодического закона, которая не зависит от формы представления периодической системы элементов.
Открытие в конце XIX в. электрона, радиоактивности, сложного строения атома, элементарных частиц привело к тому, что многие положения классического атомно-молеку-лярного учения пришлось пересмотреть. Так, еще Д. И. Менделеев говорил об атоме как о химически неделимой частице. Исследование свойств твердых тел показало, что в подавляющем большинстве случаев молекулярная теория к ним неприменима. Кристаллы солей состоят не из молекул, а из ионов, существование которых никак не вытекает из основ атомно-молекулярной теории.
И все же основные представления атомно-молекулярной теории прочно вошли в химическую науку. Все открытия
![]()
Основы атомно-молекулярного учения широко используются не только в современной химии, но и в физике, биологии, геологии, астрономии и других естественных науках.
Задания для самоконтроля
Сформулируйте закон сохранения массы. Кем он был от крыт и какое значение имеет?
Для сгорания 100 г метана необходимо 400 г кислорода. При этом образуется 225 г воды. Определите массу образовавшегося оксида углерода(1У).
Что вам известно о постоянстве состава веществ?
Сформулируйте закон объемных отношений и объясните его на конкретном примере.
Хватит ли 400 м3 кислорода для сжигания 100 м3 пропана?
Сформулируйте закон Авогадро и объясните следствия из него.
Определите объем водорода (н. у.), выделившегося при взаимодействии алюминия количеством вещества 0,5 моль с рас твором серной кислоты.
Элемент, атом, молекула простого вещества— в чем разли чие этих понятий?
Сформулируйте периодический закон и раскройте его зна чение.
Из указанных элементов третьего периода наиболее ярко выраженными неметаллическими свойствами обладает
алюминий; (3) сера;
кремний; (4) хлор.
145. Основные свойства элементов главной подгруппы первой группы с увеличением протонного числа (порядкового номера)
ослабевают;
усиливаются;
остаются неизменными;
ослабевают, а затем усиливаются.
I
146. Формула соединения азота с кислородом, в котором массо-.вая доля азота составляет 30,4 %, а молекулярная масса в газообразном состоянии равна 92, это:
![]()
147. Что, по вашему мнению, позволяет считать элементы С1 и I аналогами, а что указывает на их различия?
![]()
149*. При взаимодействии двухвалентного металла массой 6,85 г с водой выделился водород объемом 1,12 л (н. у.). Этот металл
148*. Массовая доля водорода в соединении с элементом IV группы равна 0,125. Водородное соединение этого элемента имеет формулу
