
- •11 Класс
- •Раздел I органические соединения
- •§ 1. Предельные одноатомные спирты
- •§ 2. Глицерин
- •§ 3. Фенол
- •§ 4. Альдегиды
- •§ 5. Предельные одноосновные карбоновые кислоты
- •§ 6. Взаимосвязь между углеводородами, спиртами, альдегидами и карбоновыми кислотами
- •§ 7. Сложные эфиры
- •§ 8. Жиры. Мыло
- •§ 9. Углеводы. Глюкоза
- •§ 10. Сахароза
- •§ 12. Целлюлоза
- •§ 13. Аминокислоты. Белки
- •§ 14. Искусственные и синтетические волокна
- •§ 15. Взаимосвязь между органическими веществами, их многообразие
- •Раздел II роль химии в жизни общества
- •Альдегиды.
- •§ 16. Значение химии в создании
- •§ 17. Значение химии в решении сырьевой проблемы
- •§ 18. Значение химии в решении энергетической проблемы
- •§ 19. Значение химии в повседневной жизни
- •§ 20. Химия и экология
- •§ 21. Место химии среди наук о природе, ее значение для понимания научной картины мира
- •§ 22. Основные понятия химии
- •§ 23. Основные законы химии. Атомно-молекулярное учение
- •§ 24. Химическая связь
- •§ 25. Строение неорганических и органических веществ
- •§ 27. Классификация химических реакций
- •§ 28. Основные закономерности
- •§ 29. Генетическая связь между неорганическими и органическими веществами
- •2. Растворимость кислот, основ и солей в воде
§ 14. Искусственные и синтетические волокна
Как вам известно, натуральные волокна — хлопок, лен, шерсть, шелк — вырабатывают из природных волокнистых материалов. Природный полимер целлюлоза также имеет волокнистую структуру, однако она недостаточно упорядочена, чтобы из нее можно было выработать нитки. С этой целью необходимо перестроить структуру вещества. Это достигается химическим путем: целлюлозу, выделенную из древесины, обрабатывают специальными веществами, продукт растворяют.
 В
растворе полимерные молекулы становятся
более подвижными,
теперь из них можно формировать волокно
(растворитель
при этом испаряется). Таким образом
производят искусственные (ацетатное
или вискозное) волокна, а из них —
искусственный
(ацетатный или вискозный) шелк.
В
растворе полимерные молекулы становятся
более подвижными,
теперь из них можно формировать волокно
(растворитель
при этом испаряется). Таким образом
производят искусственные (ацетатное
или вискозное) волокна, а из них —
искусственный
(ацетатный или вискозный) шелк.
Волокна
можно производить и синтетическим
путем.
Если
хлопок — полимерный материал, мономер
которого целлюлоза, то шерсть и шелк
— полимеры белковой природы, молекулы
которых образуются путем соединения
аминокислот. Как оказалось, подобную
структуру имеет полимер ами-нокапроновой
кислоты состава![]() Общая
Общая
формула полимера:
![]()
® Составьте схему соединения между собой трех молекул амино-капроновой кислоты по образцу, приведенному в § 13.
Волокно, изготовленное из такого полимера, называется капрон. Оно прочное, не вытирается, не поглощает влагу (именно поэтому быстро высыхает), хотя и имеет некоторые
недостатки.
• Учитывая, что это волокно белковой природы, выскажите предположение о его отношении к кислотам, к нагреванию. Сделайте пояснения.
Лабораторная работа 10
Ознакомление с образцами природных, искусственных и синтетических волокон
Рассмотрите образцы волокон и тканей из них: шерсти, шелка натурального, хлопка, шелка искусственного, шелка вискозного, капрона, лавсана.
Чем отличаются волокна по внешнему виду? Мнутся ли ткани? Намочите образцы. Поглощают ли они влагу?
Сделайте выводы.
Лабораторная работа 11
Отношение синтетического волокна капрон к кислотам и щелочам
В пробирки с концентрированной серной кислотой и 10%-м раствором щелочи поместите по кусочку капроновой ткани. Что наблюдаете?
Сделайте вывод о растворимости капрона.
Задания для самоконтроля
На какие группы делятся волокна? Приведите примеры-
Охарактеризуйте преимущества и недостатки синтетических волокон.
Расскажите о применении синтетических волокон. Какими изделиями из них вы пользуетесь?
Охарактеризуйте значение синтетических материалов в ва шей жизни.
§ 15. Взаимосвязь между органическими веществами, их многообразие
Изучая органические вещества, вы постепенно переходили от простейших, таких, как метан, к более сложным и сложнейшим, таким, как белки. Между метаном и белками располагается огромное количество соединений, разнообразных по строению и свойствам. Попытаемся обобщить признаки, обусловливающие это многообразие.
Прежде всего, это характер углеродного скелета. Молекулы органических веществ с одинаковым числом углеродных атомов могут иметь форму закрытых и открытых цепей. Например, гексан, принадлежащий к предельным углеводородам, и бензол, ароматический углеводород. Обе молекулы содержат по шесть углеродных атомов, соединенных, однако, разным способом.

рода как более
электроотрицательного элемента
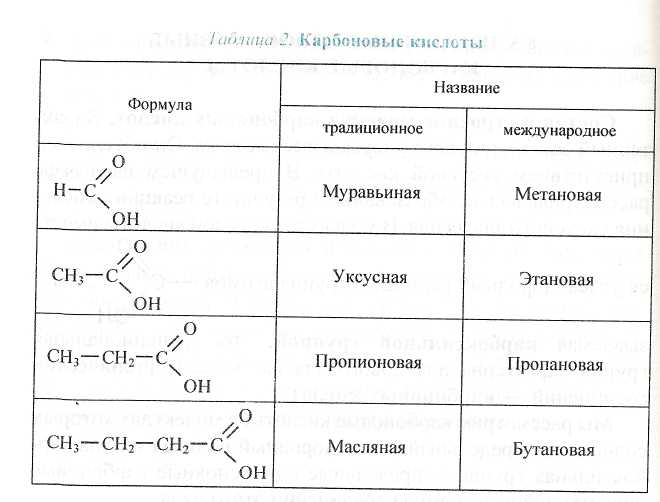

Физические свойства уксусной кислоты. Уксусная кислота — бесцветная жидкость, летучая, имеет резкий специфический запах, смешивается с водой в любых пропорциях, раствор кислый на вкус. В быту известна в виде 3—9%-го водного раствора (уксус) или 80%-го водного раствора (уксусная эссенция).
Химические свойства уксусной кислоты. Они обусловлены наличием функциональной карбоксильной группы. Электронная плотность связи О—Н смещается к атому кисло-
26
связь поляризуется, атом водорода в результате приобретает дополнительную подвижность (способность отщепляться), что и обусловливает кислотные свойства уксусной кислоты.
Действие уксусной кислоты на индикаторы
В две пробирки налейте по 1—2 мл раствора уксусной кислоты. К содержимому одной пробирки добавьте несколько капель раствора лакмуса, к другой — раствора метилового оранжевого. Наблюдайте изменение окраски индикаторов.
Какой цвет приобретают исследуемые растворы?
Изменение окраски индикаторов свидетельствует о кислотной среде, которая создается благодаря электролитической диссоциации уксусной кислоты.
С образованием каких ионов диссоциируют неорганические кислоты? Напишите уравнение электролитической диссоциации азотной кислоты.
Степень диссоциации уксусной кислоты очень низкая: в 0,1-молярном растворе при н. у. только три молекулы из ста миллионов распадаются на ионы Н+ и ацетат-ионы СН3СОО~. Значит, уксусная кислота — слабый электролит, поэтому в ионных уравнениях реакций ее формула записывается в молекулярном виде.
Подобно неорганическим кислотам уксусная кислота взаимодействует с металлами, щелочами, основными оксидами, солями. В этом можно убедиться на опытах.
• Напишите молекулярные и структурные формулы гексана и бен зола.
Другой признак — характер межуглеродных связей.
Между атомами углерода могут устанавливаться простые и кратные, а также ароматические связи.
• Приведите формулы и названия веществ с разными видами меж углеродных связей.
Наличие функциональных групп обусловливает существование разных классов органических соединений (спиртов, альдегидов, карбоновых кислот, сложных эфиров и пр.), а также соединений, содержащих несколько функциональных групп,— аминокислот, углеводов и многих других, не изучаемых вами из-за их сложности.
* Приведите формулы и названия веществ с разными функцио нальными группами.
Изомерия — еще одна из причин многообразия органических вещест. Благодаря этому явлению из одного и того же количества атомов могут образоваться разные по строению, а значит, и свойствам, вещества.
* Приведите примеры веществ-изомеров, напишите их структур ные формулы.
Кроме изученных вами видов изомерии углеродного скелета существуют еще и другие виды изомерии, обусловленные не только химическим, но и пространственным строением молекул.
Изменение состава молекулы на группу —СН2 обусловливает появление нового соединения — члена гомологического ряда. Поскольку гомологи имеют сходные свойства, то, зная поведение одного из них, можно в общих чертах охарактеризовать свойства целого ряда. Например, по свойствам метанола можно описать свойства насыщенных одноатомных спиртов. Гомология также является одной из причин многообразия органических веществ.
' Приведите примеры и названия нескольких гомологов метана, уксусной кислоты.
Способность некоторых органических соединений к реакции полимеризации позволяет расширить число этих соединений, прежде всего получаемых синтетически.
Напишите уравнение реакции полимеризации этилена.
Названные признаки в совокупности обусловливают существование огромного количества органических соединений. Все элементы периодической системы не способны образовывать столько соединений, сколько их образует один элемент — углерод.
При всем многообразии органические вещества способны к взаимопревращениям: из менее сложных можно получить более сложные благодаря химическим реакциям, от соединений одного класса перейти к соединениям другого класса. Например, начертим путь превращения этана в сложный эфир:
Из этана дегидрированием получаем этилен.
Этилен гидратацией превращаем в этанол.
Этанол окисляем до уксусного альдегида и уксусной кислоты.
Из этанола и уксусной кислоты получаем этиловый эфир уксусной кислоты.
® Составьте уравнения упомянутых реакций.
В эту цепочку превращений можно включить и неорганические соединения (например, этан можно получить из простых веществ). Таким образом, органические вещества генетически связаны между собой и с неорганическими веществами.
Взаимосвязи и взаимопревращения органических веществ имеют огромное значение для практики. Они позволяют осуществлять синтезы, направленные на получение веществ с заданными свойствами. Так, из сравнительно простых по строению углеводородов можно синтезировать огромное количество сложных веществ, необходимых и полезных человеку.
Углеводороды составляют основу продуктов переработки нефти и природного газа, поэтому являются наиболее доступным химическим сырьем. Нефтехимическая промышленность обеспечивает производство огромного количества синтетических продуктов: каучуков, моющих средств, волокон, пластмасс, лекарств и др.
