
- •Методичні рекомендації та навчальні завдання
- •2. Основи технічної термодинаміки
- •3.Основи теплопередачі.
- •4. Котельні установки і теплогенератори.
- •5. Застосування теплоти в сільському господарстві.
- •Загальні вказівки
- •1.Основи гідравліки та насоси.
- •. Основи гідростатики. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Питання для самоперевірки
- •1.2. Основи гідродинаміки. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Приклад 1
- •Питання та завдання для самоперевірки
- •. Насоси. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Будова і схема відцентрового насоса:
- •Будова і схема поршневого насоса:
- •Приклад 3
- •Питання для самоперевірки
- •2. Основи технічної термодинаміки.
- •Питання для самоперевірки
- •2.2. Суміш ідеальних газів. Теплоємність газів і газових сумішей. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •2.3. Перший закон термодинаміки.
- •Прочитайте
- •Теоретичні відомості
- •2.5. Ідеальні цикли поршневих двигунів внутрішнього згорання.
- •Прочитайте
- •Теоретичні відомості
- •Питання для самоперевірки
- •2.6 Водяна пара і вологе повітря. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Питання та завдання для самоперевірки
- •3.Основи теплопередачі.
- •3.1 Основні поняття і визначення. Теплопровідність. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Приклад 5
- •Питання для самоперевірки
- •.Конвективний теплообмін. Променистий теплообмін. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Теплопередача і теплообмінні апарати.
- •4. Котельні установки і теплогенератори
- •Процес горіння палива і способи спалювання
- •Питання для самоперевірки
- •4.3. Котельні установки Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Запитання для самоперевірки
- •4.4.Котли і теплогенератори. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Питання для самоперевірки
- •Застосування теплоти у сільському господарстві
- •5.1.Енергозберігання в сільському господарстві. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Питання для самоперевірки
- •5.2. Сушіння сільськогосподарської продукції Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Приклад 6
- •5.3. Опалення і гаряче водопостачання
- •Питання для самоперевірки
- •5.4. Вентиляція тваринницьких ферм Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Питання для самоперевірки
- •Питання для самоперевірки
- •5.6. Застосування холоду в сільському господарстві. Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Питання для самоперевірки
- •5.7. Теплотехнічні основи зберігання сільськогосподарської продукції Програмні питання
- •Прочитайте
- •Теоретичні відомості
- •Питання для самоперевірки
- •Методичні вказівки до виконання контрольної роботи
- •Задачі та питання контрольної роботи
- •Література:
Питання для самоперевірки
Що вивчає термодинаміка? Яке значення технічної термодинаміки в розв’язання практичних задач?
Назвати і охарактеризувати основні параметри робочого тіла?
Що таке ідеальний газ і для чого ввели таке поняття?
Написати рівняння сиану ідеального газу і вказати фізичну суть кожної величини, що входить у рівняння.
Що таке термодинамічна система?
2.2. Суміш ідеальних газів. Теплоємність газів і газових сумішей. Програмні питання
Поняття про газову суміш. Закон Дальтона. Склад суміші в об’ємних і масових частках, за числом молей. Уявна молярна маса ы газова стала газової суміші.
Поняття про теплоємність. Масова, об’ємна і молярна теплоємності, залежність між ними. Теплоємність при сталому об’ємі та тиску. Залежність теплоємності від температури і від атомності газів. Формули і таблиці для визначення теплоємності газів. Теплоємність газової суміші.
Прочитайте
Л-1, ст.. 85-91; Л -2, 8-10, 15-17; Л-3, ст..93-96,101-105.
Теоретичні відомості
Під час спалювання палива в циліндрах теплових двигунів і в топках котельних установок утворюються так звані продукти згоряння, які є не одним однорідним газом, а сумішшю річних газів: вуглекислого газу (СО2), водяної пари (Н2О), кисню (О2) і азоту (N2). Якщо паливо згорятиме в умовах нестачі повітря, в продуктах згоряння буде багато водню (Н2), окису вуглецю (СО) та інших продуктів неповного згоряння. Отже, в теплотехнічних розрахунках доводиться мати справу з сумішами різних газів і визначати для таких сумішей всі характерні величини (параметри, газову сталу тощо).
Сумішшю називають сукупність окремих газів, які хімічно не взаємодіють між собою. Окремі гази, що входять до складу суміші, називають компонентами. Домовимося величини, що стосуються компонентів, позначати індексами 1, 2, . ,n або загальним індексом к , а величини, що стосуються суміші - без індексів.
![]() ( 2.1
)
( 2.1
)
де р - тиск суміші газів;
р1, р2, ..., рn - парціальні тиски, тобто тиски окремих компонентів при умові, що кожний із них сам займає об'єм суміші V при температурі суміші Т.
Рівняння (2.1) виражає закон Дальтона, який полягає в тому, що тиск суміші газів дорівнює сумі парціальних тисків її компонентів.
Закон Дальтона згідно з прийнятими нами позначеннями можна записати ще й так:
![]() ( 2.2 )
( 2.2 )
Склад суміші газів може бути заданий масовими або об'ємними частками. Нехай М[кг] маси суміші складається з М1, М2, ...., Мn [кг] маси окремих компонентів. Очевидно, що маса суміші дорівнює сумі мас компонентів, тобто
М = М1 + М2 + . . . + Мn, або, в загальному вигляді,
![]() (2.3)
(2.3)
Відношення маси
кожного компонента до маси суміші,
тобто![]() ,
,
![]() ,…,
,…,
![]() називаються масовими частками.
Загальний вигляд масової частки
компонента такий:
називаються масовими частками.
Загальний вигляд масової частки
компонента такий:
![]() (2.4)
(2.4)
Якщо V [м3] суміші складається з V1, V2, ....,Vn [м3] парціальних об'ємів компонентів, відношення
![]() ,
,
![]() ,
… ,
,
… ,
![]()
називаються об'ємними частками. Загальний вигляд об'ємної частки компонента такий:
![]() (2.5)
(2.5)
Газова стала суміші дорівнює сумі добутків масових часток на питомі газові сталі компонентів.
![]() (2.6)
(2.6)
Уявна молекулярна маса суміші:
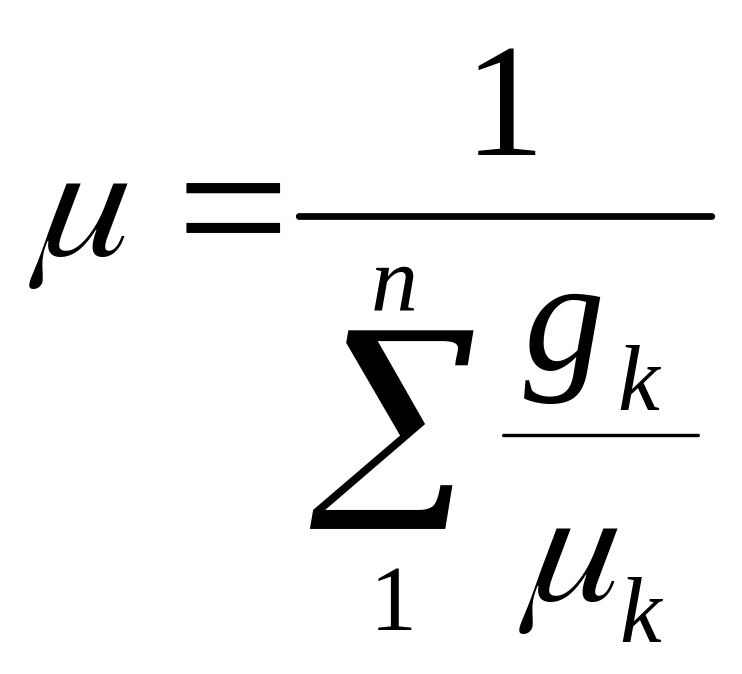 (2.7)
(2.7)
Питому газову сталу суміші:
 (2.8)
(2.8)
Теплоємністю називається кількість тепла, яку потрібно підвести до робочого тіла (при нагріванні) або відвести від робочого тіла (при охолодженні) для зміни температури одиниці кількості робочого тіла на один градус.
Залежно від того, що прийнято за одиницю кількості робочого тіла — одиниця маси (кг), одиниця об'єму (м3) чи кіломоль (кмоль) — розрізняють такі теплоємності:
масову
![]() [Дж/(кг
• К)],
[Дж/(кг
• К)],
об'ємну
![]() [Дж/(м3 • К)],
[Дж/(м3 • К)],
мольну
![]() [Дж/(кмоль • К].
[Дж/(кмоль • К].
У цих формулах q, q’, q’’ - тепло, затрачене на підвищення температури з t1 до t2 одиниці кількості газу відповідно 1 кг маси, 1 м3 за нормальних умов та 1 кмоля газу.Між теплоємностями існують такі співвідношення:
![]() ,
або
,
або
![]() (
2.9 )
(
2.9 )
де µ
![]() - об'єм 1 кмоль за нормальних умов;
- об'єм 1 кмоль за нормальних умов;
ρ0 - густина газу за нормальних умов.
(µ
-
за нормальних умов (об’єм 1 кмоль всіх
газів) = 22,4135 м![]() /кмоль).
/кмоль).
У газоподібних тіл на відміну від тіл рідких і твердих теплоємність значною мірою залежить від зовнішніх умов, за яких до тіла підводять чи відводять теплоту.
Теплоємність газів залежить від умов нагрівання чи охолодження або від процесу підведення чи відведення тепла: при сталому об'ємі чи при сталому тиску.
Нехай у циліндрі з нерухомим поршнем (мал.а) знаходиться 1 кг газу. Кількість тепла, затрачена для нагрівання цієї маси газу на один градус, визначатиме масову теплоємність при сталому об'ємі.
Я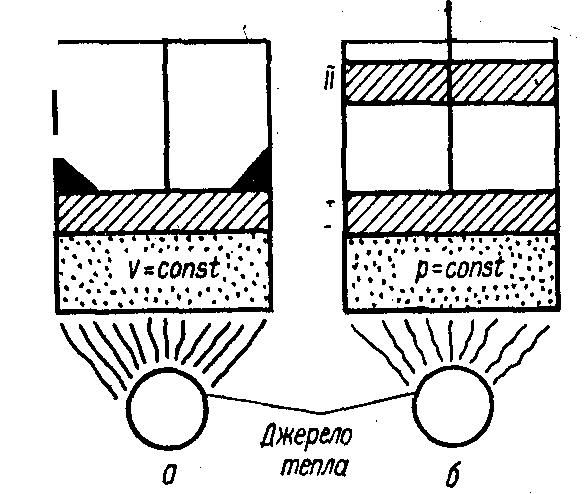 кщо
1 кг газу нагрівати на 1 градус в циліндрі
з рухомим поршнем (мал.
,б), затрачене при цьому тепло
визначатиме масову теплоємність
при сталому тиску.
кщо
1 кг газу нагрівати на 1 градус в циліндрі
з рухомим поршнем (мал.
,б), затрачене при цьому тепло
визначатиме масову теплоємність
при сталому тиску.
Оскільки в процесі нагрівання при сталому тиску тепло витрачається не тільки на підвищення температури (збільшення кінетичної енергії молекул), а й на виконання роботи l (переміщення поршня з положення І у положення ІІ), масова теплоємність ср при сталому тиску більша від масової теплоємності сv при сталому об'ємі на величину роботи l, яку виконує 1 кг газу при нагріванні його на один градус при сталому тиску. Отже, ср- сv=l
Оскільки ця робота характеризується питомою газовою сталою, тобто l = R, а тому
ср- сv = R [Дж/ (кг • К)] ( 2.10 )
Формула (25) виражає рівняння Майєра - одне з основних рівнянь теорії теплоємності.
Другим важливим співвідношенням у теорії теплоємності є відношення масової теплоємності при сталому тиску ср до масової теплоємності при сталому об'ємі сv
![]() (2.11)
(2.11)
За доведенням молекулярно-кінетичної теорії газів числове значення к залежить тільки від атомності газів: к = 1,67 —для одноатомних; к = 1,4 —для двоатомних і к =1,33 для три- і багатоатомних газів.
У теплотехнічних розрахунках доводиться визначати теплоємність газової суміші. Оскільки теплота, що йде на нагрівання 1 кг газової суміші, витрачається на нагрівання окремих компонентів, що є в суміші, то питома теплоємність суміші дорівнює сумі добутків питомих теплоємностей компонентів, з яких складається суміш, на їхні об’ємні частки.
Коли склад суміші заданий за масою газу, то питома теплоємність газової суміші визначається з рівності:
![]() ,
або
,
або
![]() (2.12)
(2.12)
де
![]() -
питома теплоємність компонента суміші;
-
питома теплоємність компонента суміші;
![]() -
масова частка компонента суміші.
-
масова частка компонента суміші.
Коли склад суміші заданий об’ємними частками , то об’ємну теплоємність суміші можна обчислити за формулою:
![]() (2.13)
(2.13)
де
![]() -
об’ємна частка компонента суміші.
-
об’ємна частка компонента суміші.
Питання для самоперевірки
Суміш яких газів можна вважати сумішшю ідеальних газів?
Закон Дальтона.
Чим може бути заданий склад газової суміші?
Що таке теплоємність і які є види теплоємності?
Як виражається теплоємність суміші газів через масову і обємну частки компонентів?
