
- •Затверджено на засіданні
- •Окисно – відновні реакції у розділі…….
- •Ступінь окиснення елементів
- •Поняття про окисно–відновні реакції
- •Вправи Метод електронного балансу
- •Окисні властивості кислот
- •Гальванічні елементи
- •Основні поняття
- •Механізм виникнення електродних потенціалів
- •Стандартний електродний потенціал і ряд напруги металів
- •Електроліз Загальні поняття про електроліз
- •Послідовність електродних процесів
- •Електроліз розчину Na2sо4 з інертним анодом
- •Електроліз розчину NiSo4 з нікелевим анодом
- •За певних умов на катоді відбувається здебільше розряд
- •3. Закони електролізу
- •4. Практичне застосування електролізу
- •Хімічні джерела струму
- •І. Гальванічні первинні елементи
- •Ртутно-цинкові елементи мають високу питому енергію та довго зберігаються в робочому стані. Напруга елемента 1,0 - 1,3 в, питома енергія 50 - 130 Вт∙год/кг.
- •Акумулятори
- •Свинцевий акумулятор
- •Залізо-нікелевий лужний акумулятор
- •Паливні елементи та електрохімічні генератори
- •Киснево-водневий паливний елемент
- •Електрохімічні генератори
- •Хімічна корозія Хімічна корозія – це процес руйнування металів в агресивних середовищах, що не проводять електричний струм, за рахунок хімічної взаємодії з оточуючим середовищем.
- •Корозія сталі у вологому повітрі
- •Види корозії в залежності від середовища
- •Фактори, що впливають на швидкість корозії
- •Методи захисту металу від корозії
- •Захисні покриття
- •Зміна складу металу
- •Зміна складу середовища
- •Електрохімічний захист
- •Катодний захист.
- •Загальні властивості металів Метали
- •Фізичні властивості металів
- •Хімічні властивості металів Відновна здатність
- •Реакція протікає з виділенням водню:
- •Форми знаходження металів у природі
- •Отримання металів
Механізм виникнення електродних потенціалів
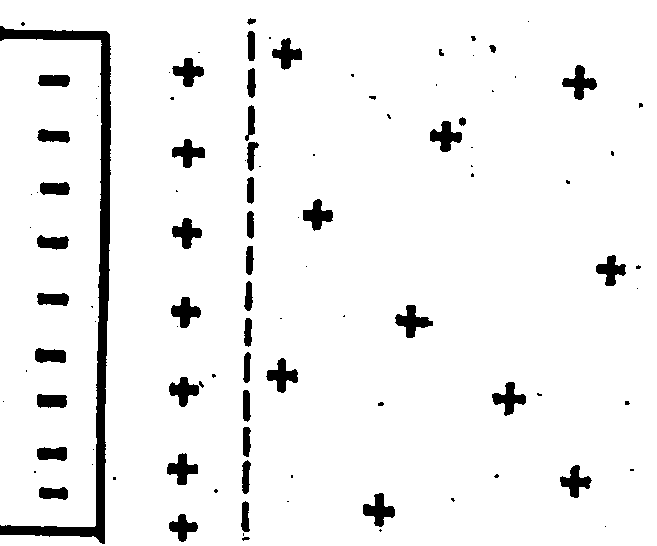
Якщо пластинку металу, наприклад цинку, занурити в чисту воду чи розведений розчин його солі, то іони Цинку, що знаходяться в поверхневому шарі пластинки, під дією полярних молекул води частково переходять у розчин, а вільні електрони, що знаходяться в ґратах металу залишаються на поверхні пластинки, заряджаючи її негативно. Пластинка при цьому стає негативним електродом.
 Метал
Розчин Метал Розчин
Метал
Розчин Метал Розчин
а б
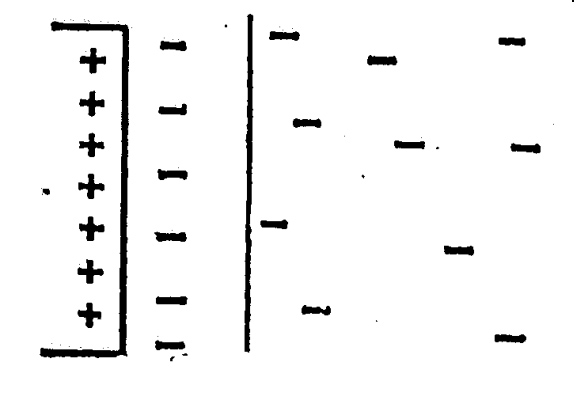
Рис.2 Схема виникнення подвійного електричного шару на межі розділу метал - розчин
Гідратовані іони Цинку електростатично притягуються до пластинки й утворюється подвійний електричний шар (рис.2а). Між цими двома зарядженими шарами існує різниця потенціалів чи, як часто говорять, скачок потенціалу, чи просто електродний потенціал.
Величина потенціалу залежить від природи металу, концентрації його іонів у розчині і природи розчинника. При великій концентрації іонів металу в розчині вони можуть переходити на металеву пластину, надбудовуючи кристалічну гратку металу. Для нейтралізації цих іонів вільних електронів не вистачає і металева пластинка одержує позитивний заряд. У цьому випадку аніони електроліту електростатично притягаються до пластинки, і також утворюється подвійний електричний шар із протилежним розподілом зарядів (рис.2б). Процес переходу іонів металу в розчин чи з розчину продовжується до того часу, доки встановиться стан рівноваги між металом і розчином його солі.
Таким чином, у загальному вигляді при зануренні металевого електрода в розчин, що містить однойменні з металом іони, на поверхні розподілу двох фаз завжди виникає потенціал. Цей потенціал виникає при взаємодії поверхневих атомів з полярними молекулами води. У результаті цієї взаємодії відбувається перехід гідратованих катіонів металу в розчин. Електрони, що залишаються на межі метал – розчин, установлюють динамічну рівновагу:
![]() ,
,
де n
– число електронів, що приймають участь
у електродному процесі. Між металом і
розчином утворюється подвійний
електричний
шар,
що характеризується певним стрибком
потенціалу – електродним
потенціалом
(![]() ).
Величина електродного потенціалу
залежить від природи і концентрації
іонів, що беруть участь в електродному
процесі, і температури. Ця залежність
виражається рівнянням
Нернста:
).
Величина електродного потенціалу
залежить від природи і концентрації
іонів, що беруть участь в електродному
процесі, і температури. Ця залежність
виражається рівнянням
Нернста:
![]() ,
,
де Men+ - концентрація іонів металу в розчині, моль/л;
![]() -
стандартний електродний потенціал, В.
-
стандартний електродний потенціал, В.
Концетрацію іонів у розчині можна визначити за формулою: Меn+ = CM · · k,
де СМ – молярна концентрація розчину електроліту, моль/л;
k – кількість іонів металу, що утворяться при дисоціації однієї молекули електроліту;
- ступінь електролітичної дисоціації електроліту.
Стандартний електродний потенціал і ряд напруги металів
Стандартним електродним потенціалом металу називається його електродний потенціал у розчині з концентрацією однойменних іонів, що дорівнює 1 моль/л.
З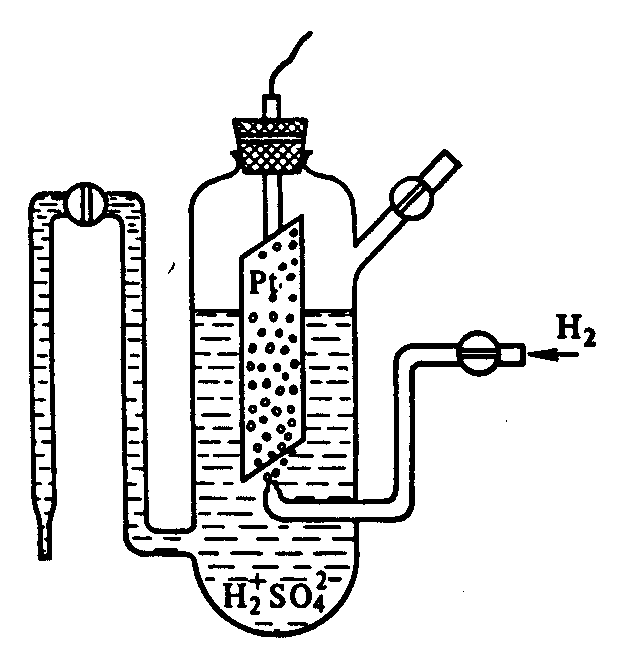 датність
кожного хімічного елемента піддаватися
в гальванічному елементі окисненню
чи, навпаки, відновленню може бути
встановлена експериментально за
допомогою водневого
електрода,
представленого на рис. 3
датність
кожного хімічного елемента піддаватися
в гальванічному елементі окисненню
чи, навпаки, відновленню може бути
встановлена експериментально за
допомогою водневого
електрода,
представленого на рис. 3
Рис.3 Схема водневого електрода
Гальванічний елемент завжди складається з двох напівелементів, один із яких – відновний, а другий окисний. Тому, якщо потрібно виміряти потенціал конкретного напівелемента, його з'єднують з іншим напівелементом, потенціал якого вже відомий. Тоді, вимірюючи потенціал повного електрохімічного елемента, можна обчислити потенціал досліджуваної напівреакції, що проходить на конкретному електроді. За умовний еталон прийнято стандартний водневий електрод. Так називається напівелемент, що складається з платинового електрода, покритого платиновою черню, що занурений у 1 молярний розчин Н+, насичений газоподібним Н2 при тиску 101.3 кПа і температурі 298 К.
У стандартному водневому напівелементі протікає реакція
![]() .
.
Оскільки електрохімічний потенціал цієї оборотної реакції залежить від концентрації катіонів і від температури, ясно, що стандартний елемент повинен діяти у строго визначених умовах. Стандартному водневому елементу умовно приписується потенціал 0,000 В.
Стандартні потенціали металів, розташовані в порядку зростання алгебраїчної величини, утворюють ряд напруг металів. Чим більш від’ємне значення стандартних потенціалів, тим більш відновна здатність металів (здатність віддавати електрони) і тим менша окиснювальна здатність їхніх іонів (здатність приєднувати електрони) у ході електродної реакції.
Потенціал водневого електрода:
![]() ,
,
де [ Н+] - концентрація іонів водню в розчині.
Окисно-відновний потенціал інертного електрода, на якому протікають різні окисно-відновні процеси, визначається наступним виразом:
![]() ,
,
де [Ox], [Red] - добуток концентрацій речовин, що беруть участь у процесі в окисній (Ох) і відновній (Red) формах.
