
- •Затверджено на засіданні
- •Окисно – відновні реакції у розділі…….
- •Ступінь окиснення елементів
- •Поняття про окисно–відновні реакції
- •Вправи Метод електронного балансу
- •Окисні властивості кислот
- •Гальванічні елементи
- •Основні поняття
- •Механізм виникнення електродних потенціалів
- •Стандартний електродний потенціал і ряд напруги металів
- •Електроліз Загальні поняття про електроліз
- •Послідовність електродних процесів
- •Електроліз розчину Na2sо4 з інертним анодом
- •Електроліз розчину NiSo4 з нікелевим анодом
- •За певних умов на катоді відбувається здебільше розряд
- •3. Закони електролізу
- •4. Практичне застосування електролізу
- •Хімічні джерела струму
- •І. Гальванічні первинні елементи
- •Ртутно-цинкові елементи мають високу питому енергію та довго зберігаються в робочому стані. Напруга елемента 1,0 - 1,3 в, питома енергія 50 - 130 Вт∙год/кг.
- •Акумулятори
- •Свинцевий акумулятор
- •Залізо-нікелевий лужний акумулятор
- •Паливні елементи та електрохімічні генератори
- •Киснево-водневий паливний елемент
- •Електрохімічні генератори
- •Хімічна корозія Хімічна корозія – це процес руйнування металів в агресивних середовищах, що не проводять електричний струм, за рахунок хімічної взаємодії з оточуючим середовищем.
- •Корозія сталі у вологому повітрі
- •Види корозії в залежності від середовища
- •Фактори, що впливають на швидкість корозії
- •Методи захисту металу від корозії
- •Захисні покриття
- •Зміна складу металу
- •Зміна складу середовища
- •Електрохімічний захист
- •Катодний захист.
- •Загальні властивості металів Метали
- •Фізичні властивості металів
- •Хімічні властивості металів Відновна здатність
- •Реакція протікає з виділенням водню:
- •Форми знаходження металів у природі
- •Отримання металів
Окисні властивості кислот
Усі кислоти (крім НNO3 і концентрованої Н2SО4) є окисниками за рахунок водневих іонів Н+, що утворюються при дисоціації у водних розчинах. Взаємодія цих кислот з відновниками супроводжується виділенням газоподібного водню:
Fе + 2НСІ = FеСІ2 + Н2 (13)
2 2![]() 1 –
окислення, відновник (Fe)
1 –
окислення, відновник (Fe)
![]() 1
–
відновлення, окисник (HCl).
1
–
відновлення, окисник (HCl).
З а
такою схемою протікають реакції проміж
вказаними кислотами і металами, що
знаходяться у ряду активності до
Гідрогену.
а
такою схемою протікають реакції проміж
вказаними кислотами і металами, що
знаходяться у ряду активності до
Гідрогену.
Аніони
нітратної і концентрованої сульфатної
кислот є більш сильними окисниками,
ніж іон
![]() .
Тому при їх взаємодії з металами або
неметалами водень не виділяється, а
утворюються речовини з меншим ступенем
окиснення: Нітрогену – від
.
Тому при їх взаємодії з металами або
неметалами водень не виділяється, а
утворюються речовини з меншим ступенем
окиснення: Нітрогену – від
![]() до
до
![]() ,
і Сульфуру – від
,
і Сульфуру – від
![]() до
до
![]() .
.
При взаємодії металів з нітратною кислотою утворюється сіль, вода і продукт відновлення Нітрогену , тип якого визначається активністю металу і концентрацією кислоти.
Усі метали, що знаходяться в ряду активності, умовно можна розбити на дві групи: від Літію до Феруму – активні метали, від Феруму (включно) і далі – малоактивні.
Активні
метали у залежності від концентрації
кислоти відновлюють нітроген
до
![]() ,
;
а
малоактивні – до
,
;
а
малоактивні – до
![]() ,
,
![]() .
.
 конц. MeNO3+H2O+
2O
(N2)
конц. MeNO3+H2O+
2O
(N2)
Me (акт.) + HNO3
розбав. MeNO3+H2O+ H4NO3
конц. MeNO3+H2O+ O2
Me (мало акт.) + HNO3
розбав. MeNO3+H2O+ O
Взаємодія активних металів з концентрованою сульфатною кислотою приводить до утворення H2S або S, а малоактивних – SO2.
 Ме акт.
MeSO4
+
H2SO4+H2
(S)
Ме акт.
MeSO4
+
H2SO4+H2
(S)
M e+
H2SO4
(конц)
e+
H2SO4
(конц)
Ме неакт.
MeSO4
+
H2O
+
![]() О2
О2
![]()
![]()
![]()
![]() Запитання
для самоперевірки
Запитання
для самоперевірки
Гальванічні елементи
Гальванічними елементами називаються пристрої, за допомогою яких хімічна енергія окисно–відновних реакцій, що відбуваються в них, перетворюється в електричну. Гальванічний елемент складається з двох електродів і іонного провідника між ними.
Гальванічний елемент служить джерелом електрохімічної енергії. Перш ніж перейти до розгляду гальванічних елементів, що мають практичне застосування, необхідно розібратися в електрохімічних принципах їхньої дії.
Основні поняття
Якщо занурити цинкову пластину в розчин купрум (ІІ) сульфату , то поверхня цинку покриється плівкою металевої міді. Це пояснюється окисно-відновною реакцією, що описується рівнянням:
![]()
У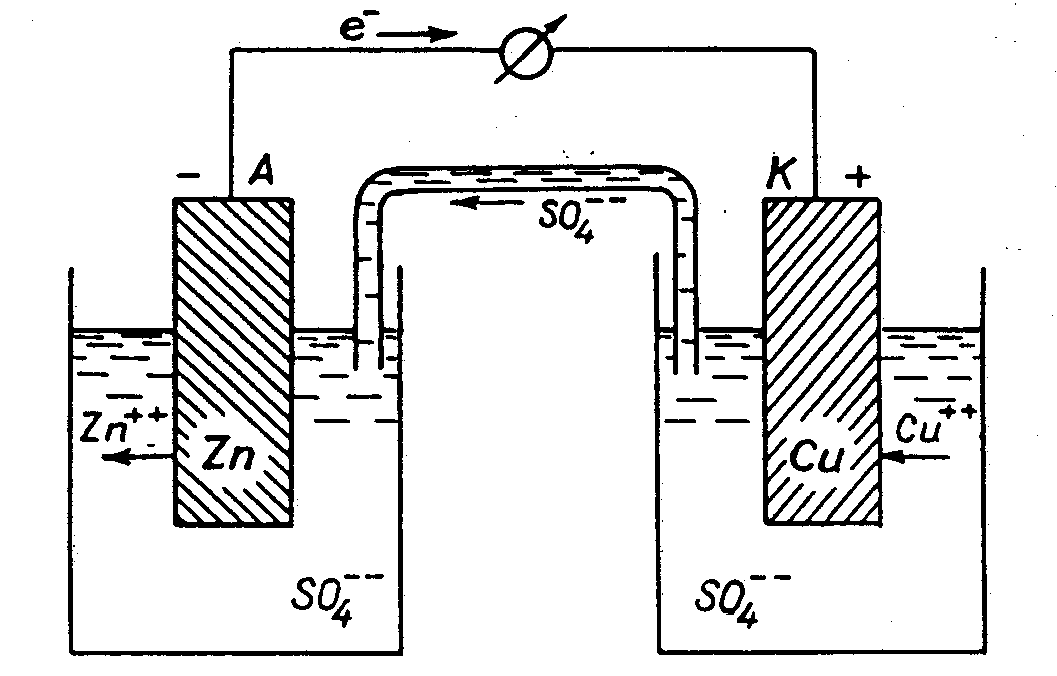 цій реакції відбувається перенос
електронів від Цинка до іонів Купруму,
інакше, окислення Цинка і відновлення
Купруму. Якщо тепер фізично розділити
ці
дві напівреакції,
зануривши цинкову пластину в розчин
цинк сульфату, а мідну пластину в розчин
купрум (ІІ) сульфату, і потім з'єднати
ці
два
напівелементи «соляним містком» і
правильно підібраними металевими
провідниками, ми одержимо
електрохімічний гальванічний елемент,
зображений
на рис.1.
цій реакції відбувається перенос
електронів від Цинка до іонів Купруму,
інакше, окислення Цинка і відновлення
Купруму. Якщо тепер фізично розділити
ці
дві напівреакції,
зануривши цинкову пластину в розчин
цинк сульфату, а мідну пластину в розчин
купрум (ІІ) сульфату, і потім з'єднати
ці
два
напівелементи «соляним містком» і
правильно підібраними металевими
провідниками, ми одержимо
електрохімічний гальванічний елемент,
зображений
на рис.1.
Рис. 1 Схема гальванічного елемента
У ньому як і раніше відбуваються окиснення і відновлення, однак, ці дві напівреакції фізично відділені одна від одної, так що електрони повинні протікати в зовнішньому ланцюзі, і це дозволяє вимірювати енергію переносу електронів від цинку до купруму. Соляний місток, що з'єднує два напівелементи, являє собою електричний провідник, по якому іони можуть переміщатися з одного напівелемента в інший, він складаєтся з скляної трубки, заповненої агар-агаром (рослинна желеподібна речовина), змішаним з KCl. Соляний місток створює контакт між двома розчинами. Металеві провідники, що з'єднують електроди з вольтметром, замикають електричний ланцюг.
Електрод, на якому відбувається реакція окислення, називається анодом:
A(-)
Zn0
– 2![]() = Zn2+
- реакція окислення,
= Zn2+
- реакція окислення,
а електрод, на якому відбувається реакція відновлення, є катодом:
K(+) Cu2+ + 2 = Cu0 - реакція відновлення.
Напруга елемента, вимірювана вольтметром, є мірою енергії, з якою відбуваються ці реакції при реально існуючих у розчині іонних концентраціях. Сумарна реакція, що характеризує роботу купрум-цинкового елемента може бути отримана шляхом алгебраїчного додавання двох реакцій, що протікають на електродах:
А (-)
Zn0
- 2
= Zn2+
K(+) Cu2+
+ 2
= Cu0
(-)
Zn0
- 2
= Zn2+
K(+) Cu2+
+ 2
= Cu0
Zn0+Cu2+ = Zn2++Cu0,
де Zn0 – відновник, а Cu2+ – окисник.
Молекулярне хімічне рівняння виглядає так:
Zn0 + CuSO4 ZnSO4 + Cu0.
Таким чином, у розглянутому гальванічному елементі використовується окисно-відновна реакція між цинком і купрумом.
Схема роботи гальванічного елемента
Для позначення гальванічних елементів часто використовується символічний запис, що надзвичайно спрощує їх опис. Наприклад, для позначення цинково-мідного елемента, зображеного на рис.1 використовується запис:
 A(-)
Zn0
ZnSO4
║ CuSO4
Cu0
К(+).
A(-)
Zn0
ZnSO4
║ CuSO4
Cu0
К(+).
Зміст такого запису, якщо читати його ліворуч праворуч, полягає в наступному: анод, тобто цинковий електрод, занурений у розчин, що містить іони двовалентного Цинка; соляний місток з'єднує перший напівелемент із розчином, утримуючим іони двовалентного Купруму; катод, що являє собою мідь, завершує цей гальванічний елемент. В зовнішньому ланцюзі електрони переміщаються від анода до катода.
Здатність кожного хімічного елемента піддаватися в гальванічному елементі окисненню чи навпаки, відновленню може бути встановлена за допомогою електродних потенціалів: катод, потенціал якого має більш високу алгебраїчну величину (більш додатне значення), є позитивним полюсом зовнішнього ланцюга гальванічного елемента, а анод – електрод з меншою величиною цього потенціалу (більш від`ємним значенням) – негативним полюсом. Визначаємо анод і катод, позначаємо перехід електронів.
Перед початком роботи гальванічного елемента в обох розчинах кількість катіонів строго відповідає кількості аніонів. При роботі гальванічного елемента в розчин ZnSO4 безупинно надходять катіони Zn2+, внаслідок чого аніонів недостатньо для утворення молекулярної речовини, а з розчину CuSO4 катіони Cu2+ постійно відновлюються на мідному катоді, і тому утворюється надлишок аніонів, які рухаються по сольовому містку або електрохімічному ключу з розчину CuSO4 до розчину ZnSO4. Таким чином, утворюється іонний струм.
При замиканні провідником двох електродів між двома металами виникає потенціал, названий контактним.
Електрорушійна сила такого елемента (ЕРС) дорівнює різниці потенціалів електродів, причому від більш позитивного потенціалу віднімають більш негативний. Таким чином, ЕРС елемента – це різниця потенціалів електродів:
ЕРС = к - а,
де к – рівноважний електродний потенціал катода, а – рівноважний електродний потенціал анода. Одиниця виміру ЕРС -вольти (В).
