
- •Затверджено на засіданні
- •Окисно – відновні реакції у розділі…….
- •Ступінь окиснення елементів
- •Поняття про окисно–відновні реакції
- •Вправи Метод електронного балансу
- •Окисні властивості кислот
- •Гальванічні елементи
- •Основні поняття
- •Механізм виникнення електродних потенціалів
- •Стандартний електродний потенціал і ряд напруги металів
- •Електроліз Загальні поняття про електроліз
- •Послідовність електродних процесів
- •Електроліз розчину Na2sо4 з інертним анодом
- •Електроліз розчину NiSo4 з нікелевим анодом
- •За певних умов на катоді відбувається здебільше розряд
- •3. Закони електролізу
- •4. Практичне застосування електролізу
- •Хімічні джерела струму
- •І. Гальванічні первинні елементи
- •Ртутно-цинкові елементи мають високу питому енергію та довго зберігаються в робочому стані. Напруга елемента 1,0 - 1,3 в, питома енергія 50 - 130 Вт∙год/кг.
- •Акумулятори
- •Свинцевий акумулятор
- •Залізо-нікелевий лужний акумулятор
- •Паливні елементи та електрохімічні генератори
- •Киснево-водневий паливний елемент
- •Електрохімічні генератори
- •Хімічна корозія Хімічна корозія – це процес руйнування металів в агресивних середовищах, що не проводять електричний струм, за рахунок хімічної взаємодії з оточуючим середовищем.
- •Корозія сталі у вологому повітрі
- •Види корозії в залежності від середовища
- •Фактори, що впливають на швидкість корозії
- •Методи захисту металу від корозії
- •Захисні покриття
- •Зміна складу металу
- •Зміна складу середовища
- •Електрохімічний захист
- •Катодний захист.
- •Загальні властивості металів Метали
- •Фізичні властивості металів
- •Хімічні властивості металів Відновна здатність
- •Реакція протікає з виділенням водню:
- •Форми знаходження металів у природі
- •Отримання металів
Зміна складу металу
Зміну складу металу з метою запобігання від корозії можна здійснювати в трьох напрямках:
- очищення металу;
- антикорозійні добавки.
Наприклад, індій додають в невеликій кількості в сплави кольорових металів. При цьому підвищується корозійна стійкість металу; талій в сплавах оберігає метал від корозії в кислому середовищі.
- створення сплавів, стійких до корозії (нержавіюча сталь – 12% Cr, 8% Ni).
Зміна складу середовища
До змін середовища відносять:
- видалення з розчинів шкідливих домішок;
- регулювання рН;
- використання інгібіторів корозії.
Інгібітори – це речовини, що уповільнюють швидкість корозії.
Анодні інгібітори – це речовини, що пасивують анод (створюють оксидні плівки на аноді).
Катодні інгібітори – це сполуки, що адсорбуються на поверхні катоду і уповільнюють процес деполяризації.
Екрануючі інгібітори – такі , що збираються навколо поверхні металу і уповільнюють процеси на електродах.
Летючі інгібітори використовуються для перевозення металевих конструкцій, ними заповнюється простір контейнера, і корозія металу йде повільніше.
Електрохімічний захист
Існують протекторний і катодний електрохімічні захисти, які застосовуються тільки в середовищах, що добре проводять електричний струм.
Протекторний захист.
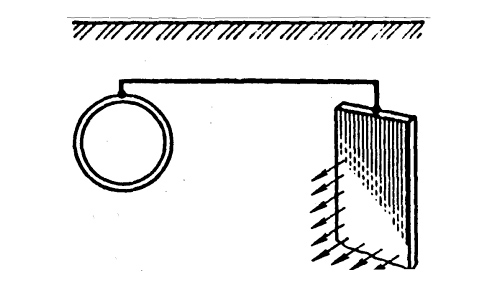
До металоконструкції на певній відстані приєднують частки більш активного металу в те ж середовище (Zn, Mg) (рис. 8 ).
A(-) Zn Н2О, O2 Fe K(+)
A(-) Zn – 2ē = Zn2+
K(+) 2H 2O + O2 + 4ē = 4OH-
Труба Zn
Рис.8 Протекторний захист металу
Розчиняється більш активний метал - протектор, на поверхні основного металу відбувається процес деполяризації. Термін роботи протектору в грунті до 10 років. Радіус дії протекторного захисту до 50 метрів.
Катодний захист.
Д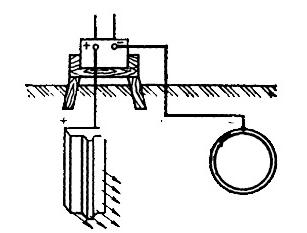 ля
нього використовуються джерела
постійного струму. Постійний струм
підводять до металевої конструкції
(труба) так, щоб вона була катодом, до
аноду приєднується рельс (рис.9).
Відбувається процес електролізу з
розчинним анодом. Руйнується
металобрухт, але конструкція не страждає
від корозії. Радіус катодного захисту
до 2 км.
ля
нього використовуються джерела
постійного струму. Постійний струм
підводять до металевої конструкції
(труба) так, щоб вона була катодом, до
аноду приєднується рельс (рис.9).
Відбувається процес електролізу з
розчинним анодом. Руйнується
металобрухт, але конструкція не страждає
від корозії. Радіус катодного захисту
до 2 км.
Труба Рельс
Рис. 9 Катодний захист металу
Загальні властивості металів Метали
Характерною ознакою металів є здатність їх атомів утворювати позитивні іони, і тому з елементами, що мають високу електронегативність, вони утворюють солі.
Метали складають 75% від усіх відомих хімічних елементів. Метали утворюють різноманітні хімічні сполуки. Більшість неорганічних сполук - це сполуки металів.
З металів починаються усі періоди (окрім першого). Чим вищий номер періоду, тим більше у ньому металів. Класифікація відбувається за групами періодичної системи: лужні метали, лужноземельні і т. д.
У промисловості зберігся розподіл на чорні і кольорові метали. До чорних металів належать залізо та його сплави і метали, які застосовуються головним чином у цих сплавах (Мn , Сг). До кольорових належать мідь і її сплави, платина, золото, титанові метали та ін.
Рідкіcні - це ті, які мало поширені у природі (побічна підгрупа III групи, лантаніди).
