
- •Затверджено на засіданні
- •Окисно – відновні реакції у розділі…….
- •Ступінь окиснення елементів
- •Поняття про окисно–відновні реакції
- •Вправи Метод електронного балансу
- •Окисні властивості кислот
- •Гальванічні елементи
- •Основні поняття
- •Механізм виникнення електродних потенціалів
- •Стандартний електродний потенціал і ряд напруги металів
- •Електроліз Загальні поняття про електроліз
- •Послідовність електродних процесів
- •Електроліз розчину Na2sо4 з інертним анодом
- •Електроліз розчину NiSo4 з нікелевим анодом
- •За певних умов на катоді відбувається здебільше розряд
- •3. Закони електролізу
- •4. Практичне застосування електролізу
- •Хімічні джерела струму
- •І. Гальванічні первинні елементи
- •Ртутно-цинкові елементи мають високу питому енергію та довго зберігаються в робочому стані. Напруга елемента 1,0 - 1,3 в, питома енергія 50 - 130 Вт∙год/кг.
- •Акумулятори
- •Свинцевий акумулятор
- •Залізо-нікелевий лужний акумулятор
- •Паливні елементи та електрохімічні генератори
- •Киснево-водневий паливний елемент
- •Електрохімічні генератори
- •Хімічна корозія Хімічна корозія – це процес руйнування металів в агресивних середовищах, що не проводять електричний струм, за рахунок хімічної взаємодії з оточуючим середовищем.
- •Корозія сталі у вологому повітрі
- •Види корозії в залежності від середовища
- •Фактори, що впливають на швидкість корозії
- •Методи захисту металу від корозії
- •Захисні покриття
- •Зміна складу металу
- •Зміна складу середовища
- •Електрохімічний захист
- •Катодний захист.
- •Загальні властивості металів Метали
- •Фізичні властивості металів
- •Хімічні властивості металів Відновна здатність
- •Реакція протікає з виділенням водню:
- •Форми знаходження металів у природі
- •Отримання металів
Методи захисту металу від корозії
Для захисту металу від корозії застосовується багато різних методів, але немає єдиної класифікації, тому використовуємо одну з найбільш зручних, в якій всі методи поділені на чотири групи:
- захисні покриття;
- зміна складу металу;
- зміна складу середовища;
- електрохімічний захист.
Захисні покриття
Всі захисні покриття поділяють на три типи: неметалеві, металеві та хімічні.
Неметалеві покриття – це покриття, які наносяться лаком, полімерними плівками, асфальтом, гумою та ін.
Металеві покриття – це шар стійкого до корозії металу, який знаходиться на поверхні основного металу і захищає його від корозії.
Способи нанесення захисного металу на поверхню основного :
- гальванопокриття (наносять за допомогою електролізу);
- розпилення розплавленого захисного металу по поверхні основного;
- занурювання основного металу в розплавлений захисний метал;
- сукупний прокат двох металів.
Всі металеві покриття поділяють на два тип
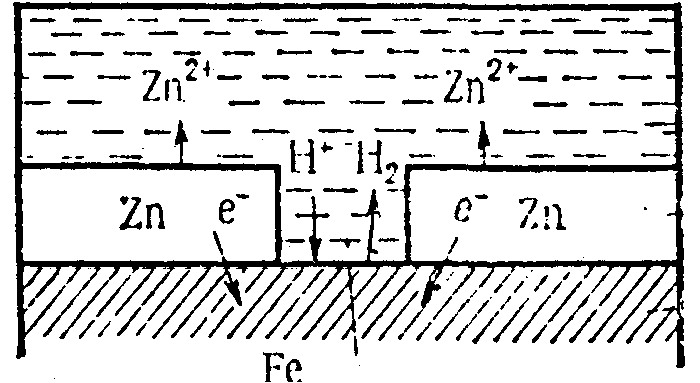
1) анодні покриття (рис. 6) :
 A(-) Zn
H 2O,
O2
Fe
K(+),
A(-) Zn
H 2O,
O2
Fe
K(+),
A(-) Zn –2ē = Zn2+ - корозія
К(+) деполяризація.
Рис. 6 Анодне покриття
2
Sn
Sn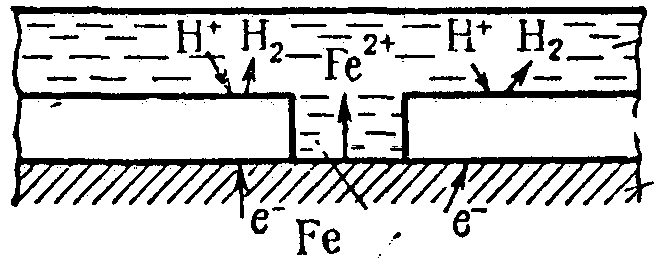
K(+) Sn H 2O, O2 Fe A(-),
A(-) Fe – 2ē = Fe2+ - корозія
K(+) деполяризація
Рис. 7 Катодне покриття
Анодні покриття на відміну від катодних після появи тріщин продовжують захищати метал від корозії.
Хімічні покриття – це покриття, що утворюються на поверхні металу при обробці поверхні різними хімічними реагентами. Це процеси:
- фосфатування;
- оксидування;
- борування;
- азотування та ін.
Наприклад, при фосфатуванні поверхню металу обробляють сумішшю мажеф (Mn(H2PO4)2, Fe(H2PO4)2) . При взаємодії цієї суміші з поверхнею утворюється густа міцна плівка сполуки фосфору, яка надійно захищає метал від корозії.
При оксидуванні на поверхні металу також утворюється міцна плівка оксиду, яка виконує захисну функцію.
