
- •Затверджено на засіданні
- •Окисно – відновні реакції у розділі…….
- •Ступінь окиснення елементів
- •Поняття про окисно–відновні реакції
- •Вправи Метод електронного балансу
- •Окисні властивості кислот
- •Гальванічні елементи
- •Основні поняття
- •Механізм виникнення електродних потенціалів
- •Стандартний електродний потенціал і ряд напруги металів
- •Електроліз Загальні поняття про електроліз
- •Послідовність електродних процесів
- •Електроліз розчину Na2sо4 з інертним анодом
- •Електроліз розчину NiSo4 з нікелевим анодом
- •За певних умов на катоді відбувається здебільше розряд
- •3. Закони електролізу
- •4. Практичне застосування електролізу
- •Хімічні джерела струму
- •І. Гальванічні первинні елементи
- •Ртутно-цинкові елементи мають високу питому енергію та довго зберігаються в робочому стані. Напруга елемента 1,0 - 1,3 в, питома енергія 50 - 130 Вт∙год/кг.
- •Акумулятори
- •Свинцевий акумулятор
- •Залізо-нікелевий лужний акумулятор
- •Паливні елементи та електрохімічні генератори
- •Киснево-водневий паливний елемент
- •Електрохімічні генератори
- •Хімічна корозія Хімічна корозія – це процес руйнування металів в агресивних середовищах, що не проводять електричний струм, за рахунок хімічної взаємодії з оточуючим середовищем.
- •Корозія сталі у вологому повітрі
- •Види корозії в залежності від середовища
- •Фактори, що впливають на швидкість корозії
- •Методи захисту металу від корозії
- •Захисні покриття
- •Зміна складу металу
- •Зміна складу середовища
- •Електрохімічний захист
- •Катодний захист.
- •Загальні властивості металів Метали
- •Фізичні властивості металів
- •Хімічні властивості металів Відновна здатність
- •Реакція протікає з виділенням водню:
- •Форми знаходження металів у природі
- •Отримання металів
Корозія сталі у вологому повітрі
В сталі вуглець знаходиться або в елементарному вигляді, або у вигляді карбіду Fe3C (цементіт).
На поверхні сталі спостерігається велика кількість точок (місцин), в яких залізо знаходиться в контакті з кристалами цементіту. В кожній такій точці виникає мікрогальванічний елемент
A(-) Fe H 2O, O2 Fe3C K(+),
 A(-) Fe0
– 2ē = Fe2+
2 корозія
A(-) Fe0
– 2ē = Fe2+
2 корозія
K(+) O2 + 4ē + 2H2O = 4OH- 1 киснева деполяризація,

2 Fe + O2 + 2 H2O = 2Fe2+ + 4OH-,
2 Fe + O2 + 2 H2O = 2Fe(OH)2.
На повітрі відбувається подальше окиснювання:
4Fe(OH)2 + O2 + 2H 2O = 4Fe(OH)3
Продукт корозії сталі – іржа, вона являє собою суміш гідроксидів:
mFeO ∙ nFe 2O3 ∙ pH2O – формула іржі.
m, n, p – вар’їрують в широких межах в залежності від умов корозії.
Види корозії в залежності від середовища
В залежності від характеру навколишнього середовища розрізняють три види корозії: атмосферну, ґрунтову ,корозію в розчинах електролітів.
Атмосферна корозія – це корозія у вологому повітрі або вологих газах. На поверхні металу за рахунок адсорбції водяної пари утворюється плівка вологи. Інтенсивність корозії залежить від товщини цієї плівки та наявності у повітрі таких речовин як CO2, SO2, H2S та ін.
Ґрунтова корозія – це корозія металевих конструкцій, що знаходяться в грунті. Ця корозія залежить від структури грунту, яка обумовлює інтенсивність надходження О2 до металу. Крім того, при ґрунтовій корозії потрібно враховувати вплив мікроорганізмів (деякі з них спричиняють корозію дуже інтенсивно).
До корозії в розчинах електролітів належить корозія в прісній та морській воді. Поряд з загальними факторами впливу на корозію велике значення має повнота та періодичність занурення металевих конструкцій в розчини електролітів.

 Форми
корозійного ушкодження металів
Форми
корозійного ушкодження металів
 а)
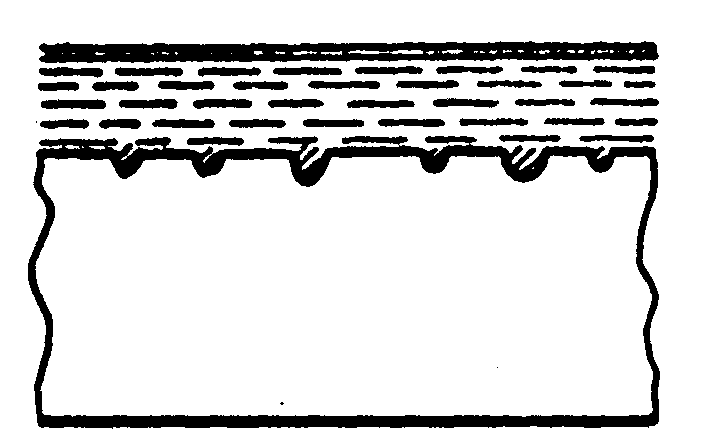
рівномірна б)
точечна
а)
рівномірна б)
точечна
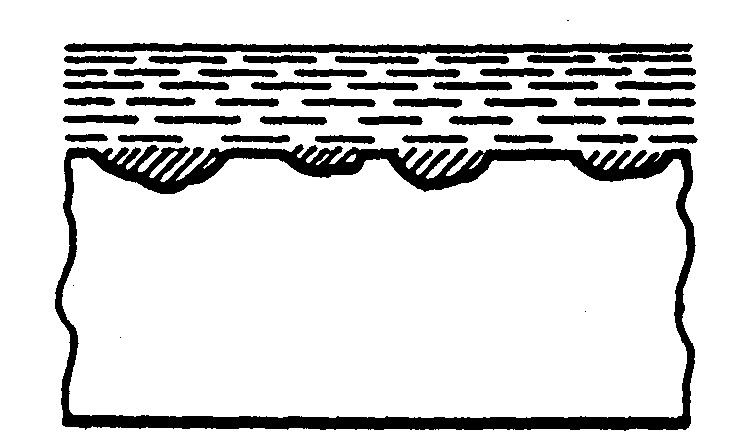
в) плямова г) піттінг
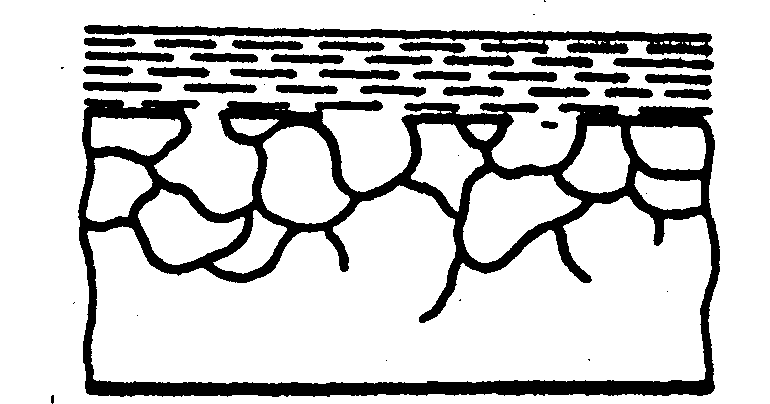
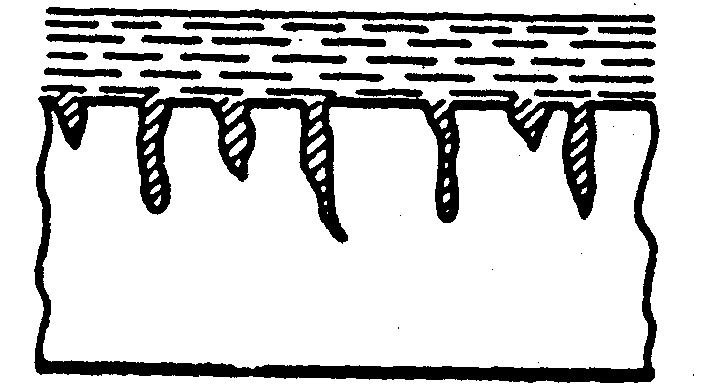
д) міжкристалітна ж) селективна
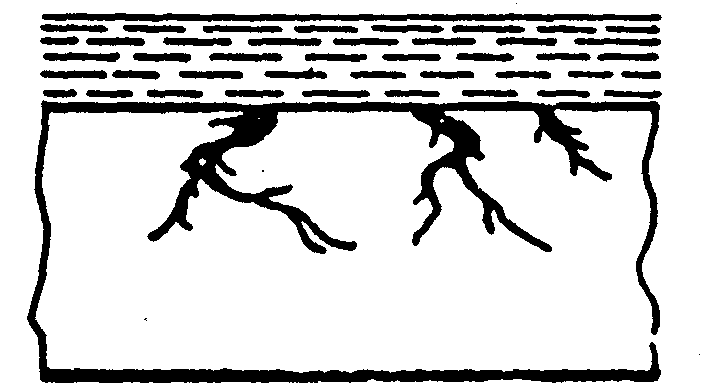
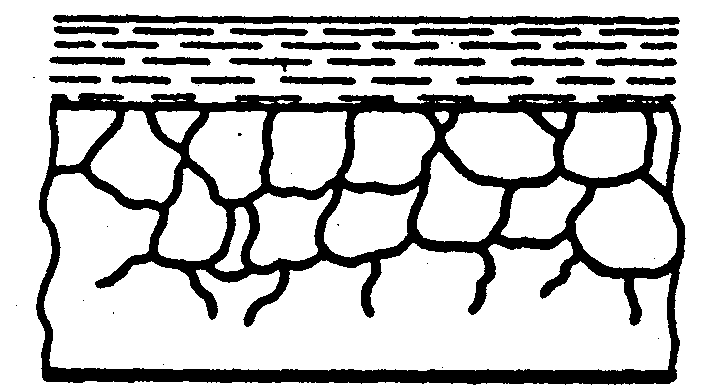
з) розтріскуюча
Рис.5 Форми корозійного ушкодження металів
При рівномірній корозії та корозії точками і плямами (рис.5а,б,в) руйнування металу йде на поверхні, при цьому механічні властивості металевих конструкцій значно не порушуються.
Чотири останні види корозії (рис.5 г, д, ж, з) небезпечні порушенням механічних характеристик (міцності, гнучкості і т.д.), так як корозія йде в усьому об’ємі.
