
- •Затверджено на засіданні
- •Окисно – відновні реакції у розділі…….
- •Ступінь окиснення елементів
- •Поняття про окисно–відновні реакції
- •Вправи Метод електронного балансу
- •Окисні властивості кислот
- •Гальванічні елементи
- •Основні поняття
- •Механізм виникнення електродних потенціалів
- •Стандартний електродний потенціал і ряд напруги металів
- •Електроліз Загальні поняття про електроліз
- •Послідовність електродних процесів
- •Електроліз розчину Na2sо4 з інертним анодом
- •Електроліз розчину NiSo4 з нікелевим анодом
- •За певних умов на катоді відбувається здебільше розряд
- •3. Закони електролізу
- •4. Практичне застосування електролізу
- •Хімічні джерела струму
- •І. Гальванічні первинні елементи
- •Ртутно-цинкові елементи мають високу питому енергію та довго зберігаються в робочому стані. Напруга елемента 1,0 - 1,3 в, питома енергія 50 - 130 Вт∙год/кг.
- •Акумулятори
- •Свинцевий акумулятор
- •Залізо-нікелевий лужний акумулятор
- •Паливні елементи та електрохімічні генератори
- •Киснево-водневий паливний елемент
- •Електрохімічні генератори
- •Хімічна корозія Хімічна корозія – це процес руйнування металів в агресивних середовищах, що не проводять електричний струм, за рахунок хімічної взаємодії з оточуючим середовищем.
- •Корозія сталі у вологому повітрі
- •Види корозії в залежності від середовища
- •Фактори, що впливають на швидкість корозії
- •Методи захисту металу від корозії
- •Захисні покриття
- •Зміна складу металу
- •Зміна складу середовища
- •Електрохімічний захист
- •Катодний захист.
- •Загальні властивості металів Метали
- •Фізичні властивості металів
- •Хімічні властивості металів Відновна здатність
- •Реакція протікає з виділенням водню:
- •Форми знаходження металів у природі
- •Отримання металів
Електрохімічні генератори
Система, що складається з батареї паливних елементів, устроїв для підводу палива й окисника, виводу продуктів реакції, підтримання і регулювання температури, називається електрохімічним генератором.
Потужність сучасних електрохімічних генераторів досягає
1000 кВт, питома енергія, що залежить від виду й кількості палива в ємності для зберігання – (400 – 800) Вт·год/кг, а ККД – ( 60 -70 )%.
Найбільш розроблені киснево-водневі генератори, які вже застосовуються на космічних кораблях. Вони забезпечують космічний корабель і космонавтів не тільки електроенергією, а й водою, яка є продуктом реакції в паливному елементі.
КОРОЗІЯ МЕТАЛІВ
Руйнування металів під впливом хімічної та електрохімічної дії навколишнього середовища називається корозією (від лат. corrosio – роз’їдання). Внаслідок корозії метал переходить в окиснений стан, і витрачає характерні для нього механічні властивості. Корозія – це хімічний окисно-відновний процес.
В залежності від механізму процесу корозію поділяють на хімічну та електрохімічну.
Хімічна корозія Хімічна корозія – це процес руйнування металів в агресивних середовищах, що не проводять електричний струм, за рахунок хімічної взаємодії з оточуючим середовищем.
Наприклад, внаслідок дії водяної пари на залізо при високих температурах відбувається його хімічна корозія:
3Fe + 4H2O = 4H2 + Fe3O4,

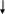 -
2ē
-
2ē
2 Fe ∙ Fe + 4 H2O = 4 H2 + Fe2O3 ∙ FeO.

 -
2 ∙ 3ē
-
2 ∙ 3ē
Хімічну корозію поділяють на газову та рідинну. Газова корозія – процес окиснення металів сухими газами (SO2, Cl2, NхOу, O2, N2, CO2 та ін.):
- 4ē


 2
Zn + O2
2 ZnO,
2
Zn + O2
2 ZnO,
- 6ē
6 Li + N2 2 Li3N,
 -
2ē
-
2ē
 Fe
+ CO2
+ H 2O
FeCO3
+ H2.
Fe
+ CO2
+ H 2O
FeCO3
+ H2.
Особливо швидко розвивається корозія під дією таких газів як флуор та хлор:
 -
6 ē
-
6 ē
2 Fe + 3 Cl2 2 FeCl3.
Плівки оксидів та інших сполук, що утворюються при корозії, захищають метал від подальшого руйнування.
Рідинна корозія – руйнування металу в розчинах неелектролітів, наприклад, корозія свинцю в бензині, цинку в хлороформі та ін.
Електрохімічна корозія
Електрохімічна корозія виникає в середовищах, що мають іонну проводимість: вологі гази, вологе повітря, вологий грунт, розчини електролітів.
Всі метали, що застосовуються в техніці, мають домішки інших металів. Це означає, що на поверхні металу є ділянки, де стикаються кристали двох різних металів, при цьому утворюються мікрогальванічні елементи, які називаються корозійними елементами:
Me1 /середовище/ Me2,
![]() <
<
![]() .
.
На аноді корозійного елемента завжди відбувається процес розчинення Me1, більш активного ніж Me2 :
A(-) Me1 – nē = Me1n+.
Н а
катоді корозійного елемента завжди
відбувається процес деполяризації.
а
катоді корозійного елемента завжди
відбувається процес деполяризації.
Рис. 4 Схема корозійного елемента
На рис. 4 показано схему корозійного елемента:
A(-) Ni | H2SO4 | Cu K (+),
A(-) Ni –2ē = Ni2+.
Нікель посилає електрони міді. Анод (Ni) заряджується позитивно, катод (Cu) – негативно, відбувається поляризація корозійного елемента, і якщо не буде ніяких часток, які поглинають електрони, то негативний заряд, який накопичується на міді, заважатиме подальшому переходу електронів і корозійний елемент перестане діяти. Але, якщо в середовищі є частки, здатні поглинати електрони, корозійний елемент продовжує працювати, відбувається його деполяризація.
Катіони H+ підходять до негативно зарядженого катоду і відновлюються, відбувається процес водневої деполяризації за схемою:
K(+) 2H+ + 2ē = H2.
В реальних умовах деполяризація буває водневою, кисневою або окисною.
Киснева деполяризація відбувається за схемою:
K(+) O2 + 4ē + 2Н 2O = 4OH-.
Воднева деполяризація, як правило, проходить в кислому середовищі, а киснева – в нейтральному та лужному.
Таким чином, при електрохімічній корозії анодний процес – корозія більш активного металу, а катодний – деполяризація.
