
- •Содержание
- •1. Природные ресурсы − топливо и минеральное сырье Республики Беларусь.
- •1.1. Природные ресурсы.
- •1.2. Энергетические ресурсы Республики Беларусь.
- •1.3. Минеральные ресурсы Республики Беларусь.
- •2. Общие принципы энергосберегающих технологий.
- •2.1. Экономия энергоресурсов
- •2.2. Энергетический баланс технологических процессов.
- •3. Эксергетический метод термодинамического анализа.
- •3.1. Роль окружающей среды в промышленных энергетических процессах.
- •3.2. Понятие и свойства эксергии.
- •Уравнение Гюи-Стодолы.
- •3.4. Степень термодинамического совершенства технических процессов.
- •4. Расчёт эксергии физических и химических процессов.
- •4.1. Основное уравнение для расчета термомеханической эксергии. Изменение термомеханической эксергии в процессе
- •Термомеханическая эксергия идеального газа .
- •Доказательство “ бесполезности “ работы проталкивания против внешнего атмосферного давления на примере расширения
- •Уравнение для расчета термомеханической эксергии идеального газа на основе различных процессов.
- •С учетом уравнений Пуассона
- •Суммарная полезная работа
- •Примеры расчета термомеханической эксергии.
- •4.6 Учет фазовых переходов при расчете эксергии.
- •4.7 Расчет концентрационной эксергии.
- •Эксергетический анализ процессов теплообмена
- •Термическая эксергия каждого потока
- •Схемы рекуперации.
- •Рекуперация тепла.
- •3 Pinch - точка
- •5. Химическая эксергия веществ
- •5.1. Принципы расчета химической эксергии.
- •5.2. Модели окружающей среды
- •5.2.1. Модель окружающей среды № 1 Шаргута.
- •5.2.2. Модель окружающей среды Арендтса.
- •5.2.3. Модель окружающей среды Степанова.
- •5.2.4. Модель окружающей среды № 2 Шаргута.
- •5.2.5. Модель окружающей среды Бродянского.
- •5.3. Проблемы выбора параметров окружающей среды, методов расчета химических эксергий.
- •. Принципы построения термохимической модели окружающей среды.
- •Параметры стандартной термохимической модели окружающей среды.
- •5.6. Схема девальвации веществ состава СaHbOcNdSe.
- •5.7. Термодинамические свойства веществ отсчета в термохимической модели окружающей среды.
- •750,45 КДж/моль.
- •6. Аддитивные расчеты химических эксергий органических веществ.
- •6.1. Аддитивные расчеты химической эксергии углеводородов при
- •6.1.1. Алканы
- •6.1.2. Алкилпроизводные циклопентана и циклогексана
- •6.1.3. Алкилпроизводные бензола
- •6.2. Аддитивные расчеты химических эксергий углеводородов в широком интервале температур
- •6.2.1. Химические эксергии углеводородов в состоянии идеального газа в интервале 298,15-1000 к
- •Продолжение таблицы 6.1
- •6.2.2. Химические эксергии жидких углеводородов.
- •7. Расчет химических эксергий смесей.
- •7.1. Расчет химической эксергии смеси в приближении идеального раствора.
- •7.2. Расчет химической эксергии смеси по экспериментальным данным.
- •8. Расчет химической эксергии топлив.
- •Окончательно можно записать
- •9. Термодинамический анализ химических процессов.
- •9.1. Основные положения эксергетического анализа химико- технологических процессов.
- •4´ Рецикл
- •9.2. Взаимосвязь потерь эксергии.
- •9.3. Эксергетический анализ химических производств.
- •9.3.1. Краткое описание технологического процесса стадии оксимирования
- •9.3.2. Исходные данные для проведения эксергетического анализа
- •9.3.3. Расчет эксергетических кпд и эксергетических потерь
- •9.3.4. Кривая регенерации тепла
- •9.3.5. Сравнительный эксергетический анализ некоторых способов получения циклогексаноноксима
- •10. Пример эксергетического расчета для выполнения индивидуального задания.
- •10.2. Расчет мольного содержания компонентов в равновесной смеси при 535 к потока №6 после дегидрирования .
- •10.3 Расчет массы воды, необходимой для нагрева в узле т601
- •10.4. Расчет массы и состава потока №14
- •10.5. Расчет эксергии c6h11oh и c6h10o при температуре 298,15 к с использованием термохимической модели ос.
- •10.6. Расчет эксергии потоков Расчет эксергии потока №1
- •Расчет эксергии потока №2
- •Расчет эксергии потока №3
- •Расчет эксергии потока №5
- •Расчет эксергии потока №6
- •Расчет эксергии потока №15
- •Расчет эксергии потока №16
- •Расчет эксергетических кпд по стадиям
- •Литература
- •Термодинамические свойства циклогексанола при 298.15 к
- •Термодинамические свойства циклогексанона при 298.15 к
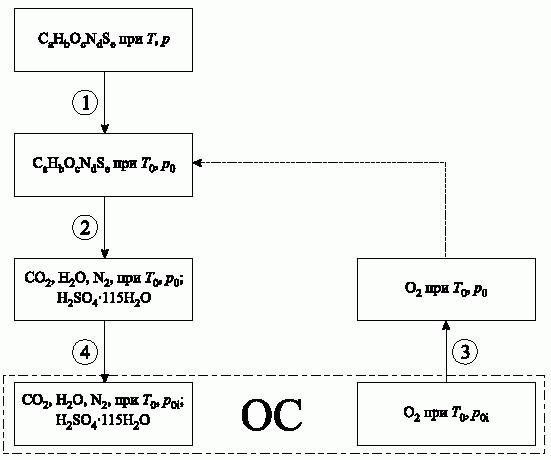
5.6. Схема девальвации веществ состава СaHbOcNdSe.
Обобщенное уравнение девальвации веществ состава СаНbOcNdSe имеет вид:
Схема девальвации представлена на рисунке 5.3, а расчетные соотношения для соответствующих процессов приведены ниже.
1. Расчет термической эксергии вещества
 (51)
(51)
где Т0 = 298,15 К, Ср теплоемкость СaHbOcNdSe.
2. Расчет эксергии девальвации.
 (5
2)
(5
2)
Расчет концентрационной эксергии дополнительных веществ отсчета
![]() (5
3)
(5
3)
Расчет концентрационной эксергии результирующих веществ отсчета

 (54)
(54)
Рис.5.3. Схема девальвации веществ состава СаНbOcNdSe
Так
как величины
,![]() относятся к давлению
относятся к давлению
![]() ,
то суммарное выражение эксергии вещества
СаНbOcNdSe
,
то суммарное выражение эксергии вещества
СаНbOcNdSe
![]()
5.7. Термодинамические свойства веществ отсчета в термохимической модели окружающей среды.
Кроме
термодинамических свойств веществ для
расчета химических эксергий необходимы
термодинамические данные для веществ
отсчета: энтальпия образования
![]() .
В таблице 5.8 представлены термодинамические
характеристики веществ отсчета взятые
из [27],
где приведены рекомендованные к
использованию в термохимических расчетах
значения термодинамических свойств
базовых веществ, а также термодинамические
свойства водного раствора Н2SO4115Н2О.
Энтальпия образования Н2SO4115Н2О
взята из рекомендованных значений [13],
а энтропия оценена по данным [28]. Для
этого энтропия растворов Н2SO4nН2О,
где n
2,3,4,6.5 экстраполировалась на n
= 115в виде полинома
.
В таблице 5.8 представлены термодинамические
характеристики веществ отсчета взятые
из [27],
где приведены рекомендованные к
использованию в термохимических расчетах
значения термодинамических свойств
базовых веществ, а также термодинамические
свойства водного раствора Н2SO4115Н2О.
Энтальпия образования Н2SO4115Н2О
взята из рекомендованных значений [13],
а энтропия оценена по данным [28]. Для
этого энтропия растворов Н2SO4nН2О,
где n
2,3,4,6.5 экстраполировалась на n
= 115в виде полинома
![]()
Найденное значение А составило 134,981,67.
Таблица 5.8: Термодинамические свойства веществ отсчета.
Вещество отсчета |
|
|
кДж моль-1 |
Дж моль-1К-1 |
|
О2 |
0 |
205,037 |
N2 |
0 |
191,502 |
CO2 |
-393,51 |
213,677 |
H2O |
-285,830 |
69,950 |
Н2SO4115Н2О |
-887,811 |
8179,23 |
Пример 3. Рассчитать химическую эксергию жидкого гексана при
р = 101325 Па и Т= 300 К, используя стандартную термохимическую модель ОС ( Т0=298,15 К и р0= 101325 Па ). Термодинамические свойства жидкого гексана приведены в таблицах П.1.2 и П.1.4.
Эксергия системы рассчитывается как сумма эксергий отдельных необратимых процессов при приведении системы в равновесие с окружающей средой
![]() .
.
Для расчета термомеханической эксергии воспользуемся формулой (7). В результате получим : E0T(T) = 1,123 Дж/моль.
Эксергию химической девальвации рассчитаем по формуле (8), учитывая, что реакция девальвации для гексана имеет вид
С6Н14(ж) + 19/2 О2(г) 6 СО2(г) + 7 Н2О(ж)
Получим следующие значения : Edev = 4022432,664 Дж/моль.
Концентрационную эксергию для кислорода рассчитаем по формуле
(9 ), а для углекислого газа по формуле (10). В результате получим :
EC (О2) = 37562,274 Дж/моль,
EC (СО2) = 119981,542 Дж/ моль.
В итоге
получим :
![]() (Т)
= 4245,6 кДж/моль.
(Т)
= 4245,6 кДж/моль.
Пример 4. Рассчитать химическую эксергию октана в состоянии идеального газа при р=101325 Па и а) Т=230К; б) Т= 1000 К, используя термохимическую модель ОС ( Т0=298,15 К и р0= 101325 Па ).
Термодинамические свойства октана приведены в таблицах П.1.2 и П.1.3, а термодинамические свойства веществ отсчета в таблицах 7 и 10.
Химическая эксергия октана рассчитывается аналогично, как и в примере 3, по формуле
![]() .
.
Термомеханическая эксергия октана, рассчитанная по формуле (7), будет равна а) E0T (T) = 1457,75 Дж/моль
б) E0T (T) = 148124,44 Дж/моль.
Для расчета эксергии девальвации воспользуемся формулой (8), учитывая , что реакция девальвации для октана имеет вид
С8Н18(г) + 25/2 О2(г) 8СО2(г) + 9 Н2О(ж)
В результате получим: Edev = 5305651,87 Дж/моль
Концентрационная эксергия для кислорода, рассчитанная по формуле (9), будет равна
EC (О2) = 49424,05 Дж/моль ,
а концентрационная эксергия для углекислого газа (формула 10 )
EC (СО2) = 159975,39 Дж/моль
В
результате получим: а)
![]() =
5417,66 кДж/моль,
=
5417,66 кДж/моль,
б) = 5564,33 кДж/моль.
Пример 5. Рассчитать химическую эксергию 2,2,4,триметилпентана в состоянии идеального газа при р= 101325 Па и Т= 1000 К, используя термохимическую модель ОС. Термодинамические свойства 2,2,4,триметилпентана приведены в таблицах П.1.3, П.1.4, а веществ отсчета в таблицах 7,10.
Для расчета химической эксергии 2,2,4 триметилпентана в термохимической модели ОС воспользуемся формулами (7) (10).
Термомеханическая эксергия равна :
E0T(T) = 157035,84 Дж/моль.
Эксергия девальвации:
Edev = 5305651,87 Дж/моль ,
учитывая, что реакция девальвации имеет вид
С8Н18(г) + 25/2 О2(г) 8СО2(г) + 9 Н2О(ж)
Концентрационные эксергии кислорода и углекислого газа равны соответственно EC (О2) = 49424,05 Дж/моль
EC (СО2)= 159975,39 Дж/моль
Таким образом, химическая эксергия 2,2,4 триметилпентана будет равна
= 5573,24 кДж/моль.
Пример 6. Рассчитать химическую эксергию жидкого акрилонитрила
( СН2= СН2CN ), используя модель ОС №1 Шаргута (Т0= 293,15 К и
р0 = 101325 Па). ( С3Н3N(ж) ) = 147,13 кДж/моль,
![]() 178,91 Дж/мольК [29].
178,91 Дж/мольК [29].
На основании уравнения реакции девальвации акрилонитрила
С3Н3N(ж) + 3,75 О2(г) = 3 CO2 + 1,5 Н2О(г) + 0,5 N2(г)
с учетом термодинамических свойств веществ (таблица П.1.1), участвующих в реакции, определим энтальпию и энтропию девальвации при Т= 298,15 К и р= 101325 Па:

 Для
пересчета значений
Для
пересчета значений
![]() и
и
![]() к температуре 293,15 К необходимо знать
изменение теплоемкости
к температуре 293,15 К необходимо знать
изменение теплоемкости
![]() в результате реакции девальвации:
в результате реакции девальвации:

Далее находим величины энтальпий и энтропий девальвации при температуре 293,15 К:

![]()
Полагаем, чтов узком температурном интервале 293,15 298,15 К величина
![]() остается постоянной. В итоге получим
остается постоянной. В итоге получим
![]()
Химическая эксергия жидкого акрилонитрила равна
![]()
При расчете химической эксергии жидкого акрилонитрила необходимо учесть работу обратимого изотермического расширения 3 моль СО2, 1,5 моль водяного пара и 0,5 моль азота от стандартного давления р0= 101325 Па до соответствующегопарциального давления газов в атмосфере при Т=293,15 К и относительной влажности воздуха 100%: Р(СО2) =31,67 Па;
Р (Н2О)= 2337 Па и Р(N2)=77300 Па.
Кроме этого, необходимо учесть работу обратимого изотермического сжатия 3,75 моль кислорода от парциального давления кислорода во влажном воздухе Р(О2) = 20738 Па до стандартного давления Р0=101325 Па.
Таким образом, химическая эксергия жидкого акрилонитрила при
Т= 293,15 К равна

Пример 7. Рассчитать химическую эксергию газообразного диоксида серы
SO2 при Т= 293,15 К и р= 101325 Па, используя модель ОС №1 Шаргута
(Т0 = 293,15 К; р0 = 101325 Па). Необходимые для расчета термодинамические свойства веществ в таблице П.1.1
Расчет химической эксергии диоксида серы проводится как и в примере 6.
Уравнение реакции девальвации для SO2(г) запишется в виде:
SO2(г) + 0,5 О2(г) + СаСО3(кр.) + 2 Н2О(г) = СаSО4·2 Н2О(кр.) + СО2(г)
В качестве веществ отсчета для серы и кальция брать гипс СаSО4·2 Н2О(кр.) и кальцит СаСО3(кр.) соответственно.
На основании термодинамических функций для всех участников реакции находим:
![]() 872,15 кДж/моль
872,15 кДж/моль
![]() 413,02 Дж/моль·К
413,02 Дж/моль·К
![]() 27,76 Дж/моль·К
27,76 Дж/моль·К
![]() 872,29 кДж/моль
872,29 кДж/моль
![]() 413,49 Дж/моль·К
413,49 Дж/моль·К
![]() 751,08 кДж/моль
751,08 кДж/моль
С учетом работы обратимого изотермического расширения одного моля СО2(г), работы сжатия 0,5 моль О2(г) и 2 моль Н2О(г), получим следующую величину для химической эксергии газообразного диоксида серы:
