
- •Введение Основные принципы лабораторно-практических занятий по дисциплине
- •I. Химическая термодинамика Теоретические основы раздела
- •Лабораторные работы Лабораторная работа №1 Определение теплового эффекта реакции нейтрализации
- •Лабораторная работа № 2 Определение константы равновесия реакции йода с йодидом калия
- •Программы для самостоятельной работы
- •II. Кинетика химических реакций Теоретические основы раздела
- •Лабораторные работы Лабораторная работа № 3 Определение порядка реакции омыления этилацетата щелочью
- •Лабораторная работа № 4 Определение порядка реакции окисления тиосульфат-аниона
- •3. Методика эксперимента
- •Программы для самостоятельной работы
- •III. Свойства растворов Теоретические основы раздела и типовые расчеты
- •Лабораторные работы Лабораторная работа № 5 Определение степени и константы диссоциации уксусной кислоты
- •Лабораторная работ № 6 Определение изотонического коэффициента эбуллиоскопическим методом
- •Программы для самостоятельной работы
- •IV. Электрохимические процессы Теоретические основы раздела
- •Многовариантная задача
- •V. Поверхностные явления Теоретические основы раздела
- •Лабораторные работы
- •Лабораторная работа № 7 Адсорбция уксусной кислоты почвой
- •Лабораторная работа № 8 Ионно-обменная адсорбция в системе «почва – раствор электролита»
- •Программы для самостоятельной работы
- •VI. Коллоидное состояние вещества Теоретические основы раздела
- •Лабораторные работы Лабораторная работа № 9 Получение и свойства коллоидных растворов
- •Лабораторная работа № 10 Коагуляция коллоидных систем
- •Лабораторная работа № 11 Влияние среды на набухание желатина
- •Лабораторная работа № 12 Влияние кислоты, щелочи и солей на набухание желатина
- •Задания для самостоятельной работы
- •Приложение
- •Библиографический список
- •Оглавление
II. Кинетика химических реакций Теоретические основы раздела
Кинетикой химических реакций называется учение о механизме и скорости химических реакций. Наиболее важными факторами, влияющими на скорость реакции, являются концентрация реагирующих веществ, температура и наличие катализаторов.
Основным законом химической кинетики является закон действующих масс. Для химической реакции:
аА + вВ → продукты,
уравнение скорости реакции можно представить выражением:
V = k ∙ СаА ∙СbВ , (2.1)
где СА и СВ – молярные концентрации веществ А и В;
k – константа скорости реакции;
а и b – порядки реакции по веществам А и В.
Различают реакции нулевого, первого, второго, третьего и дробного порядков. Самыми распространенными являются реакции первого и второго порядков.
Реакция первого порядка
Для реакции А → Р имеем:
![]() или
или
![]() (2.2)
(2.2)

![]()
![]()
или
![]() .
(2.3)
.
(2.3)
Это выражение называется кинетическим уравнением реакции 1-го порядка. Таким образом, если реакция имеет первый порядок, график зависимости «ln С – время» должен иметь вид прямой линии.
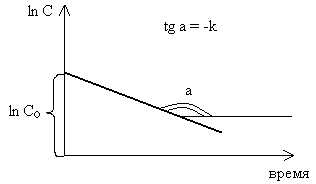
Для характеристики реакции первого порядка часто пользуются величиной, называемой периодом полупревращения или полураспада и обозначаемой τ1/2. Принимая С = 0,5Со, из кинетического уравнения реакции первого порядка получим:
τ1/2
=
![]() .
(2.4)
.
(2.4)
Типовые расчеты
Пример 1
Активность атомов полония за 7 дней уменьшается на 3,425%. Определить константу распада и период полураспада, считая реакцию распада реакцией 1-го порядка.
Решение
Для реакции первого
порядка τ1/2
=
![]() .
.
![]() дней.
дней.
Реакция второго порядка
Для реакции А + В → Р, где [А] = [В], имеем:
![]() .
(2.5)
.
(2.5)
Решение этого уравнения приводит к зависимости:
![]() ,
(2.6)
,
(2.6)
где С – текущая концентрация вещества А;
Со – исходная концентрация вещества А;
t – время реакции.
Решая уравнение относительно константы скорости, получаем:
![]() .
(2.8)
.
(2.8)
Графически данное уравнение решается в координатах «1/С – время».
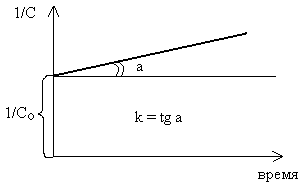
Если отнести уравнение (2.8) к моменту τ1/2 , когда израсходована половина взятого количества одного из исходных веществ, то получим:
![]() или
или
![]() ,
(2.9)
,
(2.9)
т.е. в реакциях второго порядка период полупревращения зависит от начальной концентрации реагирующих веществ.
Типовые расчеты
Пример 2
Реакция второго порядка за 500 секунд проходит на 20%. За какое время она пройдет на 60%?
Решение.
Так как константа скорости реакции второго порядка подчиняется уравнению (2.8), то для различных значений начальной и конечной концентраций имеем:
![]() .
.
Принимая С0 за 100%, С1 – за 80%, С2 – за 40%, имеем:
![]() ,
отсюда х = t2
= 3000 секунд.
,
отсюда х = t2
= 3000 секунд.
Зависимости скорости реакции от температуры
Общий характер зависимости скорости от температуры установил С. Аррениус в 1889 году:
![]()
![]() ,
(2.10)
,
(2.10)
где А – постоянная, характеризующая каждую реакцию;
Е – энергия активации;
R – универсальная газовая постоянная;
Т – абсолютная температура.
Если учесть взаимосвязь констант скорости при температурах Т1 и Т2, можно получить следующее уравнение:
![]() ,
(2.11)
,
(2.11)
![]() .
(2.12)
.
(2.12)
Типовые расчеты
Пример 3
Константы скорости реакции первого порядка при температурах 300 и 310 К равны соответственно 3,4 и 8,5 минут. Рассчитать энергию активации для данной реакции.
Решение.
Используя предыдущие соотношения, получаем:
 .
Подставляя данные примера, получаем:
.
Подставляя данные примера, получаем:
 =
2,3 ∙ 0,4 ∙ 8,31 ∙ 300 ∙ 31 = 71,1 кДж/моль.
=
2,3 ∙ 0,4 ∙ 8,31 ∙ 300 ∙ 31 = 71,1 кДж/моль.
