
- •Введение Основные принципы лабораторно-практических занятий по дисциплине
- •I. Химическая термодинамика Теоретические основы раздела
- •Лабораторные работы Лабораторная работа №1 Определение теплового эффекта реакции нейтрализации
- •Лабораторная работа № 2 Определение константы равновесия реакции йода с йодидом калия
- •Программы для самостоятельной работы
- •II. Кинетика химических реакций Теоретические основы раздела
- •Лабораторные работы Лабораторная работа № 3 Определение порядка реакции омыления этилацетата щелочью
- •Лабораторная работа № 4 Определение порядка реакции окисления тиосульфат-аниона
- •3. Методика эксперимента
- •Программы для самостоятельной работы
- •III. Свойства растворов Теоретические основы раздела и типовые расчеты
- •Лабораторные работы Лабораторная работа № 5 Определение степени и константы диссоциации уксусной кислоты
- •Лабораторная работ № 6 Определение изотонического коэффициента эбуллиоскопическим методом
- •Программы для самостоятельной работы
- •IV. Электрохимические процессы Теоретические основы раздела
- •Многовариантная задача
- •V. Поверхностные явления Теоретические основы раздела
- •Лабораторные работы
- •Лабораторная работа № 7 Адсорбция уксусной кислоты почвой
- •Лабораторная работа № 8 Ионно-обменная адсорбция в системе «почва – раствор электролита»
- •Программы для самостоятельной работы
- •VI. Коллоидное состояние вещества Теоретические основы раздела
- •Лабораторные работы Лабораторная работа № 9 Получение и свойства коллоидных растворов
- •Лабораторная работа № 10 Коагуляция коллоидных систем
- •Лабораторная работа № 11 Влияние среды на набухание желатина
- •Лабораторная работа № 12 Влияние кислоты, щелочи и солей на набухание желатина
- •Задания для самостоятельной работы
- •Приложение
- •Библиографический список
- •Оглавление
Многовариантная задача
Составить электрохимическую цепь из предложенных электродов и рассмотреть для стандартных условий его работу:
а) указать анод, катод и определить знаки электродов;
б) написать уравнения электродных процессов;
в) определить направление движения электронов во внешней цепи;
г) рассчитать ЭДС элемента;
д) рассчитать термодинамические характеристики реакции, протекающей в гальваническом элементе.
Вариант |
Электроды |
1 |
Mn2+ (a = 0,001) / Mn; Fe3+ (a = 1), Pt / Fe2+ (a = 0,2) |
2 |
Cr3+ (a = 0,5) / Cr; Pt, O2 / OHˉ (a = 0,1) |
3 |
Mg2+ (a = 0,1) / Mg; Pt, Cl2 / 2Clˉ (a = 0,01) |
4 |
Cu+ (a = 0,1) / Cu; Pt, F2 / 2Fˉ (a = 0,2) |
5 |
Pb2+ (a = 0,1) / Pb; 2H+ (a = 0,01) / H2, Pt |
6 |
Zn2+ (a = 0,02) / Zn; Cr2O72ˉ (a = 0,01), H+ (a = 0,1), Pt / Cr3+ (a = 0,01) |
7 |
Fe2+ (a = 1) / Fe; Ag+ (a = 0,02) / Ag |
8 |
S / S2ˉ (a = 0,01); Pt, F2 / 2Fˉ (a = 0,2) |
9 |
Cd2+ (a = 0,001) / Cd; Pt, Cl2 / 2Clˉ (a = 0,01) |
10 |
Se / Se2ˉ (a = 0,001); Mg2+ (a = 0,1) / Mg |
11 |
Cr3+ (a = 0,02) / Cr; Cu+ (a = 0,01) / Cu |
12 |
Ag+ (a = 0,001) / Ag; Pt, F2 / 2Fˉ (a = 0,02) |
13 |
Cr2O72ˉ (a = 0,01), H+ (a = 0,1), Pt / Cr3+ (a = 0,01); Pt, O2 / OHˉ (a = 0,1) |
14 |
Mn2+ (a = 0,001) / Mn; Pt, Cl2 / 2Clˉ (a = 0,001) |
15 |
Tl2+ (a = 0,03) / Tl; Fe3+ (a = 0,01), Pt / Fe2+ (a = 0,2) |
V. Поверхностные явления Теоретические основы раздела
Известно, что любая поверхность обладает свободной поверхностной энергией G, величина которой определяется как произведение поверхностного натяжения σ на величину площади поверхности S:
G = σ S. (5.1)
Самопроизвольное изменение концентрации вещества на поверхности раздела фаз по сравнению с его концентрацией внутри фазы называют адсорбцией.
Количественно процесс мономолекулярной адсорбции на поверхности раствора может быть выражен уравнением Гиббса:
![]() ,
(5.2)
,
(5.2)
где Г – величина адсорбции, моль/м2;
с – концентрация вещества адсорбтива в растворе, моль/м3;
![]() -
поверхностная активность, характеризующая
изменение σ в зависимости от концентрации
при S
= const;
-
поверхностная активность, характеризующая
изменение σ в зависимости от концентрации
при S
= const;
Т – температура системы, К;
R – универсальная газовая постоянная. Дж/моль К.
На границе фаз «жидкость – твердое тело» или «газ – твердое вещество» применяют уравнение Лэнгмюра:
![]() или
или
![]() ,
(5.3)
,
(5.3)
где Г – удельная адсорбция;
Г∞ - предельная максимальная адсорбция;
С – концентрация адсорбтива;
Р – давление адсорбтива;
К – постоянная величина.
Уравнение Лэнгмюра может быть представлено в виде:
![]() (5.4)
(5.4)
или
![]() (5.5)
(5.5)
или
![]() ,
(5.6)
,
(5.6)
где V – объем адсорбированного газа;
Vm – объем адсорбированного газа, полностью покрывающего поверхность 1 г адсорбента (объемы V и Vm приведены к нормальным условиям).
Графическое изображение уравнения приведено на рисунке:
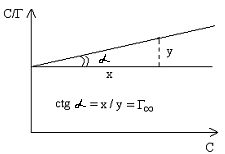
При известной величине Г∞ может быть вычислена площадь, занимаемая одной молекулой адсорбтива в состоянии насыщения:
![]() ,
м2/молекула
(5.7)
,
м2/молекула
(5.7)
Толщина адсорбированного слоя δ вычисляется по уравнению:
![]() ,
(5.8)
,
(5.8)
где М – молярная масса адсорбтива, г/моль;
d – плотность адсорбтива;
N0 – число Авогадро.
Площадь поверхности S 1 г адсорбтива равна:
![]() ,
(5.9)
,
(5.9)
где S - площадь одной молекулы адсорбтива на поверхности адсорбента.
При адсорбции на поверхности многих адсорбентов образуется полимолекулярный адсорбционный слой. Полимолекулярная адсорбция описывается теорией БЭТ, которая устанавливает зависимость между адсорбционной емкостью насыщенного монослоя аm, удельной адсорбцией а, равновесным давлением газа Р и величиной k – константой, зависящей от энергии взаимодействия молекул в адсорбционном слое.
Уравнение БЭТ в виде уравнения прямой линии имеет вид:
 ,
(5.10)
,
(5.10)
где PS – давление насыщенного пара.
Для определения
удельной поверхности адсорбента S
строят график зависимости:
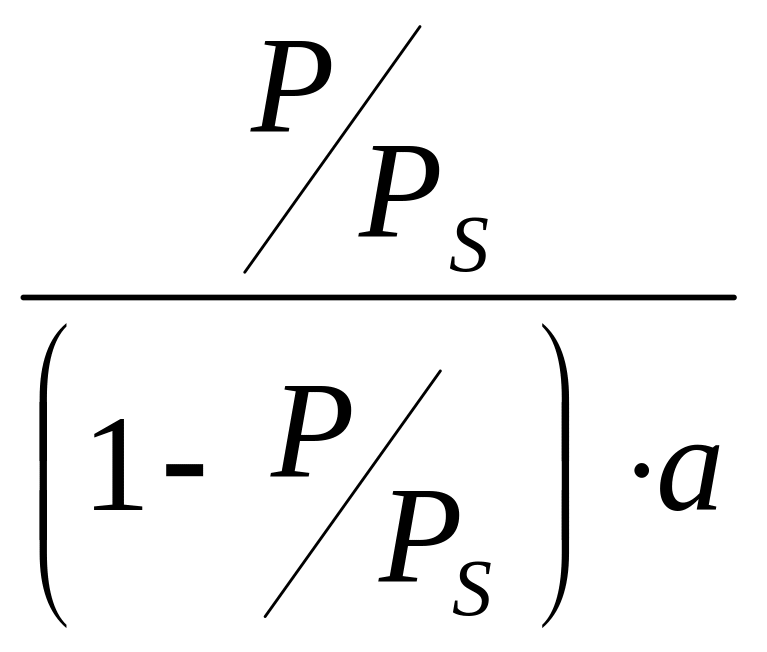 от
от
![]() .
.
По угловому коэффициенту прямой, равному (k – 1)(kam)-1, и величине отрезка, отсекаемого на оси ординат при = 0, равного (kam)-1 рассчитывается am. Удельная поверхность S вычисляется по формуле:
S = S0 ∙ am ∙ N0, (5.11)
где S0 – площадь, занимаемая одной молекулой газа в адсорбционном слое;
N0 – постоянная Авогадро.
На практике для вычисления величины адсорбции получило распространение также эмпирическое уравнение Фрейндлиха:
![]() ,
(5.12)
,
(5.12)
где Х – количество адсорбированного вещества, моль;
m – масса адсорбента, г;
С – равновесная концентрация;
К и n – эмпирические константы.
В логарифмическом виде уравнение Фрейндлиха представляет уравнение прямой:
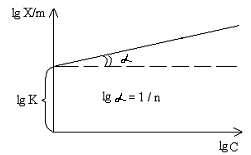
При графическом построении в осях координат «lg X/m – lg C» отрезок, отсекаемый прямой на оси ординат, дает значение lg K, а тангенс угла дает значение 1 / n, т.к. последний составляет угловой коэффициент в уравнении 5.13:
![]() .
(5.13)
.
(5.13)
Ионно-обменная адсорбция
На границе раздела водного раствора и твердого адсорбента практически всегда возникает двойной электрический слой, обусловленный диссоциацией на ионы как растворенных, так и адсорбированных веществ. Кроме того, у ряда адсорбентов существует способность избирательно адсорбировать из раствора ионы одного какого-либо вида.
Адсорбированные ионы на поверхности, находясь в динамическом равновесии с ионами раствора, обмениваются в строго эквивалентном количестве на ионы того же знака, присутствующие в растворе. Такую адсорбцию называют ионно-обменной адсорбцией.
Количественное соотношение между концентрациями обменивающихся ионов устанавливается уравнением Никольского:
 ,
(5.14)
,
(5.14)
где а1 и а2 – активности ионов в равновесном растворе;
х1 и х2 – равновесное количество ионов в твердой фазе;
z1 и z2 – заряды обменивающихся ионов;
К – константа ионного обмена.
Типовые расчеты
Пример 1
При адсорбции аргона коксовым углем при 194,7 К получены следующие результаты:
-
Р1, Па
31,9∙103
130,5∙103
290,0∙103
Р1, мм.рт.ст.
24,0
98,4
218,0
Г1, мг/г
5,0
15,4
24,0
Рассчитайте постоянные в уравнении Лэнгмюра.
Решение.
Согласно уравнению Лэнгмюра Г/Г∞ является угловым коэффициентом зависимости между Р/Г и Р, а lg 1/КГ∞ - отрезком, отсекаемым этой прямой на оси ординат.
Вычисляем величины Р/Г:
Р, Па |
31,9∙103 |
130,5∙103 |
290,0∙103 |
Р/Г |
6,4∙103 |
8,7∙103 |
12,1∙103 |
По полученным данным строим график, отложив по оси абсцисс Р, а по оси ординат – Р/Г:
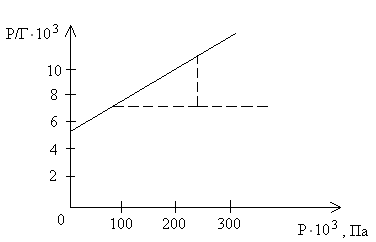
Как видно из графика:
1/Г∞ = (11 - 7) / (240 – 60) = 0,0222
Отсюда Г∞ = 45, 1/КГ∞ = 5,7∙103, тогда
К = 1 / 5,37 ∙ 45 = 0,004.
Пример 2
При исследовании поверхностной активности растворов уксусной кислоты при 200С были получены следующие результаты:
Концентрация кислоты, моль/л |
0,00 |
0,01 |
0,10 |
0,50 |
1,00 |
Поверхностное натяжение, дин/см |
73,26 |
70,02 |
66,88 |
61,66 |
57,28 |
Найти величины Г, δ и площади, занимаемой одной молекулой уксусной кислоты при разных концентрациях.
Решение.
Воспользуемся
уравнением Гиббса
![]() .
Находим средние значения Сср, ∆С, ∆σ
и ∆σ/∆С (см. таблицу).
.
Находим средние значения Сср, ∆С, ∆σ
и ∆σ/∆С (см. таблицу).
Сср |
∆С |
∆σ |
∆σ/∆С |
С1
=
|
0,01-0,00=0,01 |
70,02-73,26= -3,24 |
-3,24/0,01= -324 |
С2
=
|
0,1-0,01=0,09 |
66,88-70,02= -3,14 |
-3,14/0,09= -34,9 |
С3
=
|
0,5-0,1=0,04 |
61,16-66,88= -5,22 |
-5,22-0,4= -13,05 |
С4
=
|
1,0-0,5=0,5 |
57,28-61,66= -4,38 |
-4,38/0,5= -8,76 |
По уравнению Гиббса вычисляем величину адсорбции:
Г1
=
![]() моль/см2,
моль/см2,
Г2 = 0,8 ∙ 10-10 моль/см2,
Г3 = 1,65 ∙ 10-10 моль/см2,
Г4 = 2,75 ∙ 10-10 моль/см2.
Площади, занимаемые одной молекулой уксусной кислоты при данной концентрации, вычисляем по уравнению (5.11):
S1
=
![]() =
0,25 ∙ 10-13
см2,
=
0,25 ∙ 10-13
см2,
S2 = 0,21 ∙ 10-13 см2,
S3 = 0,11 ∙ 10-13 см2,
S4 = 0,06 ∙ 10-13 см2.
Тогда толщину адсорбционного слоя для Г4 вычисляем по формуле:
δ =
![]() =
1,6 ∙ 10-9,
=
1,6 ∙ 10-9,
где 60 – молярная масса уксусной кислоты, г/моль;
1,05 – плотность уксусной кислоты, г/см3.
Пример 3
Зависимость поверхностного натяжения водных растворов амилового спирта (С5Н11ОН) от концентрации при 250С выражается следующим образом:
-
Концентрация, кмоль/м3
Поверхностное натяжение, мН/м
0
72,0
0,0019
70,4
0,0038
69,2
0,0075
66,7
0,0150
61,7
0,0300
55,3
0,0600
46,6
0,1200
38,0
Графическим способом определите величину адсорбции амилового спирта из раствора с концентрацией 0,030 кмоль/м3.
Решение.
Построим график
зависимости поверхностного натяжения
от концентрации. Проведем касательную
к кривой в стыке, имеющей ординату 0,030
кмоль/м3.
Тангенс угла наклона касательной к оси
абсцисс равен
![]() .
.
Из графика находим:
![]() =
-0,495 Н/м2
кмоль.
=
-0,495 Н/м2
кмоль.
Множитель 10-3 в числителе связан с тем, что σ в таблице и на рис. выражено в мН/м. По уравнению изотермы адсорбции Гиббса находим:
Г =
![]() =
5,95∙10-9
кмоль/м2.
=
5,95∙10-9
кмоль/м2.
Пример 4
Рассчитайте количество ммоль аммиака, адсорбированное 100 г почвы, если равновесное количество NH3 равно 12,5 ммоль/л, а константы К и 1/n, определенные экспериментально, соответственно равны 5,01 и 0,30.
Решение.
Расчеты производятся
по уравнению Фрейндлиха, представленного
в логарифмической форме:
![]() .
Подставляя числовые данные, получим:
lgХ
= 0,70 + 0,3291 = 1,0291, Х = 10,69 ммоль/100 г.
.
Подставляя числовые данные, получим:
lgХ
= 0,70 + 0,3291 = 1,0291, Х = 10,69 ммоль/100 г.
