
- •Курсовая работа
- •Введение
- •1 Краткая характеристика фенола
- •1.1 Физические и химические свойства
- •1.2 Токсичность фенола
- •1.3 Методы получение фенола
- •1.4 Применение фенола
- •2 Краткая характеристика ацетона
- •2.1 Физические и химические свойства ацетона
- •2.2 Токсичность ацетона
- •2.3 Пожароопасность ацетона
- •2.4 Методы получения
- •Лабораторное применение:
- •3 Совместное получение фенола и ацетона
- •1 Стадия – получение кумола
- •2 Стадия – каталитическое окисление
- •3.1 Описание процесса
- •3.2 Описание технологического процесса
- •3.3 Характеристика используемого сырья
- •3.4 Преимущества и недостатки метода
- •3.5 Отходы производства и их утилизация
- •Заключение
- •Список использованной литературы
1.3 Методы получение фенола
фенол получают окислением толуола, с промежуточным образованием бензойной кислоты
5С6H5СH3 + 6KMnO4 + 9H2SO4 → 5С6H5СOOH + 6MnSO4 + 3K2SO4 + 14H2O
бензойной кислоты
Из каменноугольной смолы (как побочный продукт – выход мал):
C6H5ONa + H2SO4(разб) → С6H5-OH + NaHSO4
фенолят натрия
(продукт обработки смолы едким натром)
Из галогенбензолов:
С6H5-Cl + NaOH t,p → С6H5 – OH + NaCl
Сплавлением солей ароматических сульфокислот с твёрдыми щелочами:
C6H5-SO3Na + NaOH t → Na2SO3 + С6H5 – OH
натриевая соль
бензолсульфокислоты
Метод Рашига: процесс получения фенола, включающий реакцию хлорирования бензола и последующий гидролиз монохлорбензола:
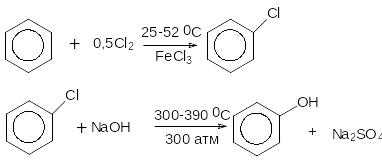
Суммарный выход фенола по двум стадиям составляет 70-85%.
1.4 Применение фенола
После открытия фенола, применение ему нашли быстро — для дубления кож, в производстве синтетических красителей,смол, пластмасс, полиамидов. В годы первой мировой войны фенол широко использовался для производства сильного взрывчатого вещества — пикриновой кислоты.
Разбавленные водные растворы фенола (карболка (5%)) применяют для дезинфекции помещений, белья. Являясь антисептиком, широко применялся в европейской и американской медицине в период 2 мировой войны, но из-за высокой токсичности в настоящее время использование сильно ограничено. Широко используется в молекулярной биологии и генной инженерии для очистки ДНК.
В настоящее время можно выделить несколько основных направлений использования фенола. Один из них – производство лекарственных средств. Большинство этих лекарств — производные получаемой из фенола салициловой кислоты: o-HOC6H4COOH. Самое распространенное жаропонижающее — аспирин не что иное, как ацетилсалициловая кислота. Эфир салициловой кислоты и самого фенола тоже хорошо известен под названием салол. При лечении туберкулеза применяют парааминосалициловую кислоту (сокращенно ПАСК). Ну и, наконец, при конденсации фенола с фталевым ангидридом получается фенолфталеин, он же пурген.
Другое направление применения фенола – производство синтетических волокон: нейлона, капрона. Но важнейшая область его применения – производство феноло-формальдегидных смол.
2 Краткая характеристика ацетона
Ацетон (диметилкетон, систематическое наименование: пропан-2-он) — простейший представитель кетонов. Формула: CH3-C(O)-CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом.
Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г.) и устойчиво растёт.
2.1 Физические и химические свойства ацетона
Физические свойства
Полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом.
Молярная масса 58,08 г/моль;
Плотность 0,7899 г/см3
Температура плавления - 95 0C;
Температура кипения 56,1 0С;
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение
CH3C(O)CH3 + NaHSO3 → (CH3)2C(OH)-SO3Na
Вступает в альдольную самоконденсацию под действием щелочей, с образованием диацетонового спирта.
2CH3C(O)CH3 → (CH3)2C(OH)CH2C(O)CH3
Восстанавливается цинком до пинакон.
2CH3C(O)CH3 + Zn → (CH3)2C(OH)C(OH)(CH3)2
При пиролизе (700 °C) образует кетен.
CH3C(O)CH3 → CH2=C=O + 2H2
Легко присоединяет циановодород с образованием ацетонциангидрина.
CH3C(O)CH3 + HCN → (CH3)2C(OH)CN
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Ацетон, как и другие кетоны, в щелочной среде способен изомерироваться в пропаналь, последний — до пропенового спирта. В кислой среде и в присутствии ионов двухвалентной ртути, пропеновый спирт изомерируется сразу в ацетон. Между этими веществами всегда существует таутомерное равновесие:
CH3C(O)CH3 ↔ С2Н5СОН ↔ СН2=С(ОН)-СН3
