- •Химическая связь
- •1. Типы химической связи
- •Типы химической связи и их основные отличительные признаки
- •3. Ковалентные связи в молекулах и атомных кристаллических решетках
- •4. Квантово-химическое объяснение ковалентнок связи
- •4.1. Ковалентные -связи между s- орбиталями
- •4.2. Ковалентные -связи между p-орбиталями
- •4.3. Ковалентные -связи между s- и p-орбиталями
- •4.4. Ковалентные -связи между p-орбиталями
- •4.5. Энергетическая диаграмма образования связей между p-орбиталями.
- •5. Гибридизация атомных орбиталей
- •Типы гибридизации и геометрия молекул
- •7. Полярность ковалентных связей. Электроотрицательность элементов
- •8. Образование ковалентной связи при участии неподеленных электронных пар
- •10. Ионная связь
- •12. Металлическая связь
- •2. Общее понятие о ковалентной связи (Самостоятельно)
- •6. Ковалентные связи с участием атома углерода (самостоятельно)
- •9. Водородная связь (самостоятельно)
- •11. Ионные кристаллы (Самостоятельно)
- •13. Проводники, диэлектрики и полупроводники (Самостоятельно)
8. Образование ковалентной связи при участии неподеленных электронных пар
Образование ковалентной связи можно описать с помощью двух механизмов — равноценного и донорно-акцепторного. Равноценный механизм предполагает, что общая электронная пара (в методе валентных связей) образуется из неспаренных электронов обоих атомов-партнеров по связи. Донорно-акцепторный механизм образования ковалентной связи предполагает, что один из атомов предоставляет для образования связи неподеленную (собственную) пару электронов, а другой атом – вакантную (без электронов) атомную орбиталь. Атом, поставляющий пару электронов в область связывания, — это ее донор, атом, приобретающий часть электронной плотности донорной пары, — акцептор. При образовании ковалентной связи участвующие атомы могут быть, с одной стороны, как нейтральными, так и заряженными, с другой стороны — как свободными, так и уже связанными (т. е. входящими в состав молекул).
После образования связи по донорно-акцепторному механизму уже нельзя указать, какой атом был донором, а какой — акцептором электронной пары.
Пример:
Молекула
Н2
со связью Н—Н может образоваться (в
рамках метода
валентных связей) из двух атомов водорода
при обобществлении двух
неспаренных электронов (равноценный
механизм). Однако тот же результат
достигается, если исходными являются
заряженные атомы Н-1
и Н+1.
Атом
Н-1
предоставляет
для образования связи Н—Н свою
неподеленную пару
электронов 1s2,
а атом Н+—
вакантную 1s-АО
(рис.
18 СЛ. 24).
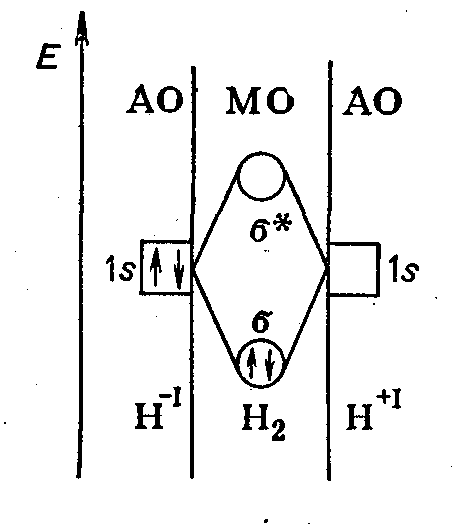
Рис. 18. Энергетическая диаграмма образования связи в молекуле Н2, исходя из атомов Н- и Н+
Молекула
аммиака NН3
содержит неподеленную пару электронов
у атома азота, молекула воды Н2О
также имеет неподеленные пары
у атома кислорода. Вместе с активным
акцептором — ионом водорода
Н+
по донорно-акцепторному механизму
образуются катионы аммония NН4+,
и оксония Н3О+
СЛ.
25:
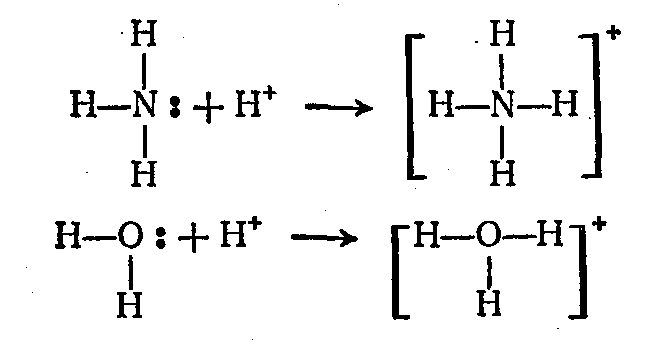
Форма молекулы NН3 (незавершенный тетраэдр) становится полностью симметричной в катионе NН4 (правильный тетраэдр); симметричность катиона Н3О+ также выше, чем у молекулы Н2О. В ионах Н3О+ и NН4+ все атомы водорода неразличимы, т, е. уже нельзя указать тот атом водорода, который был до образования связи в виде Н+ и служил акцептором электронной пары. Тип гибридизации центральных атомов О (в Н3О+) и N (в NН4+) остается тем же, что был в молекулах Н2О и NН3 (sр3-гибридизация).
Кроме того, для образовавшейся по донорно-акцепторному механизму ковалентной связи были приняты названия в простых соединениях — семиполярная, а в комплексных соединениях — донорно-акцепторная, или координационная. Поскольку ковалентные связи, образующиеся по обоим механизмам, по свойствам не различаются, указанные названия применять нецелесообразно.
10. Ионная связь
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента.
Чисто - ионная связь есть предельный случай ковалентной связи.
На практике полный переход электрона от одного атома к другому атому-партнеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую (но не нулевую) электроотрицательность, и любая химическая связь будет в некоторой степени ковалентной.
Если степень ковалентности связи достаточно высока, то такая химическая связь является полярной ковалентной связью с той или иной степенью ионности. Если же степень ковалентвостн связи мала по сравнению со степенью ее ионности, то такая связь считается ионной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящимися в состояния разноименно заряженных ионов.
Процесс образования ионной связи позволяет объяснить электростатическая модель, т. е. рассмотрение химического взаимодействия между отрицательно и положительно заряженными ионами.
Ионы — это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или приема электронов.
При отдаче или приеме электронов молекулами образуются молекулярные, или многоатомные ионы, например, NО2- — нитрит-ион.
Одноатомные положительные ионы, или одноатомные катионы, и одно атомные отрицательные ионы, или одноатомные анионы, возникают при химической реакции между нейтральными атомами путем взаимопередачи электронов. При этом атом электроположительного элемента, обладающий небольшим числом внешних электронов (одним — двумя, реже тремя—четырьмя), переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов (отдача электронов). Наоборот, атом электроотрицательного элемента, имеющий большое число внешних электронов (от трех до семи), переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов (прием чужих электронов). Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы — неметаллами.
При передаче электронов атомы металлического и неметаллического элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает вокруг своего остова внешнюю оболочку последующего благородного газа (электронный октет), тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую октетную конфигурацию предыдущего благородного газа.
П р и
м е р: Атом натрия Nа
(электронная конфигурация 1s22s22р63s1)
имеет один
внешний
электрон (электрон третьего энергетического
уровня), а атом хлора С1 (электронная
конфигурация 1s22s22р63s23р5)
— семь
внешних
электронов. При переходе от атома натрия
Na
внешнего
3s-электрона
к атому С1 электронная оболочка атома
хлора становится внешней электронной
оболочкой атома аргона (3s23р8),
а
электронная оболочка натрия — внешней
оболочкой атома неона (2s22p6),
так как на третьем энергетическом уровне
натрия не остается ни одного электрона
(рис.
19 СЛ. 26(0)).
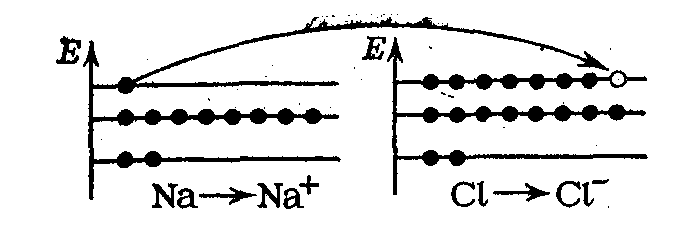
Рис. 19. Переход электрона от атома Nа к атому Cl
При этом атом натрия теряет один отрицательный заряд и становится катионом N3+, а атом хлора приобретает этот заряд и становится анионом С1-.
СЛ.
26(1)
Оценка зарядов на атомах натрия и хлора
в состоянии ионов следует из сравнения
числа протонов в их ядрах и общего числа
электронов на их оболочках.
Nа —> Nа+ С1 —> Сl-
Ядро 11р+ 11р+ 17р+ 17р+
Оболочка 11е- 10е- 17е- 18е-
В
рамках орбитальной модели атома
образование ионов Na+
и С1-
объясняется так СЛ
27:
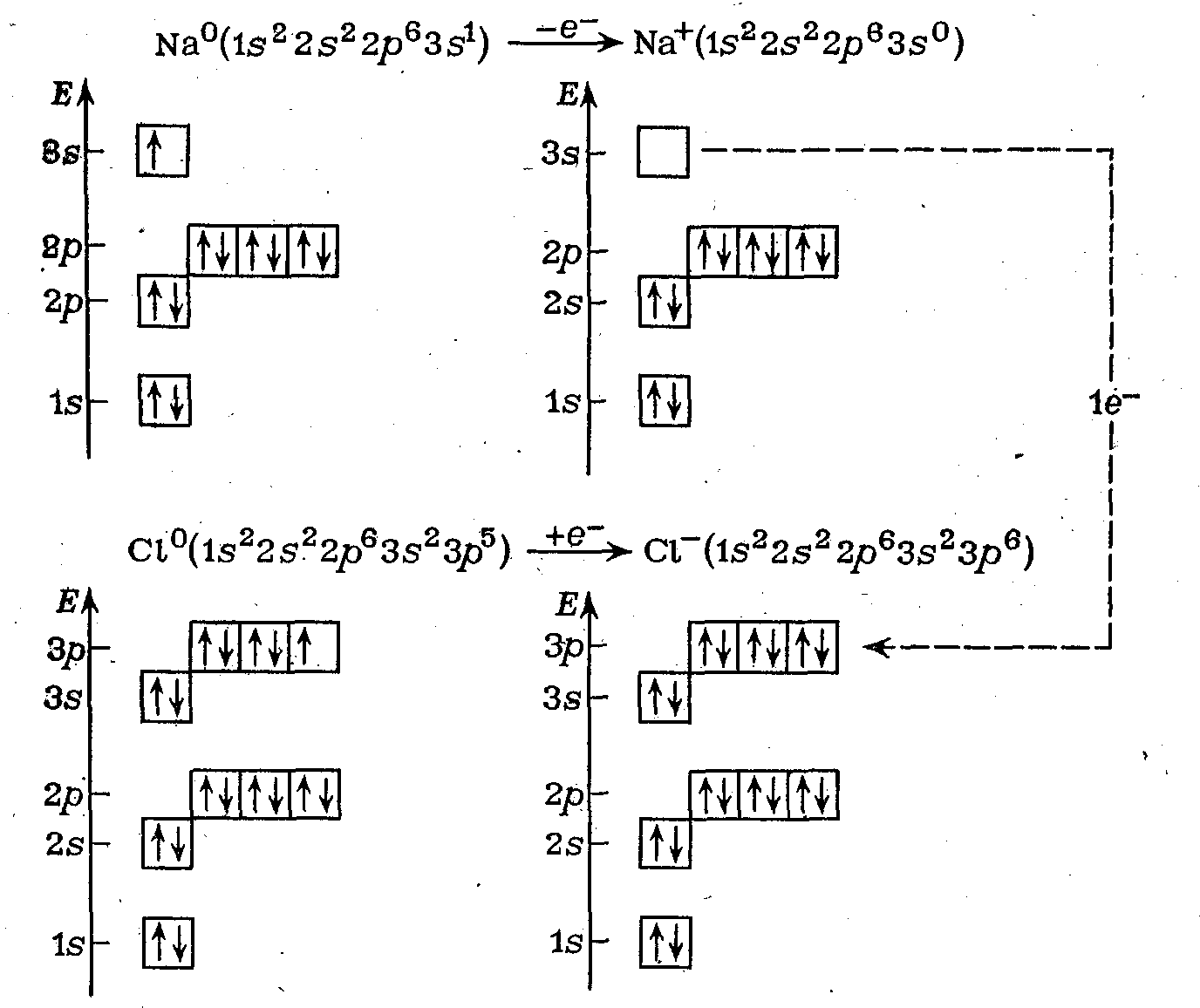
Переход 3s-электрона атома натрия на 3p-подуровень хлора показан пунктирной стрелкой справа. Третий энергетический уровень имеет еще пять 3d-АО, но так как 3d-подуровень начинает заполняться только у атомов элементов четвертого периода, он здесь не показан ион С1- находится в промежуточном устойчивом состоянии благородного газа.
Для простоты вместо эффективных зарядов обычно указывают целочисленные заряды ионов (Nа+)(С1-), имея в виду, что именно такие ионы образуются при электролитической диссоциации ионного соединения NаС1 в водном растворе или в расплаве: NаС1 = Nа+ + С1-.
Для того, чтобы
решить, является ли данная связь
преимущественно ковалентной или
преимущественно ионной (и соответствующим
способом интерпретировать свойства
соединений), можно прибегнуть к оценке
по методу Полинга. Химическая связь с
50 %-ой ионностью отвечает разности =
1,7; при > 1,7
связь будет по преимуществу ионная,
например, как для NаС1 (=
2,1), например СЛ. 28:
|
CsCl |
BaCl2 |
MgCl2 |
AlCl3 |
SnCl2 |
BiCl3 |
|
2,3 |
2,1 |
1,8 |
1,5 |
1,2 |
1,1 |
Очевидно, что СsС1, ВаС12 и МgС12 — ионные соединения, остальные хлориды (А1С13, SпСl2 и ВiС1з) — ковалентные.
Чтобы
изобразить образование ионов в химической
реакции между нейтральными
атомами, уравнение химической реакции
записывают с помощью электронных
формул СЛ
29(0):
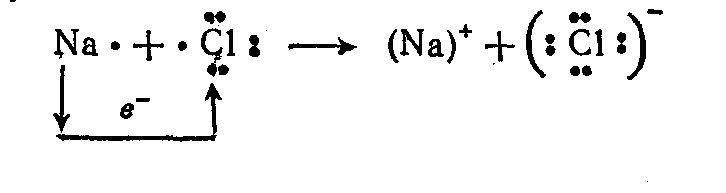
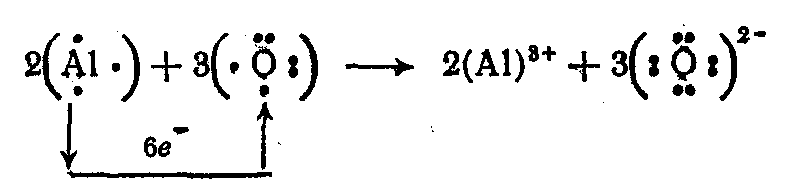
При этом следует использовать правило равенства чисел электронов, переданных в реакции: число отданных электронов должно быть равно числу принятых электронов.
В
соответствии с этим правилом подбираются
стехиометрические коэффициенты
в уравнении реакции СЛ
29(1):