
- •Химическая связь
- •1. Типы химической связи
- •Типы химической связи и их основные отличительные признаки
- •3. Ковалентные связи в молекулах и атомных кристаллических решетках
- •4. Квантово-химическое объяснение ковалентнок связи
- •4.1. Ковалентные -связи между s- орбиталями
- •4.2. Ковалентные -связи между p-орбиталями
- •4.3. Ковалентные -связи между s- и p-орбиталями
- •4.4. Ковалентные -связи между p-орбиталями
- •4.5. Энергетическая диаграмма образования связей между p-орбиталями.
- •5. Гибридизация атомных орбиталей
- •Типы гибридизации и геометрия молекул
- •7. Полярность ковалентных связей. Электроотрицательность элементов
- •8. Образование ковалентной связи при участии неподеленных электронных пар
- •10. Ионная связь
- •12. Металлическая связь
- •2. Общее понятие о ковалентной связи (Самостоятельно)
- •6. Ковалентные связи с участием атома углерода (самостоятельно)
- •9. Водородная связь (самостоятельно)
- •11. Ионные кристаллы (Самостоятельно)
- •13. Проводники, диэлектрики и полупроводники (Самостоятельно)
4.5. Энергетическая диаграмма образования связей между p-орбиталями.
Комбинирование шести p-АО двух связывающихся атомов даёт шесть молекулярных орбиталей: одну связывающую -МО и одну разрыхляющую *-МО, две связывающие -МО и две разрыхляющие *-МО.
Граничные поверхности *-МО отличаются от таковых для -МО (рис. 8), но это не существенно при трактовке связи по методу молекулярных орбиталей. Более важно, что энергия связывающих -МО всегда ниже, чем энергия разрыхляющих *-МО.
При
наличии как минимум шести электронов
на двух p-подуровнях
связывающихся атомов все три связывающие
МО (одна -МО
и две -МО)
окажутся
занятыми электронами. Например, это
реализуется в молекуле О2,
так как 2р-подуровень атома О (электронная
конфигурация
2s22р4)
содержит
четыре электрона (рис.
11 СЛ.13).
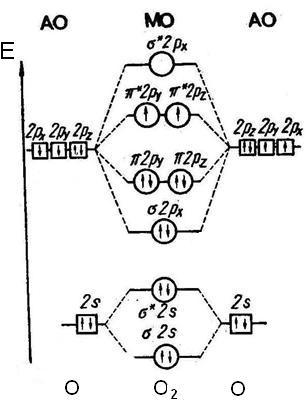
Рис. 11. Энергетическая диаграмма образования связи в молекуле О2
Из рис. 11 следует, что 5.5-связь в молекуле О2, отсутствует, поскольку s.s, и s.s*-МО полностью заполнены четырьмя 2s-электронами, как и в гипотетической молекуле Не2. Поэтому далее s-подуровни атомов, заполненные двумя электронами, на энергетических диаграммах не учитываются.
Заселение молекулярных орбиталей p-электронами начинается после полного заполнения 5.5-, и 5.5*-МО. Как низшая по энергии, сначала заполняется p.p-МО, затем две p-p-МО, причем каждая из них заполняется вначале одним электроном (по правилу Хунда), а затем и вторым электроном с противоположным спином. Из восьми 2s-электронов двух атомов О размещенными оказываются только шесть. По принципу минимума энергии оставшиеся два p-электрона занимают разрыхляющие p-p*-МО, кото-рые ниже по энергии, чем p.p*-МО.
В молекуле N2 за счет трех электронов p-подуровня каждого атома N образуется тройная , , -связь: N+NNN.
При
этом p-орбитали
перекрываются, как показано на рис. 10.
Образование связи в молекуле N2
по методу молекулярных орбиталей
иллюстрирует рис
12 СЛ. 14.
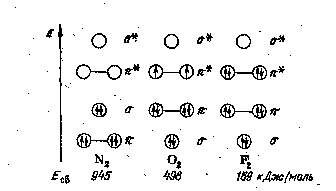
Рис. 12. Связывающие и разрыхляющие молекулярные орбитали, заполняемые p-электронами, в молекулах N2, О2 и F2 и энергия связи азот — азот, кислород — кислород и фтор — фтор
Следует обратить внимание на то, что в молекуле N2, в отличие от молекулы О2 рис. 11, связывающие -МО расположены по энергии ниже, чем связывающая -МО.
Отсутствие разрыхляющих электронов в молекуле N2 объясняет большое значение энергии связи азот — азот (см. рис. 12) и весьма высокую химическую инертность молекулярного азота. В противоположность этому молекулы О2 и F2 имеют соответственно два и четыре электрона на разрыхляющих *-МО, что обусловливает значительно меньшую прочность связей кислород — кислород и фтор — фтор и высокую реакционную способность молекулярных кислорода и фтора.
Из энергетической диаграммы образования связи в гипотетической молекуле Ne2, следует, что такая молекула неустойчива и не может образовываться. Действительно, в соответствии с энергетической диаграммой молекулы Ne2 число разрыхляющих электронов равно числу связывающих электронов, т. е. связь неон — неон неосуществима, как и связь гелий — гелий.
Обобщая рассмотренные механизмы формирования ковалентных связей, можно утверждать: ковалентная связь между двумя атомами образуется тогда, когда действие хотя бы одной связывающей молекулярной орбитали не компенсируется действием разрыхляющей молекулярной орбитали.
Действительно, в молекулах N2 и F2 проявляется связывающее действие соответственно трех и одной молекулярной орбитали, тогда как в гипотетической молекуле Ne2 число связывающих МО, заполненных электронами, равно числу заселенных разрыхляющих МО.
