
- •Химическая связь
- •1. Типы химической связи
- •Типы химической связи и их основные отличительные признаки
- •3. Ковалентные связи в молекулах и атомных кристаллических решетках
- •4. Квантово-химическое объяснение ковалентнок связи
- •4.1. Ковалентные -связи между s- орбиталями
- •4.2. Ковалентные -связи между p-орбиталями
- •4.3. Ковалентные -связи между s- и p-орбиталями
- •4.4. Ковалентные -связи между p-орбиталями
- •4.5. Энергетическая диаграмма образования связей между p-орбиталями.
- •5. Гибридизация атомных орбиталей
- •Типы гибридизации и геометрия молекул
- •7. Полярность ковалентных связей. Электроотрицательность элементов
- •8. Образование ковалентной связи при участии неподеленных электронных пар
- •10. Ионная связь
- •12. Металлическая связь
- •2. Общее понятие о ковалентной связи (Самостоятельно)
- •6. Ковалентные связи с участием атома углерода (самостоятельно)
- •9. Водородная связь (самостоятельно)
- •11. Ионные кристаллы (Самостоятельно)
- •13. Проводники, диэлектрики и полупроводники (Самостоятельно)
4.2. Ковалентные -связи между p-орбиталями
Атомные
p-орбитали,
подобно s-АО,
при сближении соответствующих атомов
могут
перекрываться вдоль своей оси и
комбинироваться в молекулярные орбитали
(рис.
4) СЛ.7.
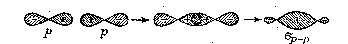
Рис. 4. Образование ковалентной связи при перекрывание атомных p-АО.
Знаки плюс и минус внутри граничной поверхности p-орбиталей (рис. 4) не относятся к электрическим зарядам (электроны всегда заряжены отрицательно), а обозначают перекрывающиеся половины каждой p-АО. Комбинирование двух p-АО приводит к образованию двух ,вращательно-симметричных молекулярных орбиталей. одной связывающей -МО и одной разрыхляющей *-МО. Образующаяся связь является р-p-связью.
На
рис.
5 СЛ. 8 (0)
показано образование р-p-связи
из двух p-АО
фтора.
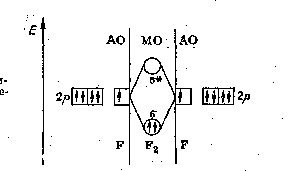
Рис. 5. Энергетическая диаграмма образования -связи в молекуле F2
В
образовании
-связи
участвуют по одной орбитали с p-подуровня
каждого атома фтора, остальные p-АО
(указанные отдельно) формируют -МО,
Электроны
заполняют связывающую -МО,
которая по энергии ниже, чем исходные
p-АО.
Оба атома фтора связываются в молекулу
F2:
СЛ.
8 (1).
![]()
4.3. Ковалентные -связи между s- и p-орбиталями
Атомные s- и p-орбитали также могут перекрываться и комбинироваться в молекулярные орбитали рис. 6 СЛ. 9.
 Рис.
6. Образование ковалентной связи при
перекрывание атомных s
и
p-АО.
Рис.
6. Образование ковалентной связи при
перекрывание атомных s
и
p-АО.
Перекрывающаяся половина p-АО по знаку совпадает со сферически симметричной s-АО. В результате комбинирования s- и p-АО формируются две вращательно-симметричные молекулярные орбитали: одна связывающая -МО и одна разрыхляющая *-МО. Образующаяся ковалентная связь называется s-p-связью.
На
рис.
7 СЛ. 10
представлена энергетическая диаграмма
образования s-p-связи
между атомом водорода Н и атомом хлора
С1.
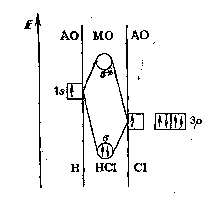
Рис. 7. Энергетическая диаграмма образования -связи в молекуле HCl
В образовании связи принимают участие 1s-АО водорода и одна p-АО хлора, содержащая неспаренный электрон, (не участвующие в связи остальные р-АО хлора, содержащие электронные пары, на рис. 7 указаны отдельно; s-АО хлора также не участвует в формировании связи и на рис. 7 не показана). Хлор — более электроотрицательный элемент, чем водород, поэтому p-подуровень атома хлора располагают на энергетической диаграмме ниже, чем s-подуровень атома водорода. Два электрона заполняют связывающую -МО, которая по энергии ниже исходных 1s- и 3p-АО. Оба атома объединяются в молекулу хлороводорода: H+ClHCl.
В соответствии с атомной моделью Бора при образовании ковалентной связи Н—С1 создается октет валентных электронов вокруг атома хлора, но лишь дублет электронов вокруг атома водорода.
4.4. Ковалентные -связи между p-орбиталями
Образование
химической связи возможно и между двумя
атомами, содержащими
валентные p-подуровни.
При сближении атомов вдоль оси в
первую очередь происходит перекрывание
между двумя px-АО,
которые и образуют p-p
-связь. Однако это не исключает последующего
взаимодействия ру-
и
рz-АО
обоих атомов. Комбинирование двух рz-АО
или
двух рy-АО
(хотя
и не настолько энергетически выгодное,
как при образовании
-связи)
приводит к формированию молекулярных
орбиталей иного |чем
-МО)
вида. Эти орбитали не являются
вращательно-симметричными (какими
были s-p
-МО), но лежат симметрично относительно
плоскости, включающей
оси х
обоих
атомов (рис.
8 СЛ. 11 (0)).
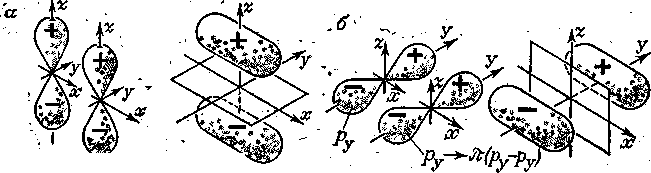
Рис. 8. Образование p-p-связей из двух рz-орбиталей (а) и из двух ру-орбиталей (б)
Такие молекулярные орбитали называются связывающими -МО, а образующиеся связи — соответственно p-p-связями.
Молекулярные орбитали -типа комбинируются из p-орбиталей одинаковой пространственной ориентации (либо из двух рy-АО, либо из двух рz,-АО).
Комбинирование
различных по ориентаций орбиталей,
например рy-
и рz-АО,
как
показано на рис.
9
СЛ. 11 (1),
пространственно невозможно из-за
различия знаков.
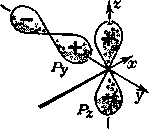
Рис. 9. Схема, иллюстрирующая отсутствие перекрывания и невозможность образования связи между различными по ориентации p-орбиталями
В
предельном случае, т. е. при перекрывании
p-орбиталей
всех трех ориентаций,
образуются одна -связь.
Химическая
-связь
— это результат прямого перекрывания
p-орбиталей,
а
-связи—
результат бокового перекрывания
p-орбиталей
рис.
10 СЛ. 12.
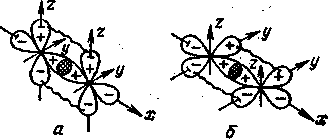
Поскольку -связь может образовываться и без сопутствующего формирования -связи, а -связь, наоборот, образуется, когда первая пара p-АО уже вступила в прямое перекрывание и образовала -связь, то различают -составляющую и -составляющую единой ковалентной связи.
