
- •Химическая связь
- •1. Типы химической связи
- •Типы химической связи и их основные отличительные признаки
- •3. Ковалентные связи в молекулах и атомных кристаллических решетках
- •4. Квантово-химическое объяснение ковалентнок связи
- •4.1. Ковалентные -связи между s- орбиталями
- •4.2. Ковалентные -связи между p-орбиталями
- •4.3. Ковалентные -связи между s- и p-орбиталями
- •4.4. Ковалентные -связи между p-орбиталями
- •4.5. Энергетическая диаграмма образования связей между p-орбиталями.
- •5. Гибридизация атомных орбиталей
- •Типы гибридизации и геометрия молекул
- •7. Полярность ковалентных связей. Электроотрицательность элементов
- •8. Образование ковалентной связи при участии неподеленных электронных пар
- •10. Ионная связь
- •12. Металлическая связь
- •2. Общее понятие о ковалентной связи (Самостоятельно)
- •6. Ковалентные связи с участием атома углерода (самостоятельно)
- •9. Водородная связь (самостоятельно)
- •11. Ионные кристаллы (Самостоятельно)
- •13. Проводники, диэлектрики и полупроводники (Самостоятельно)
4. Квантово-химическое объяснение ковалентнок связи
4.1. Ковалентные -связи между s- орбиталями
Квантово-механические представления о строении электронных оболочек атомов позволяют качественно объяснить и количественно рассчитать в соответствии с современным уровнем развития квантовой химии образование ковалентной связи.
Если
друг к другу приближаются два атома,
каждый из которых имеет занятую
одним электроном орбиталь, то между
атомами возникает ковалентная
связь. Простейший пример образования
ковалентной связи представляет собой
объединение двух атомов водорода в
молекулу Н2
(рис.
1) СЛ. 4.
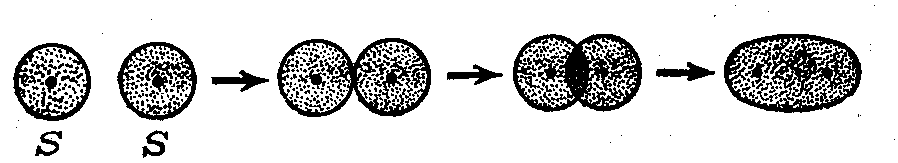
Рис. 1. Образование ковалентной связи при перекрывании атомных орбиталей водорода.
По методу валентных связей при сближении двух атомов водорода происходит перекрывание их s-орбиталей, каждая из которых содержит один электрон. Этот процесс сопровождается выделением энергии при образовании общей электронной пары. Поскольку между положительно заряженными ядрами атомов водорода действуют силы электростатического отталкивания, то, начиная с некоторого расстояния между атомами, эти силы начинают препятствовать дальнейшему самопроизвольному сближению атомов. Чтобы вновь разделить образовавшуюся молекулу Н2 на атомы водорода, необходимо затратить энергию (436 кДж/моль); она называется энергией связи и численно равна энергии, выделившейся при образовании молекулы Н2 (—136 кДж/моль). Таким образом, образованию ковалентной связи отвечает состояние молекулы Н2 с энергетическим минимумом в 436 кДж/моль. Обобщая этот результат на процесс образования ковалентных связей между атомами других элементов, можно утверждать, что при объединении атомов в молекулы реализуется состояние с энергетическим минимумом.
Таким образом, прочность ковалентной связи обусловлена тем, что для ее разрыва всегда необходима затрата некоторой энергии.
По методу молекулярных орбиталей, процесс образования ковалентной связи в молекуле Н2 объясняется следующим образом. Однократно заселенные электроном орбитали двух атомов водорода при их достаточном сближении и перекрывании комбинируются в две молекулярные орбитали, внутри которых располагаются оба атомных ядра. Одна из этих молекулярных орбиталей (как более выгодная по энергии) оказывается полностью занятой двумя электронами (общей электронной парой), что и показано на рис. 1 (справа).
Любую
молекулярную орбиталь (МО) можно
трактовать, подобно любой атомной
орбитали, как объем пространства в
молекуле, где пребывание электронов
можно обнаружить с вероятностью 90 % и
где может сосредотачиваться 90 % электронной
плотности одного или двух электронов
в зависимости от занятости данной МО.
На рис.
2 СЛ.5,
представляющим энергетическую диаграмму
образования связи в молекуле водорода
по методу молекулярных орбиталей.
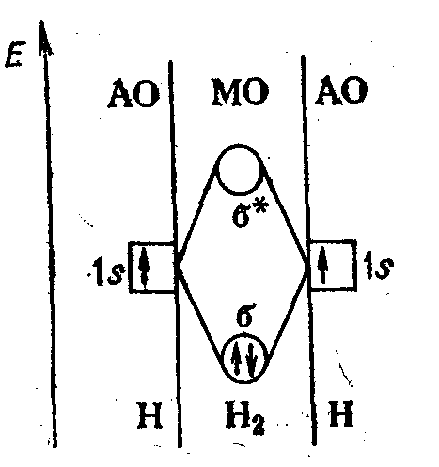
Рис. 2. Энергетическая диаграмма образования -связи в молекуле Н2
Такую МО, занятой двумя электронами является, например, нижняя по энергии.
Ковалентная связь, при формировании которой обе взаимодействующие атомные орбитали перекрываются и комбинируются вдоль оси таким образом, что образуются вращательно-симметричные молекулярные орбитали как на рис. 1.
Ковалентная связь, при формировании которой обе взаимодействующие атомные орбитали перекрываются и комбинируются вдоль оси таким образом, что образуются вращательно-симметричные молекулярные орбитали, называется -связью. Если в образовании -связи участвуют со стороны обоих атомов s-АО, то для уточнения информации говорят о возникновении s-s-связи.
Две молекулярные орбитали, которые всегда образуются при комбинировании двух атомных орбиталей, различаются по энергии. Молекулярная орбиталь, которая оказывается более выгодной для электронов по энергии и благодаря которой атомы связываются в молекулу, называется связывающей, ее обозначают как -МО (см. рис. 1). Другая молекулярная орбиталь, менее выгодная по энергии, чем исходные атомные орбитали, называется разрыхляющей, ее обозначают как *-МО.
Названия
«связывающая» и «разрыхляющая» МО
нисходят из распределения
электронной плотности в этих объемах
молекулярного пространства. Связывающей
МО отвечает повышенная электронная
плотность в области связывания
(между атомными ядрами), а разрыхляющей
МО — повышенная электронная плотность
в области разрыхления (по обе стороны
за атомными ядрами).
Распределение электронной плотности
в молекулярных орбиталях наглядно
показано на рис.
3 СЛ.6.

Рис. 3 Распределение электронной плотности в связывающей s (а) и разрыхляющей s* (б) молекулярной орбитали.
Таким образом, электроны на связывающих МО укрепляют химическую связь, а электроны на разрыхляющих МО ослабляют (разрыхляют) химическую связь. Вероятность пребывания электронов в связывающей МО высокая, а в разрыхляющей МО — низкая, поэтому электроны при образовании молекулы вначале занимают связывающие МО, а уж затем — разрыхляющие МО; например, на рис. 2 оба электрона двух атомов водорода оказываются при образовании -связи на единственной -МО.
С помощью метода молекулярных орбиталей легко объяснить, почему атомы гелия в отличие от атомов водорода или кислорода не объединяются в ковалентныё молекулы Не2. Два атома гелия имеют четыре 1s-электрона, при гипотетическом образовании молекулы Не2 первые два электрона займут -МО (как на рис. 1), а вторые два электрона — *-МО (которая остается вакантной в молекуле Н2, рис. 1). Квантово-механические расчеты показывают, что при равном числе связывающих и разрыхляющих электронов действие последних сильнее, и молекула, такая как Не2, не образуется. Образование таких молекул энергетически невыгодно, а стабилизирующее молекулу действие электронов на связывающих МО компенсируется (а часто превышается) дестабилизирующим действием разрыхляющих электронов. Именно поэтому существуют такие частицы, как Н+, Н2, и Не2+, но не образуются молекулярные частицы Н2- и Не2.
