
- •Химическая связь
- •1. Типы химической связи
- •Типы химической связи и их основные отличительные признаки
- •3. Ковалентные связи в молекулах и атомных кристаллических решетках
- •4. Квантово-химическое объяснение ковалентнок связи
- •4.1. Ковалентные -связи между s- орбиталями
- •4.2. Ковалентные -связи между p-орбиталями
- •4.3. Ковалентные -связи между s- и p-орбиталями
- •4.4. Ковалентные -связи между p-орбиталями
- •4.5. Энергетическая диаграмма образования связей между p-орбиталями.
- •5. Гибридизация атомных орбиталей
- •Типы гибридизации и геометрия молекул
- •7. Полярность ковалентных связей. Электроотрицательность элементов
- •8. Образование ковалентной связи при участии неподеленных электронных пар
- •10. Ионная связь
- •12. Металлическая связь
- •2. Общее понятие о ковалентной связи (Самостоятельно)
- •6. Ковалентные связи с участием атома углерода (самостоятельно)
- •9. Водородная связь (самостоятельно)
- •11. Ионные кристаллы (Самостоятельно)
- •13. Проводники, диэлектрики и полупроводники (Самостоятельно)
2. Общее понятие о ковалентной связи (Самостоятельно)
Ковалентная связь образуется за счет общих электронных пар, возникающих в электронных оболочках связываемых атомов. Поскольку ковалентно связанные атомы не несут на себе ионных зарядов, ковалентную связь еще называют гомеополярной или неполярной.
Ковалентная связь может быть образована атомами одного и того же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов Н2 О2, N2, С12 и др. Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах Н2О, РF3, СS2. Неполярную ковалентную связь еще называют чисто ковалентной.
Ковалентные связи обычно формируются между атомами элементов, обладающих электроотрицательным характером, т. е. между атомами неметаллических элементов, хотя известны ковалентные связи в молекулах, состоящих из атомов электроположительных элементов, таких как Li2 (обычно эти молекулы очень слабые и малоустойчивые).
Для наглядного изображения ковалентной связи в химических формулах используются точки (каждая точка отвечает валентному электрону), а также черта (каждая черта отвечает общей электронной паре).
П р и м е р. Связи в молекуле С12 можно изобразить так:
: С1 : С1 :, : С1— С1 : или С1— С1
Такие записи электронных формул равнозначны.
Ковалентные связи обладают пространственной направленностью. В результате ковалентного связывания атомов образуются либо молекулы, либо атомные кристаллические решетки со строго определенным геометрическим расположением атомов. Каждому веществу соответствует своя структура.
С позиций теорий Бора формирование ковалентной связи объясняется следующим образом. Атомам свойственна тенденция преобразовывать свой внешний слой электронной оболочки в октет, т. е. в конфигурацию ближайшего благородного газа. Оба атома – партнера по связи представляют для образования ковалентной связи по одному неспаренному электрону, т. е. занимающему атомную орбиту, и оба электрона становятся общими для этих атомов.
Например: Атомы хлора, каждый из которых на внешнем энергетическом уровне имеет семь электронов — три пары и один неспаренных электрон, создают (каждый для себя) октет валентных электронов путем образования одной ковалентной связи:
Новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора.
Несмотря на очевидную наглядность электронных формул, в рамках модельных представлений теории Бора невозможно указать, по каким орбитам движутся электроны общей пары. Они не могут уже находиться на атомных орбитах (каждая из которых относится лишь к одному атомному ядру). Поэтому теория. Бора (недостаточная и для объяснения строения несвязанного атома) оказалась несостоятельной и в объяснении механизма образования ковалентной связи. Эти трудности устраняет квантово-механическая, орбитальная модель атома.
6. Ковалентные связи с участием атома углерода (самостоятельно)
Существование большого числа органических соединений в значительной степени обусловлено двумя особыми свойствами атома углерода. Каждый атом углерода может образовывать четыре ковалентных связи и принимать участие в формировании четырех общих электронных пар. Кроме того, атом углерода имеет склонность (более всех других элементов) образовывать гомоядерные связи, давая так называемые углеродные цепи.
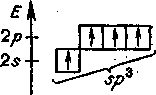
В основном состоянии атом углерода С(2s22р2) имеет два неспаренных электрона, за счет которых может образовывать только две общие электронные пары. Чтобы иметь возможность принять участие в образовании четырех общих электронных пар, атом углерода должен располагать четырьмя неспаренными электронами. Это достигается переходом атома углерода в возбужденное состояние (С*) при переносе одного 2s-электрона на 2р-подуровень рис 6.0.
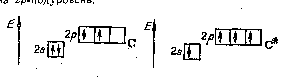
Рис. 6.0
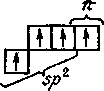
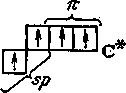
При sр2- и sp-гибридизации только три или две АО углерода участвуют в образовании -связей. Оставшиеся АО углерода (и электроны в них) имеют возможность формировать -составляющие многократных связей углерод—углерод.
Правильность этой модели образования четырех ковалентных связей подтверждается не только составом и геометрической формой молекул соединений углерода, но и четырехвалентным состоянием атома углерода в образуемых им простых веществах.
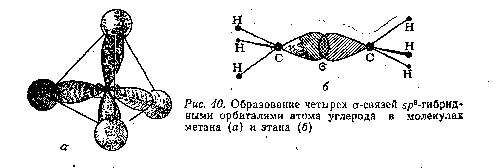 Рис.
6.2
Рис.
6.2
П р и м е р ы:
1. В молекуле метана СН4 атом углерода (sp3-ги6ридиэация) находится в тетраэдрическом окружении четырех атомов водорода (рис. 6.2а); в ней формируются четыре -связи углерод — водород. Метан — это простейшее из органических соединений углерода, он не содержит связей углерод—углерод.
2. В молекуле этана С2Н8 атом углерода (sр3-гибридизация) так же, как и в молекуле метана СН4, находится в тетраэдрическом окружении, но образует два химически разных вида связей — три -связи С—Н и одну -связь С—С (рис. 6.2б).
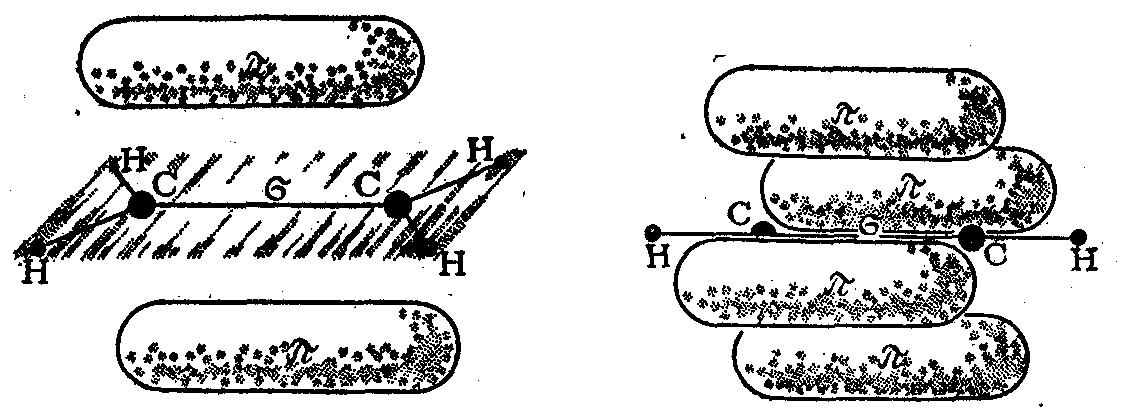
3. В молекуле этилена С2Н4 атом углерода (sр2-гибридизация) находится в тригональном (треугольном) окружении, и образует две -связи С—Н и одну , -связь СС (рис. 6.3а). Разделение двойной связи на - и -составляющие условно, хотя вклад -составляющей в общую энергию двойной связи (см. ниже) считается более высоким, чем вклад -составляющей.
4. В молекуле ацетилена С2Н2 атом углерода (sp-гибридизация) находится в линейном окружении и образует одну -связь С — Н и одну , , -связь С С (рис. 6.3б).
Энергия одинарной, двойной и тройной связей углерод — углерод в органических соединениях имеет значения 346, 602 и 835 кДж/моль соответственно,
А Б
Рис. 6.3 Образование двойной связи углерод – углерод в молекуле этилена А; Образование тройной связи углерод — углерод в молекуле ацетилена Б.
Для органических соединений, которые обладают только одинарными --связями углерод—углерод, например метана и этана, характерны реакции замещения. К реакциям присоединения без разрыва связи С—С (в этане и других гомологах метана) такие вещества не способны.
Для органических соединений, которые содержат двойные (-,-) и тройные (-, , -) связи углерод—углерод, например этилена и ацетилена, характерны реакции присоединения по месту разрыва -составляющих кратных связей (-составляющая как более устойчивая, три этом сохраняется. Реакции замещения для этих веществ также возможны.
В органических соединениях углерод может находится также в особом состоянии, называемом ароматическим состоянием. Это совершенно особый вид связывания атомов углерода в плоские циклы (замкнутые цепи), в которых все атомы цикла участвуют в образовании единой -электронной системы.
Простейшее ароматическое соединение — бензол содержит шесть атомов углерода, связанных друг с другом в цикл (бензольное кольцо). Каждый атом углерода находится в в sp2-гибридизации, поскольку имеет три связанных с ним партнера — атом Н и два других атома С, образуются три -связи — одна С—Н и две С—С. У каждого атома углерода в sр2-гибридизации имеется еще одна, негибридная 2р-орбиталь с неспаренным электроном, которая может образовать -связь. Ось такой p-орбитали расположена перпендикулярно плоскости осей орбиталей, формирующих -связи. В отличие от молекулы этилена, при образовании которой -связи формируются между двумя атомами углерода, в молекуле бензола все шесть 2р-орбиталей комбинируются вместе, образуя общую для них связывающую молекулярную -орбиталь, а шесть электронов объединяются в -электронный секстет. Граничная поверхность такой орбитали (поровну над и под плоскостью -связей) показана на рис. 6.4.
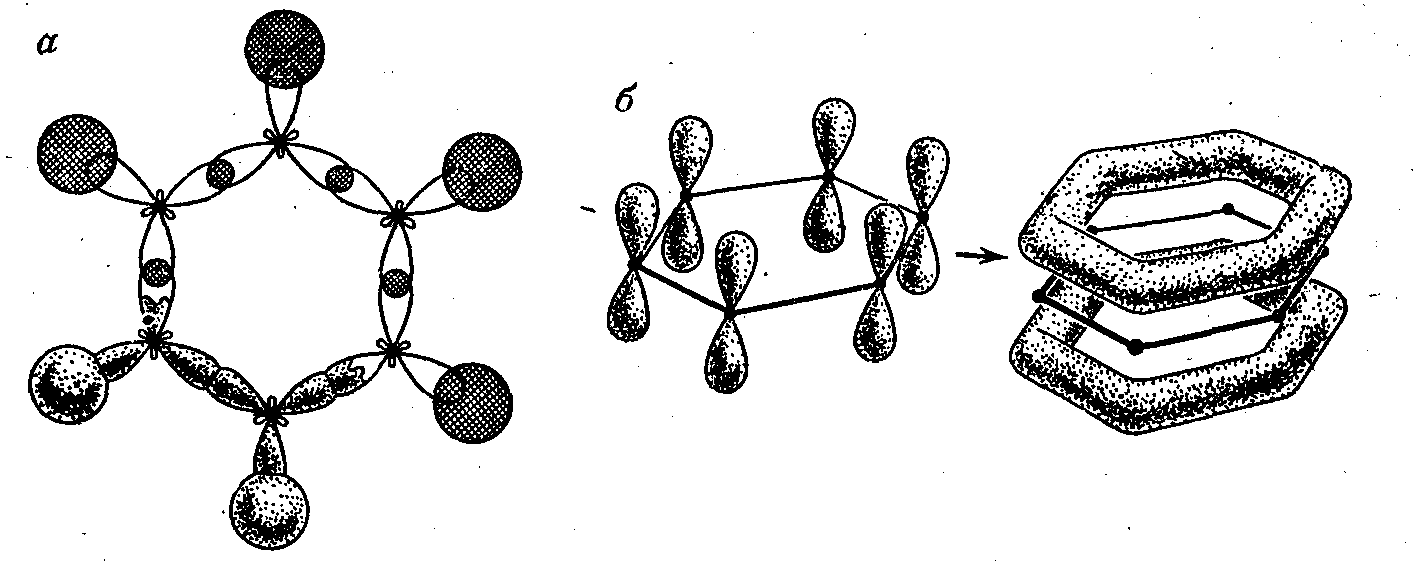
Рис. 6.4. Образование в молекуле бензола двухцентовых -связей (а) и многоцентровых -связей (б)
Метод молекулярных орбиталей всегда рассматривает образование связей как обобществление электронов в объеме пространства, включающем все ядра атомов данной молекулы. Особенно это верно для образования многоцентровых -связей. В молекуле бензола образуется шестичленная молекулярная -система, определяющая свойства всех ароматических соединений.
Плотность -электронов молекулы С6Н6 делокализована по всем шести ядрам атомов углерода, т. е. по всей молекуле. Образование многоцентровых МО также особенно выгодно в энергетическом отношении, что придает устойчивость всей системе.
Для бензольного кольца характерны реакции замещения. При этом ароматическая система остается неизменной. В реакциях присоединения -электронный секстет разрушается, из-за чего каждый электрон становится способным к образованию дополнительной -связи, что выше уже отмечалось для этилена и ацетилена.
