
- •Материаловедение
- •Введение
- •1. Кристаллическое строение металлов
- •1.1. Общая характеристика и структурные методы исследования металлов
- •1.2. Атомно-кристаллическая структура металлов
- •1.3. Дефекты кристаллического строения
- •1.4. Строение сплавов
- •2. Кристаллизация металлов
- •3. Деформация и разрушение металлов
- •3.1. Упругая и пластическая деформация
- •3.2. Механизм пластической деформации
- •3.3. Влияние пластической деформации на структуру и свойства металла
- •3.4. Разрушение металлов
- •4. Влияние нагрева на структуру и свойства деформированного металла
- •4.1. Возврат и полигонизация
- •4.2. Рекристаллизация
- •4.3. Факторы, влияющие на размер зерна рекристаллизованного металла
- •4.4. Холодная и горячая деформации
- •5. Железо-углеродистые сплавы
- •5.1. Компоненты и фазы в системе железо-углерод
- •5.2. Диаграмма состояния железо-цементит (Fe–Fe3c) (метастабильное равновесие)
- •5.3. Формирование структуры углеродистых сталей при медленном охлаждении
- •5.4. Формирование структуры белых чугунов
- •6. Чугуны
- •6.1. Белые чугуны
- •6.2. Серые чугуны
- •6.3. Высокопрочные чугуны
- •6.4. Ковкие чугуны
- •7. Стали
- •7.1. Примеси в сталях
- •7.2. Влияние углерода на свойства стали
- •7.3. Влияние постоянных примесей на свойства стали
- •7.4. Влияние легирующих элементов на критические точки железа
- •7.5. Классификация сталей
- •7.6. Маркировка сталей
- •7.7. Коррозионно-стойкие и жаростойкие стали и сплавы
- •7.8. Жаропрочные стали и сплавы
- •8. Термическая обработка сталей
- •8.1. Отжиг стали
- •8.2. Нормализация стали
- •8.3. Закалка стали
- •8.4. Отпуск стали
- •9. Химико-термическая обработка стали
- •9.1. Цементация стали
- •9.2. Азотирование стали
- •9.3. Нитроцементация и цианирование сталей
- •9.4. Диффузионная металлизация
- •10. Огнеупорные материалы
- •10.1. Свойства огнеупоров
- •10.2. Классификация огнеупоров
- •10.3. Огнеупорные изделия
- •10.4. Огнеупорные бетоны, торкрет-массы, мертели
- •11. Теплоизоляционные материалы
- •11.1. Свойства теплоизоляционных материалов
- •11.2. Классификация теплоизоляционных материалов
- •11.3. Естественные теплоизоляционные материалы
- •11.4. Искусственные теплоизоляционные материалы
- •Библиографический список
- •Оглавление
5. Железо-углеродистые сплавы
5.1. Компоненты и фазы в системе железо-углерод
Сплавы железа широко распространены в промышленности. Основными из них являются стали и чугуны. Это сплавы железа с углеродом.
Строение любых сплавов отражается диаграммой состояния. Чтобы экспериментально построить диаграммы состояния сплавов, образованных двумя компонентами А и В, нужно подготовить несколько сплавов с разным содержанием этих компонентов. Для каждого сплава экспериментально определяют критические точки, то есть температуры фазовых превращений. Полученные значения температур откладывают на вертикальных линиях в соответствии химическим составом сплавов [3]. Соединяя критические точки, получают линии диаграммы состояния. Диаграмма состояния показывает изменение равновесного состояния сплавов в зависимости от температуры и концентрации (рис. 5.1).
Рис. 5.1. Диаграмма состояния
Железо
Железо – металл сероватого цвета. Атомный номер 26. Чистое железо содержит 99,999 % Fe, технические сорта 99,8…99,9 %. Температура плавления железа 1539 С. Железо является полиморфным металлом.
До 911 С – кристаллическая решётка ОЦК (Feα),
911…1392 С – кристаллическая решётка ГЦК (Feγ),
1392…1539 – кристаллическая решётка ОЦК (Feα ,Feδ).
До температуры 768 С α-железо ферромагнитно, выше парамагнитно. Температуру 768 С, при которой происходит переход от ферромагнитного состояния к парамагнитному, называют точкой Кюри и обозначают А2 . Плотность α-железа – 7,68 г/см3 .
Критическую точку
перехода α![]() γ
при температуре 911 С
обозначают
при нагреве Ас3,
а при охлаждении Аr3
. Критическую
точку перехода γ
γ
при температуре 911 С
обозначают
при нагреве Ас3,
а при охлаждении Аr3
. Критическую
точку перехода γ![]() α
при температуре 1392 С
обозначают
при нагреве Ас4,
а при охлаждении Аr4.
α
при температуре 1392 С
обозначают
при нагреве Ас4,
а при охлаждении Аr4.
Железо, как и другие чистые металлы, обладает низкой твёрдостью и прочностью, но высокой пластичностью и вязкостью. Железо со многими элементами образует твёрдые растворы, причём с металлами – твёрдые растворы замещения, с неметаллами, в том числе с углеродом, – твёрдые растворы внедрения.
Твёрдый раствор внедрения углерода в α-железе называют ферритом. Он имеет ОЦК решётку.
Твёрдый раствор внедрения углерода в γ-железе называют аустенитом. Он имеет ГЦК решётку.
Растворимость углерода в γ-железе больше, чем в α-железе.
Углерод
Углерод – неметаллический элемент с атомным номером 6. Плотность углерода 2,5 г/см3. Температура плавления 3500 С. Углерод имеет две модификации: графит и алмаз. Графит имеет слоистую гексагональную решётку. Он очень мягок, имеет металлический блеск и низкое электросопротивление.
Железо с углеродом образует три химических соединения: 1) Fe3С (6,67 % С, остальное Fe). Это химическое соединение – карбид железа называется цементит; 2) Fe2С (9,68 % С, остальное Fe); 3) FeС (21, 5% С, остальное Fe) (рис. 5.2.).
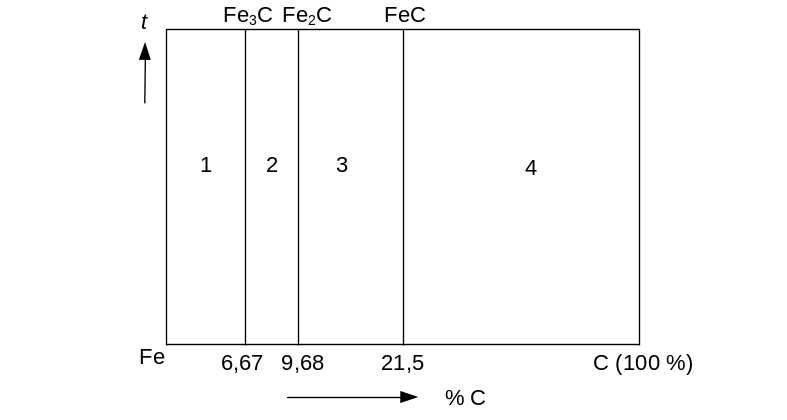
Рис. 5.2. Диаграмма состояния Fe–С
Диаграммы состояний, в которых имеются химические соединения, можно разбить на несколько самостоятельных диаграмм, считая эти соединения компонентами этих диаграмм.
Следовательно, диаграмму Fe–C можно разбить на четыре части: 1) Fe–Fe3C; 2) Fe3C–Fe2C; 3) Fe2C–FeC; 4) FeC–С.
Так как в промышленности в основном применяют железоуглеродистые сплавы с содержанием углерода до 5 %, то наибольший интерес представляет первая диаграмма Fe–Fe3C (железо–цементит).
Цементит
Цементит – химическое соединение железа с углеродом. Содержит 6,67 % С. Цементит имеет сложную ромбическую решётку. Температура плавления цементита точно не определена из-за его распада при нагреве (tпл1252 С). Цементит слабо ферромагнитен и теряет ферромагнетизм при температуре 210 С. Он имеет высокую твёрдость и хрупкость. В цементите могут растворяться другие элементы. Такой цементит называют легированным. Цементит является неустойчивым химическим соединением и может разлагаться на железо и углерод. Это процесс называется графитизацией.
