
- •М.П. Завгородній, м.М. Корнет, о.А. Бражко, л.О. Омельянчик біоорганічна хімія:
- •Частина 1
- •Тема 1. Класифікація і номенклатура біоорганічних сполук
- •Доповніть фразу:
- •Тема 2. Хімічний зв’язок та взаємний вплив атомів у біОорганічних сполуках
- •2.1. Електронна будова елементів-органогенів
- •Атомні орбіталі
- •2.1.2 Гібридизація орбіталей
- •Ковалентні зв'язки
- •2.2.2 Донорно-акцепторні зв'язки
- •2.2.3 Водневі зв'язки
- •2.3. Спряження і ароматичність
- •2.3.1 Системи з відкритим ланцюгом спряження
- •2.3.2 Системи із замкнутою системою спряження
- •2.3.3 Електронні ефекти
- •Тема 3. Стереоізомерія біоорганічних сполук
- •Тема 4. Спирти. Феноли
- •4.1 Спирти
- •Лабораторні роботи Робота 1. Визначення вмісту спирту в розчині
- •Робота 2. Відкриття наявності води в етанолі та його зневоднення
- •Робота 3. Відкриття у спирті-сирці сивушних масел
- •Робота 4. Розчинність одноатомних насичених спиртів у воді
- •Робота 5. Окиснення етанолу
- •Робота 6. Добування алканоляту натрію (етилату натрію)
- •Робота 8. Добування акролеїну з гліцерину
- •4.2 Феноли і нафтоли
- •Лабораторна робота Робота 1. Добування і розкладання феноляту натрію
- •Робота 2. Бромування фенолу
- •Робота 3. Нітрування фенолу
- •Робота 4. Сульфування фенолу
- •Робота 5. Утворення нафтолятів
- •Робота 6. Кольорові реакції фенолів і нафтолів з хлоридом феруму
- •Робота 7. Відновлення двох- і трьохатомними фенолами гідроксиду купруму (II)
- •Робота 8. Реакції конденсації фенолу і формальдегіду
- •Тема 5. Карбонільні сполуки (альдегіди і кетони)
- •Лабораторні роботи Робота 1. Добування фуксинсульфітної кислоти
- •Робота 2. Добування метаналю (формальдегіду)
- •Робота 3. Добування етаналю (ацетальдегіду) з етанолу
- •Робота 4. Добування ацетону
- •Робота 6. Реакція відновлення альдегідами реактиву Фелінга
- •Робота 7. Реакція «срібного дзеркала»
- •Робота 8. Деполімеризація параформу
- •Робота 9. Добування уротропіну
- •Робота 10. Окисні властивості хінону
- •Робота 11. Реакція дисмутації (реакція Канніццаро)
- •Робота 12. Якісні реакції на ацетон
- •Тема 6. Карбонові кислоти
- •6.1 Карбонові кислоти
- •Лабораторні роботи Робота 1. Дисоціація ацетатної кислоти
- •Робота 2. Добування ацетату феруму (III) та його гідроліз
- •Робота 3. Розкладання карбонату натрію ацетатною кислотою
- •Робота 4. Добування метанової (форміатної) кислоти з хлороформу
- •Робота 5. Розкладання метанової (мурашиної) кислоти
- •Робота 6. Добування вищих жирних кислот з їхніх солей
- •Робота 7. Розкладання етандіової (оксалатної) кислоти
- •Робота 8. Приєднання брому до олеїнової кислоти
- •Робота 9. Перетворення олеїнової кислоти на елаїдинову («елаїдинова проба»)
- •Робота 10. Окиснення олеїнової кислоти (за Вагнером)
- •Робота 13. Добування фенолфталеїну (пургену)
- •6.2 Фенолокислоти
- •Лабораторні роботи Робота 1. Розкладання саліцилової кислоти при нагріванні
- •Робота 2. Добування саліцилату натрію та його розкладання
- •Робота 3. Добування ацетилсаліцилової кислоти (аспірину)
- •Робота 4. Кольорова реакція на наявність у субстратах саліцилової кислоти
- •Робота 6. Відношення ацетилсаліцилової кислоти до хлориду феруму (III) до і після гідролізу
- •Робота 7. Взаємодія бензойної та саліцилової кислот з бромом
- •Робота 8. Кольорові реакції галової кислоти і таніну з хлоридом феруму (III)
- •Тема 7. Ефіри та аміди карбонових кислот
- •7.1. Етери (прості ефіри)
- •Лабораторні роботи Робота 1. Добування діетилового етеру
- •Робота 2. Визначення доброякісності етилового етеру
- •7.2 Естери (складні ефіри)
- •Лабораторні роботи Робота 1. Добування етилетаноату
- •Робота 2. Добування ізоамілетаноату
- •Робота 3. Добування ізоамілметилбутаноату
- •Робота 4. Добування етилбензоату
- •7.3 Аміди кислот
- •Лабораторні роботи Робота 1. Гідроліз сечовини
- •Робота 2. Утворення нітратної солі сечовини
- •Робота 3. Розкладання сечовини нітритною кислотою
- •Робота 4. Розкладання сечовини розчином гіпоброміду натрію (реакція Бородіна)
- •Робота 5. Біуретова реакція
- •Робота 6. Розкладання сечовини лугом
- •Робота 7. Утворення уреїдів оксалатної кислоти
- •Робота 8. Взаємодія ацетаміду з лугом
- •Рекомендована Література
- •Навчальне видання
- •Біоорганічна хімія:
- •Частина 1
2.2.2 Донорно-акцепторні зв'язки
Перекривання двох одноелектронних АО - не єдиний шлях утворення ковалентного зв'язку. Ковалентний зв'язок може утворюватися при взаємодії заповненої двохелектронної орбіталі одного атома (донора) з вакантною орбіталлю іншого атома (акцептора). Донорами є сполуки, що містять або орбіталі з неподільною парою електронів, або π-МО. Носіями неподільних пар електронів (п-електронів, від англ. - що не зв'язують) є атоми азоту, кисню, сірки, галогенів.

аміак метанол метаналь метилхлорид
Неподільні пари електронів відіграють важливу роль у прояві хімічних властивостей сполук. Зокрема, вони відповідають за здатність сполук вступати в донорно-акцепторну взаємодію.
Ковалентний зв'язок, що утворюється за рахунок пари електронів одного з партнерів по зв'язку, називається донорно-акцепторним, або координаційним.
Донор Акцептор
неподільна
пара електронів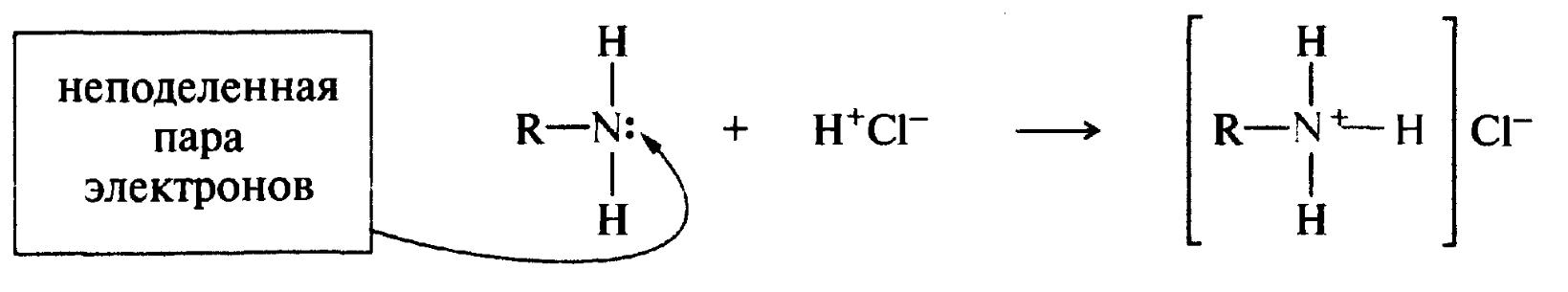
Первинний амін алкіламонійхлорид
Донорно-акцепторний зв'язок, що утворився, відрізняється тільки способом утворення; за властивостями він однаковий з іншими ковалентними зв'язками. У атома-донора при цьому переважає позитивний заряд.
Донорно-акцепторні зв'язки характерні для комплексних сполук, що називаються також донорно-акцепторними комплексами. Залежно від типу донора, тобто від того, які електрони усуспільнюються, комплекси класифікують як п- або π-комплекси.
Різновидом донорно-акцепторного зв'язку є біполярний (семиполярний) зв'язок, наприклад у нітрогрупі.
Біполярний зв'язок
Нітросполука
Одночасно з утворенням ковалентного зв'язку за рахунок неподільної пари електронів атома на зв'язаних атомах виникають протилежні за знаком заряди. Електростатичне поєднання ковалентних та іонних зв'язків дає біполярний зв'язок, характерною ознакою якого є наявність протилежних зарядів на ковалентно зв'язаних атомах.
Утворення донорно-акцепторного зв'язку може спостерігатися і в тих випадках, коли донорний та акцепторний атоми знаходяться всередині однієї молекули і внаслідок особливостей просторової будови зближені на відстань, достатню для їхньої взаємодії. Прикладом сполук з таким внутрішньо молекулярним координаційним зв'язком є силатрани, що часто проявляють високу біологічну активність.
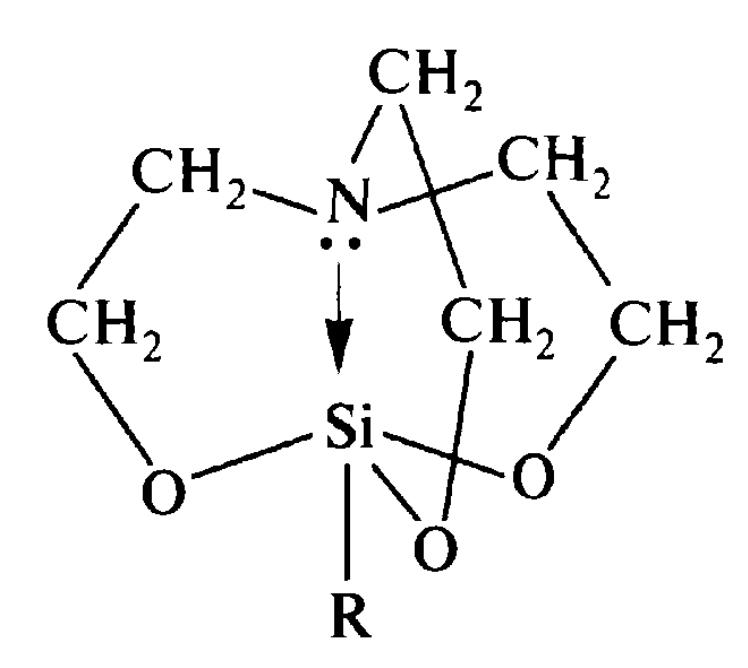
силатрани
(R=Hal, Alk, Ar та ін.)
2.2.3 Водневі зв'язки
Атом водню, пов'язаний з сильно електронегативним елементом (азотом, киснем, фтором та ін.), здатний взаємодіяти з неподільною парою електронів іншого досить електронегативного атома цієї ж самої або іншої молекули. В результаті виникає водневий зв'язок, що є різновидом донорно-акцепторного зв'язку. Графічно водневий зв'язок зазвичай позначається трьома крапками.
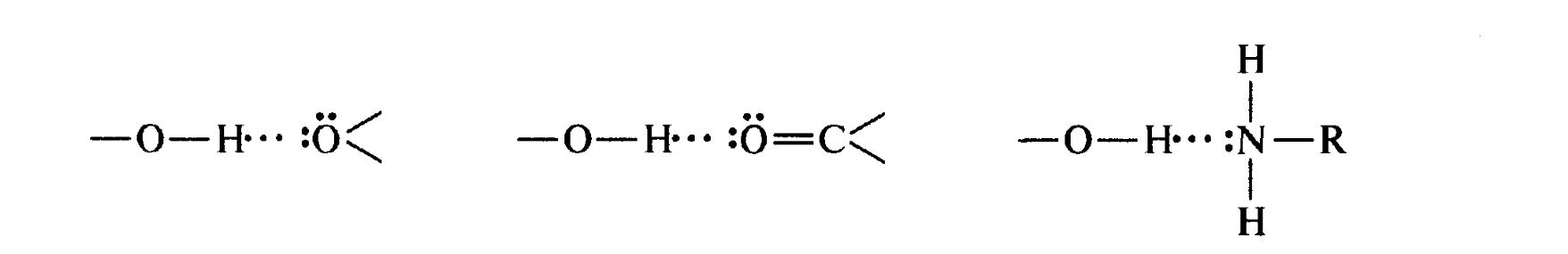
Енергія водневого зв'язку невелика (10-4- кДж/моль) і в основному визначається електростатичною взаємодією.
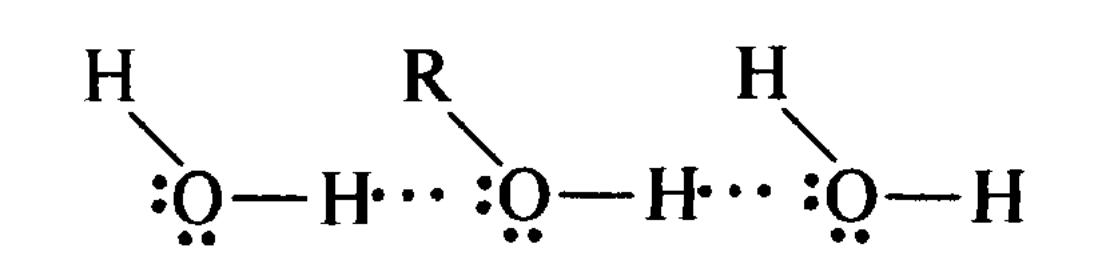
Міжмолекулярні водневі зв'язки обумовлюють асоціацію органічних сполук, наприклад спиртів.
Міжмолекулярний
водневий зв'язок
Внутрішньомолекулярний
водневий зв'язок
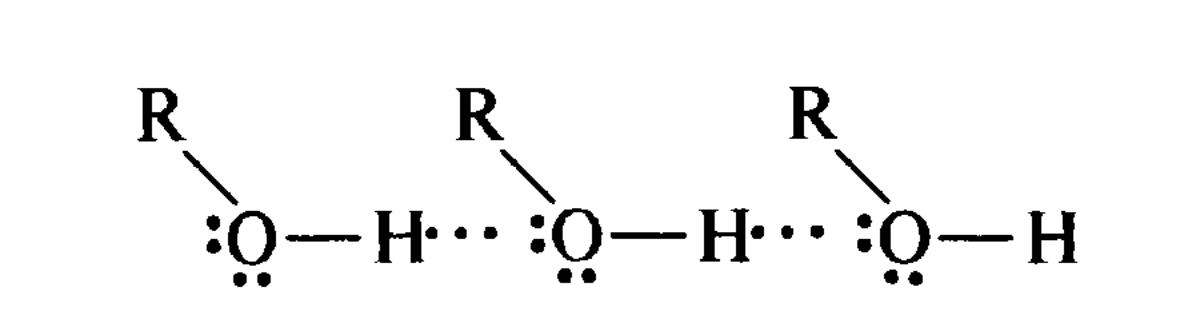
АСОЦІАЦІЯ МОЛЕКУЛ СПИРТУ
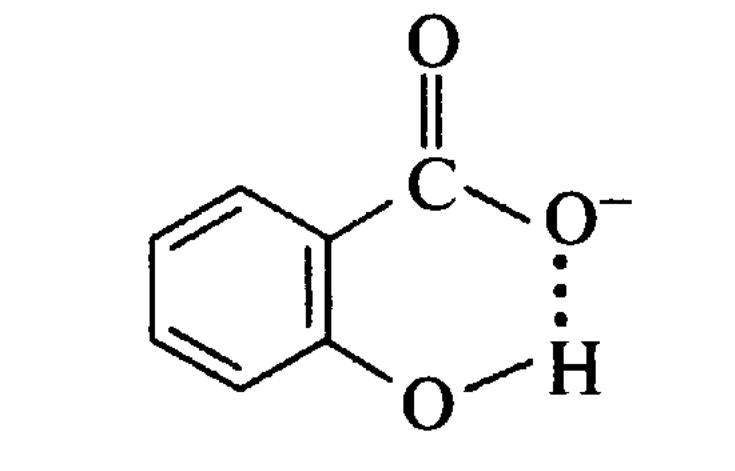
ГІДРАТАЦІЯ МОЛЕКУЛ СПИРТУ САЛІЦИЛАТ-ІОН
Водневі зв'язки впливають на фізичні (температура кипіння і плавлення, в'язкість, спектральні характеристики) і хімічні (кислотно-основні) властивості сполук. Так, температура кипіння етанолу С2Н5ОН (78,3°С) значно вища, ніж у ефіру диметилу СН3ОСН3 (-24° С), що має однакову з ним молекулярну масу й не асоціюється за рахунок міжмолекулярних водневих зв'язків. Органічні сполуки можуть взаємодіяти з розчинником, тобто сольватуватися, за рахунок міжмолекулярних водневих зв'язків. Наприклад, у водному розчині відбувається гідратація спиртів.
