
- •М.П. Завгородній, м.М. Корнет, о.А. Бражко, л.О. Омельянчик біоорганічна хімія:
- •Частина 1
- •Тема 1. Класифікація і номенклатура біоорганічних сполук
- •Доповніть фразу:
- •Тема 2. Хімічний зв’язок та взаємний вплив атомів у біОорганічних сполуках
- •2.1. Електронна будова елементів-органогенів
- •Атомні орбіталі
- •2.1.2 Гібридизація орбіталей
- •Ковалентні зв'язки
- •2.2.2 Донорно-акцепторні зв'язки
- •2.2.3 Водневі зв'язки
- •2.3. Спряження і ароматичність
- •2.3.1 Системи з відкритим ланцюгом спряження
- •2.3.2 Системи із замкнутою системою спряження
- •2.3.3 Електронні ефекти
- •Тема 3. Стереоізомерія біоорганічних сполук
- •Тема 4. Спирти. Феноли
- •4.1 Спирти
- •Лабораторні роботи Робота 1. Визначення вмісту спирту в розчині
- •Робота 2. Відкриття наявності води в етанолі та його зневоднення
- •Робота 3. Відкриття у спирті-сирці сивушних масел
- •Робота 4. Розчинність одноатомних насичених спиртів у воді
- •Робота 5. Окиснення етанолу
- •Робота 6. Добування алканоляту натрію (етилату натрію)
- •Робота 8. Добування акролеїну з гліцерину
- •4.2 Феноли і нафтоли
- •Лабораторна робота Робота 1. Добування і розкладання феноляту натрію
- •Робота 2. Бромування фенолу
- •Робота 3. Нітрування фенолу
- •Робота 4. Сульфування фенолу
- •Робота 5. Утворення нафтолятів
- •Робота 6. Кольорові реакції фенолів і нафтолів з хлоридом феруму
- •Робота 7. Відновлення двох- і трьохатомними фенолами гідроксиду купруму (II)
- •Робота 8. Реакції конденсації фенолу і формальдегіду
- •Тема 5. Карбонільні сполуки (альдегіди і кетони)
- •Лабораторні роботи Робота 1. Добування фуксинсульфітної кислоти
- •Робота 2. Добування метаналю (формальдегіду)
- •Робота 3. Добування етаналю (ацетальдегіду) з етанолу
- •Робота 4. Добування ацетону
- •Робота 6. Реакція відновлення альдегідами реактиву Фелінга
- •Робота 7. Реакція «срібного дзеркала»
- •Робота 8. Деполімеризація параформу
- •Робота 9. Добування уротропіну
- •Робота 10. Окисні властивості хінону
- •Робота 11. Реакція дисмутації (реакція Канніццаро)
- •Робота 12. Якісні реакції на ацетон
- •Тема 6. Карбонові кислоти
- •6.1 Карбонові кислоти
- •Лабораторні роботи Робота 1. Дисоціація ацетатної кислоти
- •Робота 2. Добування ацетату феруму (III) та його гідроліз
- •Робота 3. Розкладання карбонату натрію ацетатною кислотою
- •Робота 4. Добування метанової (форміатної) кислоти з хлороформу
- •Робота 5. Розкладання метанової (мурашиної) кислоти
- •Робота 6. Добування вищих жирних кислот з їхніх солей
- •Робота 7. Розкладання етандіової (оксалатної) кислоти
- •Робота 8. Приєднання брому до олеїнової кислоти
- •Робота 9. Перетворення олеїнової кислоти на елаїдинову («елаїдинова проба»)
- •Робота 10. Окиснення олеїнової кислоти (за Вагнером)
- •Робота 13. Добування фенолфталеїну (пургену)
- •6.2 Фенолокислоти
- •Лабораторні роботи Робота 1. Розкладання саліцилової кислоти при нагріванні
- •Робота 2. Добування саліцилату натрію та його розкладання
- •Робота 3. Добування ацетилсаліцилової кислоти (аспірину)
- •Робота 4. Кольорова реакція на наявність у субстратах саліцилової кислоти
- •Робота 6. Відношення ацетилсаліцилової кислоти до хлориду феруму (III) до і після гідролізу
- •Робота 7. Взаємодія бензойної та саліцилової кислот з бромом
- •Робота 8. Кольорові реакції галової кислоти і таніну з хлоридом феруму (III)
- •Тема 7. Ефіри та аміди карбонових кислот
- •7.1. Етери (прості ефіри)
- •Лабораторні роботи Робота 1. Добування діетилового етеру
- •Робота 2. Визначення доброякісності етилового етеру
- •7.2 Естери (складні ефіри)
- •Лабораторні роботи Робота 1. Добування етилетаноату
- •Робота 2. Добування ізоамілетаноату
- •Робота 3. Добування ізоамілметилбутаноату
- •Робота 4. Добування етилбензоату
- •7.3 Аміди кислот
- •Лабораторні роботи Робота 1. Гідроліз сечовини
- •Робота 2. Утворення нітратної солі сечовини
- •Робота 3. Розкладання сечовини нітритною кислотою
- •Робота 4. Розкладання сечовини розчином гіпоброміду натрію (реакція Бородіна)
- •Робота 5. Біуретова реакція
- •Робота 6. Розкладання сечовини лугом
- •Робота 7. Утворення уреїдів оксалатної кислоти
- •Робота 8. Взаємодія ацетаміду з лугом
- •Рекомендована Література
- •Навчальне видання
- •Біоорганічна хімія:
- •Частина 1
2.1.2 Гібридизація орбіталей
У хімії широко використовується уявлення про гібридні орбіталі атома вуглецю та інших елементів. Поняття про гібридизацію як спосіб опису перебудови орбіталей необхідно в тих випадках, коли кількість неспарених електронів в основному стані атома менша від кількості утворюваних зв'язків. Постулюється, що різні атомні орбіталі, що мають близькі значення рівня енергії, взаємодіють між собою, утворюючи гібридні орбіталі з однаковою формою та енергією.
Гібридні орбіталі за рахунок більшого перекривання утворюють міцніші зв'язки порівняно з негібридизованими орбіталями. Тип гібридизації визначає спрямованість гібридних АО у просторі, а отже, і геометрію молекул.
Залежно від кількості орбіталей, що вступили в гібридизацію, атом вуглецю може знаходитися в одному з трьох станів гібридизації.
sp3-Гібридизація. В результаті sp3- гібридизації (рис. 1.3, а) атом вуглецю з основного стану 1s22s22p2 (рис.1.4, а) за рахунок переміщення електрона з 2s- на 2p-орбіталь переходить у збуджений стан 1s22s22p3. При зміщенні чотирьох зовнішніх АO збудженого атома вуглецю (однієї 2s- і трьох 2p-орбіталей) виникають чотири рівноцінні sp3-гібридні орбіталі. Вони мають форму об'ємної вісімки, одна з лопатей якої значно більша за іншу. Внаслідок взаємного відштовхування гібридні АО спрямовані в просторі до вершин тетраедра і кути між ними дорівнюють 109,5° (найбільш вигідне положення).
Кожна гібридна орбіталь в атомі заповнюється одним електроном. Атом вуглецю у стані sp3-гібридизації має електронну конфігурацію 1s2 (2sp3)4 (рис. 1.4, б). Такий стан гібридизації характерний для атомів вуглецю в насичених вуглеводнях (алканах) і відповідно в алкільних радикалах їх похідних.
sp2-Гібридизація.
У результаті sp2-гібридизації за рахунок зміщення однієї 2s- і двох 2p-АO збудженого атома вуглецю утворюються три рівноцінні sp2-гібридні орбіталі, розташовані в одній площині під кутом 120° (рис. 1.3, б). Негібридизована 2pz-АO знаходиться в перпендикулярній площині. Атом вуглецю у стані sp2-гібридизації має електронну конфігурацію 1s2(2sp2)32p1 (рис. 1.4, в). Такий атом вуглецю характерний для ненасичених вуглеводнів (алкенів), а також для деяких функціональних груп, наприклад карбонільної, карбоксильної та ін.
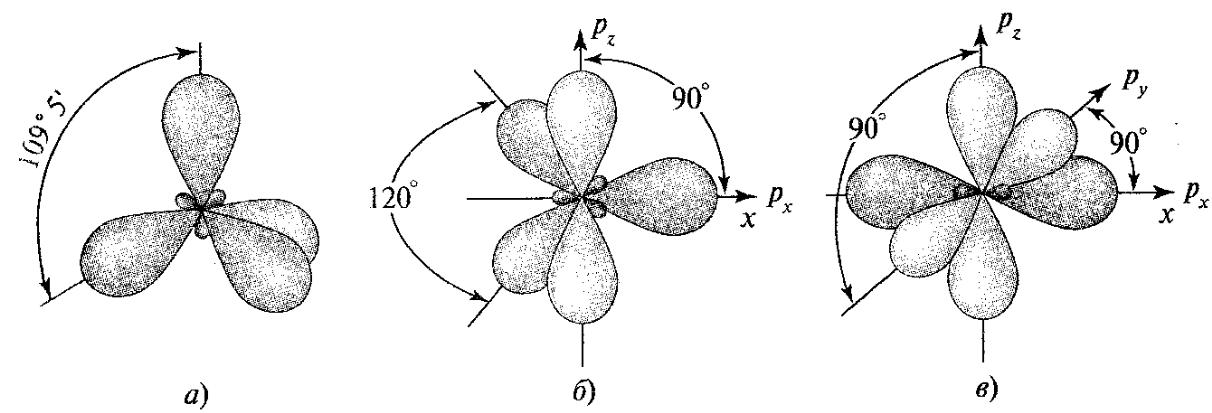
Рис. 1.3. Види гібридизації атома вуглецю (кольором показано негібридизовані р-АО)


Рис. 1.4. Розподіл електронів за орбіталями в атома вуглецю в основному і гібридизованих станах
sp-Гібридизація.
У результаті sp- гібридизації за рахунок зміщення однієї 2s- і однієї 2p-орбіталей збудженого атома вуглецю утворюються дві рівноцінні sp- гібридні АO, розташовані лінійно під кутом 180°.
Решта негібридизованих 2р-АО розташовується у взаємно перпендикулярних площинах. Атом вуглецю у стані sp-гібридизації має електронну конфігурацію 1s2(2sp)22p2 (рис. 1.4, г). Такий атом зустрічається у сполуках, що мають потрійний зв'язок, наприклад в алкінах, нітрилі.
У гібридизованому стані можуть знаходитися й атоми інших елементів. Наприклад, атом азоту в іоні амонію NH4+ і відповідно алкіламонію RNH3+, перебуває у стані гібридизації; у піролі й піридині – sp2-гібридизації; у нітрилі – sp-гібридизації.
