
- •М.П. Завгородній, м.М. Корнет, о.А. Бражко, л.О. Омельянчик біоорганічна хімія:
- •Частина 1
- •Тема 1. Класифікація і номенклатура біоорганічних сполук
- •Доповніть фразу:
- •Тема 2. Хімічний зв’язок та взаємний вплив атомів у біОорганічних сполуках
- •2.1. Електронна будова елементів-органогенів
- •Атомні орбіталі
- •2.1.2 Гібридизація орбіталей
- •Ковалентні зв'язки
- •2.2.2 Донорно-акцепторні зв'язки
- •2.2.3 Водневі зв'язки
- •2.3. Спряження і ароматичність
- •2.3.1 Системи з відкритим ланцюгом спряження
- •2.3.2 Системи із замкнутою системою спряження
- •2.3.3 Електронні ефекти
- •Тема 3. Стереоізомерія біоорганічних сполук
- •Тема 4. Спирти. Феноли
- •4.1 Спирти
- •Лабораторні роботи Робота 1. Визначення вмісту спирту в розчині
- •Робота 2. Відкриття наявності води в етанолі та його зневоднення
- •Робота 3. Відкриття у спирті-сирці сивушних масел
- •Робота 4. Розчинність одноатомних насичених спиртів у воді
- •Робота 5. Окиснення етанолу
- •Робота 6. Добування алканоляту натрію (етилату натрію)
- •Робота 8. Добування акролеїну з гліцерину
- •4.2 Феноли і нафтоли
- •Лабораторна робота Робота 1. Добування і розкладання феноляту натрію
- •Робота 2. Бромування фенолу
- •Робота 3. Нітрування фенолу
- •Робота 4. Сульфування фенолу
- •Робота 5. Утворення нафтолятів
- •Робота 6. Кольорові реакції фенолів і нафтолів з хлоридом феруму
- •Робота 7. Відновлення двох- і трьохатомними фенолами гідроксиду купруму (II)
- •Робота 8. Реакції конденсації фенолу і формальдегіду
- •Тема 5. Карбонільні сполуки (альдегіди і кетони)
- •Лабораторні роботи Робота 1. Добування фуксинсульфітної кислоти
- •Робота 2. Добування метаналю (формальдегіду)
- •Робота 3. Добування етаналю (ацетальдегіду) з етанолу
- •Робота 4. Добування ацетону
- •Робота 6. Реакція відновлення альдегідами реактиву Фелінга
- •Робота 7. Реакція «срібного дзеркала»
- •Робота 8. Деполімеризація параформу
- •Робота 9. Добування уротропіну
- •Робота 10. Окисні властивості хінону
- •Робота 11. Реакція дисмутації (реакція Канніццаро)
- •Робота 12. Якісні реакції на ацетон
- •Тема 6. Карбонові кислоти
- •6.1 Карбонові кислоти
- •Лабораторні роботи Робота 1. Дисоціація ацетатної кислоти
- •Робота 2. Добування ацетату феруму (III) та його гідроліз
- •Робота 3. Розкладання карбонату натрію ацетатною кислотою
- •Робота 4. Добування метанової (форміатної) кислоти з хлороформу
- •Робота 5. Розкладання метанової (мурашиної) кислоти
- •Робота 6. Добування вищих жирних кислот з їхніх солей
- •Робота 7. Розкладання етандіової (оксалатної) кислоти
- •Робота 8. Приєднання брому до олеїнової кислоти
- •Робота 9. Перетворення олеїнової кислоти на елаїдинову («елаїдинова проба»)
- •Робота 10. Окиснення олеїнової кислоти (за Вагнером)
- •Робота 13. Добування фенолфталеїну (пургену)
- •6.2 Фенолокислоти
- •Лабораторні роботи Робота 1. Розкладання саліцилової кислоти при нагріванні
- •Робота 2. Добування саліцилату натрію та його розкладання
- •Робота 3. Добування ацетилсаліцилової кислоти (аспірину)
- •Робота 4. Кольорова реакція на наявність у субстратах саліцилової кислоти
- •Робота 6. Відношення ацетилсаліцилової кислоти до хлориду феруму (III) до і після гідролізу
- •Робота 7. Взаємодія бензойної та саліцилової кислот з бромом
- •Робота 8. Кольорові реакції галової кислоти і таніну з хлоридом феруму (III)
- •Тема 7. Ефіри та аміди карбонових кислот
- •7.1. Етери (прості ефіри)
- •Лабораторні роботи Робота 1. Добування діетилового етеру
- •Робота 2. Визначення доброякісності етилового етеру
- •7.2 Естери (складні ефіри)
- •Лабораторні роботи Робота 1. Добування етилетаноату
- •Робота 2. Добування ізоамілетаноату
- •Робота 3. Добування ізоамілметилбутаноату
- •Робота 4. Добування етилбензоату
- •7.3 Аміди кислот
- •Лабораторні роботи Робота 1. Гідроліз сечовини
- •Робота 2. Утворення нітратної солі сечовини
- •Робота 3. Розкладання сечовини нітритною кислотою
- •Робота 4. Розкладання сечовини розчином гіпоброміду натрію (реакція Бородіна)
- •Робота 5. Біуретова реакція
- •Робота 6. Розкладання сечовини лугом
- •Робота 7. Утворення уреїдів оксалатної кислоти
- •Робота 8. Взаємодія ацетаміду з лугом
- •Рекомендована Література
- •Навчальне видання
- •Біоорганічна хімія:
- •Частина 1
Робота 7. Розкладання етандіової (оксалатної) кислоти
Етандіова (оксалатна, щавлева) кислота НООС–СООН – безбарвна кристалічна речовина, добре розчиняється у воді, плавиться при 189,5 °С, гігроскопічна, одна з найсильніших органічних кислот (К1= 5,9 • 10-2, К2= 6,4•10-5). Солі та етери етандіової (оксалатної) кислоти називають оксалатами. Міститься в листках щавлю у вигляді кислої калієвої солі НООС–COOK. Кристалізується з двома молекулами води у вигляді призм С2Н204*2Н20. Синтетично добувають швидким нагріванням (при 350 °С) з форміату натрію. Широко використовують у хімічному синтезі. Кристали оксалату кальцію – складова частина сечових каменів (кристали мають вигляд поштових конвертів). Оксалатна кислота слабша за кислотними властивостями від багатьох сильних мінеральних кислот.
Хід роботи. В суху пробірку поміщають щипку оксалатної кислоти (1–2г) і додають 1–2 мл концентрованої сульфатної кислоти. Пробірку закривають пробкою з газовідвідною трубкою. Кінець останньої занурюють у пробірку з гідроксидом барію або кальцію (баритовою або вапняною водою). Пробірку з оксалатною і сульфатною кислотами закріплюють ледь похило в штативі й обережно нагрівають на повільному вогні до рівномірного кипіння. Оксалатна кислота розкладається до вуглекислого газу та форміатної кислоти. При подальшому нагріванні відбувається розкладання до чадного газу й води. Для виявлення чадного газу газовідвідну трубку виймають із пробірки з баритовою (вапняною) водою і запалюють газову суміш, що виділяється з газовідвідної трубки, – вона горить синім полум'ям.
Хімізм. Розкладання оксалатної кислоти відбувається таким чином:
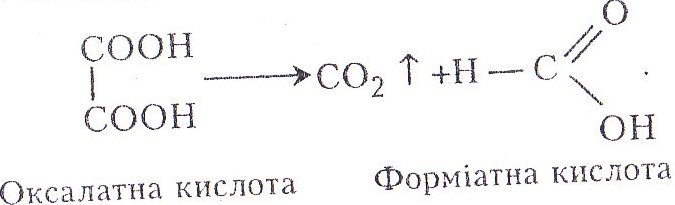
Вуглекислий газ, взаємодіючи з гідроксидом барію, утворює карбонати:
Ва(ОН)2 + С02 –›ВаС03↓+Н20.
При подальшому нагріванні форміатна кислота розкладається на оксид карбону (II) й воду:
![]()
Після запалювання оксиду карбону (II) утворюється вуглекислий газ:
2СО + 02 –› 2СО2
Робота 8. Приєднання брому до олеїнової кислоти
Олеїнова кислота С17Н33СООН, СН3(СН2)7СН=СН(СН2)7СООН – вища ненасичена жирна кислота, входить до складу майже всіх природних естерів гліцерину. Багаті на олеїнову кислоту олії – маслинова (80 % маси залишків ВЖК), мигдалева (77 %) і соняшникова (50–80 %). Олеїнова кислота – оліїста рідина, не розчиняється у воді, розчиняється в органічних розчинниках, кипить при 232 °С, густина d184 = 0,895. Добувають її гідролізом жирів і олій. Має всі властивості, характерні для кислот, а також ненасичених вуглеводнів. Використовується для виготовлення косметичних засобів, ліків (лінетолу – етилового етеру олеїнової кислоти), синтетичних каучуків, пластифікаторів тощо.
Хід роботи. У пробірку поміщають 4–5 крапель водної емульсії олеїнової кислоти, додають 3–4 краплі бромної води, ретельно перемішують. Бромна вода знебарвлюється.
Хімізм. При взаємодії з бромом (бромною водою) відбувається розривання подвійного зв'язку в радикалі олеїнової кислоти і утворюється тверда дибромстеаринова кислота:
СН3(СН2)7-СН=СН-(СН2)7СООН+Вг2 –›СН3(СН2)7СН(Вг)-СН(Вг)-(СН2)7-СООН
Олеїнова к-та Дибромстеаринова кислота
