
- •М.П. Завгородній, м.М. Корнет, о.А. Бражко, л.О. Омельянчик біоорганічна хімія:
- •Частина 1
- •Тема 1. Класифікація і номенклатура біоорганічних сполук
- •Доповніть фразу:
- •Тема 2. Хімічний зв’язок та взаємний вплив атомів у біОорганічних сполуках
- •2.1. Електронна будова елементів-органогенів
- •Атомні орбіталі
- •2.1.2 Гібридизація орбіталей
- •Ковалентні зв'язки
- •2.2.2 Донорно-акцепторні зв'язки
- •2.2.3 Водневі зв'язки
- •2.3. Спряження і ароматичність
- •2.3.1 Системи з відкритим ланцюгом спряження
- •2.3.2 Системи із замкнутою системою спряження
- •2.3.3 Електронні ефекти
- •Тема 3. Стереоізомерія біоорганічних сполук
- •Тема 4. Спирти. Феноли
- •4.1 Спирти
- •Лабораторні роботи Робота 1. Визначення вмісту спирту в розчині
- •Робота 2. Відкриття наявності води в етанолі та його зневоднення
- •Робота 3. Відкриття у спирті-сирці сивушних масел
- •Робота 4. Розчинність одноатомних насичених спиртів у воді
- •Робота 5. Окиснення етанолу
- •Робота 6. Добування алканоляту натрію (етилату натрію)
- •Робота 8. Добування акролеїну з гліцерину
- •4.2 Феноли і нафтоли
- •Лабораторна робота Робота 1. Добування і розкладання феноляту натрію
- •Робота 2. Бромування фенолу
- •Робота 3. Нітрування фенолу
- •Робота 4. Сульфування фенолу
- •Робота 5. Утворення нафтолятів
- •Робота 6. Кольорові реакції фенолів і нафтолів з хлоридом феруму
- •Робота 7. Відновлення двох- і трьохатомними фенолами гідроксиду купруму (II)
- •Робота 8. Реакції конденсації фенолу і формальдегіду
- •Тема 5. Карбонільні сполуки (альдегіди і кетони)
- •Лабораторні роботи Робота 1. Добування фуксинсульфітної кислоти
- •Робота 2. Добування метаналю (формальдегіду)
- •Робота 3. Добування етаналю (ацетальдегіду) з етанолу
- •Робота 4. Добування ацетону
- •Робота 6. Реакція відновлення альдегідами реактиву Фелінга
- •Робота 7. Реакція «срібного дзеркала»
- •Робота 8. Деполімеризація параформу
- •Робота 9. Добування уротропіну
- •Робота 10. Окисні властивості хінону
- •Робота 11. Реакція дисмутації (реакція Канніццаро)
- •Робота 12. Якісні реакції на ацетон
- •Тема 6. Карбонові кислоти
- •6.1 Карбонові кислоти
- •Лабораторні роботи Робота 1. Дисоціація ацетатної кислоти
- •Робота 2. Добування ацетату феруму (III) та його гідроліз
- •Робота 3. Розкладання карбонату натрію ацетатною кислотою
- •Робота 4. Добування метанової (форміатної) кислоти з хлороформу
- •Робота 5. Розкладання метанової (мурашиної) кислоти
- •Робота 6. Добування вищих жирних кислот з їхніх солей
- •Робота 7. Розкладання етандіової (оксалатної) кислоти
- •Робота 8. Приєднання брому до олеїнової кислоти
- •Робота 9. Перетворення олеїнової кислоти на елаїдинову («елаїдинова проба»)
- •Робота 10. Окиснення олеїнової кислоти (за Вагнером)
- •Робота 13. Добування фенолфталеїну (пургену)
- •6.2 Фенолокислоти
- •Лабораторні роботи Робота 1. Розкладання саліцилової кислоти при нагріванні
- •Робота 2. Добування саліцилату натрію та його розкладання
- •Робота 3. Добування ацетилсаліцилової кислоти (аспірину)
- •Робота 4. Кольорова реакція на наявність у субстратах саліцилової кислоти
- •Робота 6. Відношення ацетилсаліцилової кислоти до хлориду феруму (III) до і після гідролізу
- •Робота 7. Взаємодія бензойної та саліцилової кислот з бромом
- •Робота 8. Кольорові реакції галової кислоти і таніну з хлоридом феруму (III)
- •Тема 7. Ефіри та аміди карбонових кислот
- •7.1. Етери (прості ефіри)
- •Лабораторні роботи Робота 1. Добування діетилового етеру
- •Робота 2. Визначення доброякісності етилового етеру
- •7.2 Естери (складні ефіри)
- •Лабораторні роботи Робота 1. Добування етилетаноату
- •Робота 2. Добування ізоамілетаноату
- •Робота 3. Добування ізоамілметилбутаноату
- •Робота 4. Добування етилбензоату
- •7.3 Аміди кислот
- •Лабораторні роботи Робота 1. Гідроліз сечовини
- •Робота 2. Утворення нітратної солі сечовини
- •Робота 3. Розкладання сечовини нітритною кислотою
- •Робота 4. Розкладання сечовини розчином гіпоброміду натрію (реакція Бородіна)
- •Робота 5. Біуретова реакція
- •Робота 6. Розкладання сечовини лугом
- •Робота 7. Утворення уреїдів оксалатної кислоти
- •Робота 8. Взаємодія ацетаміду з лугом
- •Рекомендована Література
- •Навчальне видання
- •Біоорганічна хімія:
- •Частина 1
2.3.3 Електронні ефекти
Індуктивний ефект. Наявність у молекулі полярного σ-зв'язку викликає поляризацію найближчих зв'язків і зумовлює виникнення часткових зарядів на сусідніх атомах.

Таким чином, замісники викликають поляризацію не лише "свого", але й сусідніх σ-зв'язків. Цей вид передачі впливу атомів прийнято називати індуктивним ефектом (І-ефект).
Індуктивний ефект - це передача електронного впливу замісників за рахунок зміщення електронів σ-зв'язків.
Індуктивний ефект через слабку поляризованість σ-зв'язку затухає через три-чотири зв'язки в ланцюзі. Його дія найсильніше проявляється стосовно до атома вуглецю, сусіднього з тим, у якого знаходяться замісники.
Напрям індуктивного ефекту замісника прийнято якісно оцінювати шляхом порівняння з атомом водню, індуктивний ефект якого прийнятий за нуль. Графічно дію І-ефекту зображують стрілкою, що співпадає з положенням валентної риски і спрямована вістрям у бік більш електронегативного атома.
Замісник (Х), що притягує електронну щільність σ-зв'язку, і сильніше, ніж атом водню, проявляє негативний індуктивний ефект (-І).
Такі замісники в цілому знижують електронну щільність системи, і їх називають електроноакцепторними. До них належить більшість функціональних груп (галогени, OH, NO2, COOH та ін. ) і катіони.
Замісник (Y), що зміщує порівняно з атомом водню електронну щільність зв'язку в бік вуглецевого ланцюга, проявляє позитивний індуктивний ефект (+І).
Такі замісники зумовлюють підвищення електронної щільності в ланцюзі й називаються електронодонорними. До них належать алкільні (метильні, етильні та ін.) групи, метали і аніони.
Мезомерний ефект. На відмінну від неспряжених сполук, в яких електронний вплив замісників передається по σ-зв'язках (індуктивний ефект), у спряжених системах у передачі електронного впливу основну роль відіграють π-електрони делокалізованих ковалентних зв'язків. Ефект, що проявляється в зміщенні електронної щільності делокалізованої (спряженої) π-системи, називають мезомерним ефектом (М-ефект) або ефектом спряження.
Мезомерний ефект - передача електронного впливу замісників по спряженій системі.
При цьому замісник сам є учасником спряженої системи. Він може вносити в систему спряження π-зв'язок (карбонільна, карбоксильна й інші групи), неподільну пару електронів гетероатома (галогени, аміно- і гідроксигрупи), вакантну чи заповнену одним або двома електронами р-АО.
Замісники, що підвищують електронну щільність у спряженій системі, проявляють позитивний мезомерний ефект (+М).
+М-ефект мають замісники, що містять атоми з неподільною парою електронів або цілим негативним зарядом. Ці замісники здатні до передачі пари електронів у загальну зв'язану систему, тобто є електронодонорними.
Замісники, що знижують електронну щільність у спряженій системі, проявляють негативний мезомерний ефект (- М).
-М-ефект мають ненасичені угрупування й позитивно заряджені атоми, тобто електроноакцепторні замісники.
Графічно зміщення електронної щільності позначається зігнутими стрілками, початок яких показує, які р- чи π-електрони зміщуються, а кінець - зв'язок або атом, до яких вони зміщуються. На відміну від індуктивного мезомерний ефект передається за системою зв'язаних зв'язків на значно більшу відстань.
У наведених нижче прикладах показано прояв - М-ефекту карбонільної групи в акролеїні і бензальдегіді, а також +М-ефекту аміногрупи в аніліні.
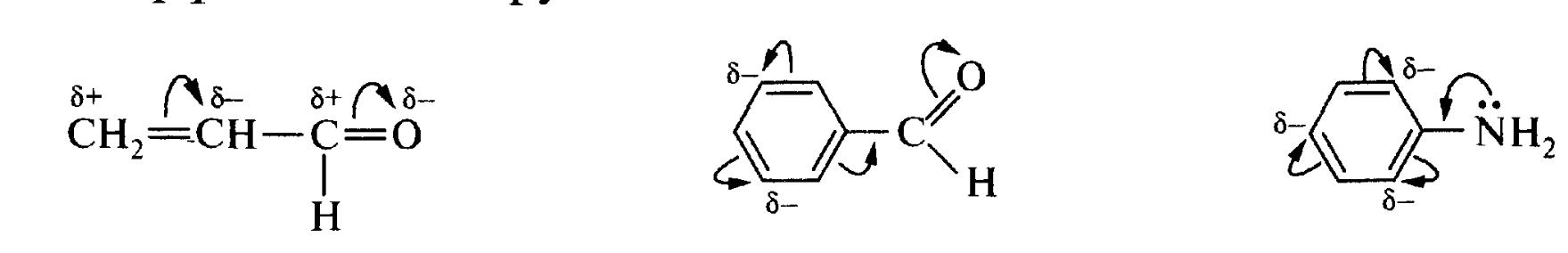
акролеїн бензальдегід анілін
Таблиця 1.4. Електронні ефекти деяких замісників
Замісник |
Електронні ефекти |
Характер сумісної дії |
|
індуктивний |
мезомерний |
||
Алкільні групи (R) |
+I |
- |
Електронодонорний |
―O- |
+I |
+M |
|
―NH2 ,―NHR,―NR2 |
-I |
+M |
|
―OH |
-I |
+M |
|
Алкоксигрупи (―OR) |
-I |
+M |
|
―NH3+ ,―NR+ |
-I |
- |
Електроноакцепторний |
Галогени (F, Cl, Br, I) |
-I |
+M |
|
―NO2 |
-I |
-M |
|
―SO3H |
-I |
-M |
|
―COOH, ―COOR |
-I |
-M |
|
>C═O |
-I |
-M |
|
При оцінюванні впливу замісників на розподіл електронної щільності в молекулі необхідно враховувати результативну дію індуктивного й мезомерного ефектів. Електронні ефекти деяких замісників підсумовано в таблиці 1.4.
Електронні ефекти замісників є важливим чинником, що дозволяє дати якісну оцінку розподілу електронної щільності в нереагуючій молекулі й прогнозувати її властивості. Таким чином, електронні ефекти лежать в основі сучасної інтерпретації вчення А.М. Бутлерова про взаємний вплив атомів у молекулі.
Контрольні запитання
Яку електронну будову мають елементи органогени?
Що являє собою гібридизація орбіталей? Яка її функція?
Охарактеризуйте ковалентні зв’язки.
Дайте характеристику донорно-акцепторним зв’язкам.
Дайте характеристику водневим зв’язкам.
Які системи спряження вам відомі? Дайте характеристику поняття «ароматичність».
Які електронні ефекти можливі для органічних молекул?
Література
Основна: 1-3, 5; додаткова: 2,3, 5-7.
