
- •По химии
- •© Филиал «Угреша»
- •Лекция 1 Основные законы и понятия химии
- •Система единиц си
- •Порядок величин масс (в г)
- •Если бы в результате какой-либо мировой катастрофы
- •Моль, число Авогадро
- •Расчет эквивалентных масс
- •Понятие валентности и степени окисления
- •Основные классы неорганических соединений
- •Неорганические соединения
- •Простые вещества
- •Сравнительная характеристика классов простых веществ
- •К лассификация сложных веществ
- •Лекция 3 Электронное строение атомов элементов
- •Диссоциация
- •Волновые числа различных типов излучения
- •Электронные орбиты некоторых атомов
- •Специальные системы обозначения орбитали
- •Лекция 4 Периодический закон и периодическая система. Принципы электронного строения и периодическая система элементов д.И.Менделеева
- •Периодическая система элементов
- •Структура периодической таблицы элементов
- •Принцип дополнительности Нильса Бора
- •Основные виды связей
- •Относительные электроотрицательности элементов ( по Полингу)
- •Начала химической термодинамики. Первый закон термодинамики. Термохимия
- •Основные понятия и определения
- •Термодинамические параметры
- •Функции состояния термодинамической системы
- •I закон термодинамики
- •Энергетические эффекты
- •Стандартные тепловые эффекты
- •Энергетика химических процессов
- •Лекция 7 Второй закон термодинамики. Энтальпийный и энтропийный факторы процесса. Энергия Гиббса
- •Необратимые и обратимые реакции
- •Признаки истинного (устойчивого) равновесия
- •Изменение энтропии
- •Энтальпийный и энтропийный факторы процесса. Энергия Гиббса
- •Исходные Величина Продукты Исходные Продукты
- •III закон термодинамики
- •Лекция 8 Кинетика химических реакций
- •Влияние температуры на скорость реакции
- •Катализ
- •Химическое равновесие. Окислительно-восстановительные процессы и реакции
- •Водные растворы в неорганической химии
- •Водные растворы в неорганической химии (продолжение)
- •Водные растворы в неорганической химии Гидролиз солей
- •Различные формы состояния вещества. Свойства и закономерности поведения дисперсных систем
- •Введение в органическую химию. Строение органических соединений
- •Теория химического строения органических соединений а.М. Бутлерова
- •Важнейшие органические и неорганические полимеры, их строение и классификация
- •Методы получения и физико-химические свойства полимеров
- •Ряд стандартных электродных потенциалов
Теория химического строения органических соединений а.М. Бутлерова
1961 г.
Основные положения теории строения сводятся к следующему:
1) в молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связи атомов называется химическим строением;
2) свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы;
3) атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга.
В теории химического строения большое внимание уделяется взаимному влиянию атомов и групп атомов в молекуле.
Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются структурными формулами или формулами строения.
Значение теории химического строения А.М. Бутлерова:
1) является важнейшей частью теоретического фундамента органической химии;
2) по значимости ее можно сопоставить с Периодической системой элементов Д.И. Менделеева;
3) она дала возможность систематизировать огромный практический материал;
4) дала возможность заранее предсказать существование новых веществ, а также указать пути их получения.
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомеры – это вещества, которые имеют одинаковый состав и одинаковую молярную массу, но различное строение молекул, а потому обладающие разными свойствами.
Например, бутан C4H10 отличается тем, что имеет два изомера: нормальный бутан с неразветвленной углеродной цепью и изобутан с разветвленной цепью.
CH3–CH2–CH2–CH3(нормальный бутан)
CH3
│
CH3–CH–CH3(изобутан)
Гомологические ряды органических соединений
Среди многообразия органических соединений можно выделить группы веществ, которые сходны по химическим свойствам и отличаются друг от друга на группу СН2.
Гомологи – это соединения, сходные по химическим свойствам, состав которых отличается друг от друга на одну или несколько групп СН2.
Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд.
Гомологическая разность – это группы СН2.
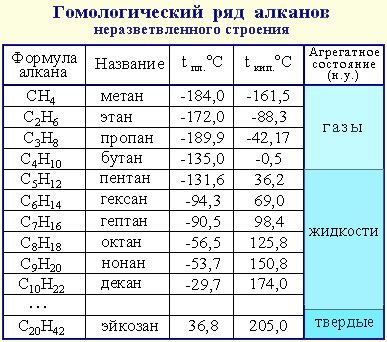
Примером гомологического ряда может служить ряд предельных углеводородов (алканов).
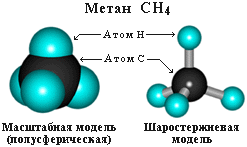
Простейший его представитель – метан СН4.
Формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности.
Состав молекул всех членов гомологического ряда может быть выражен одной общей формулой, например: СnН2n + 2, где n – число атомов углерода.
Гомологические ряды могут быть построены для всех классов органических соединений. Зная свойства одного из членов гомологического ряда, можно сделать выводы о свойствах других представителей того же ряда. Это обусловливает важность понятия гомологии при изучении органической химии.
Классификация органических соединений.
Все органические соединения в зависимости от природы углеродного скелета и его состава делят на 3 ряда:
1 ряд ациклические (нециклические, цепные) - соединения с открытой цепью атомов углерода называют также жирными или алифатическими.
Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры.
В зависимости от характера связей между атомами углерода, эти соединения подразделяют на предельные (или насыщенные), содержащие в молекулах только простые (одинарные) связи, и непредельные (или ненасыщенные), в молекулах которых имеются кратные (двойные или тройные) связи между атомами углерода.
Среди циклических соединений (соединения с замкнутой цепью атомов) обычно выделяют:
2 ряд карбоциклические – молекулы которых содержат кольца из углеродных атомов;
3 ряд гетероциклические – кольца которых содержат, кроме углерода, атомы других элементов (кислорода, серы, азота и др.).
Карбоциклические соединения подразделяются:
1) на алициклические (предельные и непредельные), похожие по свойствам на алифатические;
2) ароматические – содержат бензольные кольца.
Соединения каждого из указанных рядов подразделяются на классы.
В рядах ациклических и карбоциклических соединений простейшими являются углеводороды, состоящие только из атомов углерода и водорода. Все остальные соединения этих рядов рассматривают как производные углеводородов, образованные замещением одного, двух или нескольких атомов водорода в углеводородной молекуле другими атомами или группами атомов.
Остатки углеводородов, образующиеся при отнятии от их молекул одного, двух или нескольких атомов водорода, называют углеводородными радикалами:
R ─ - одновалентный радикал;
─ R ─ ( R<) - двухвалентный радикал;
─ R < - трехвалентный радикал
Свойства свободных радикалов: 1) обычно очень неустойчивы; 2) химически весьма активны; 3) быстро превращаются в устойчивые молекулы
Функциональные группы – это группы атомов, замещающие водород в углеводородной основе, которые определяют химические свойства данного класса соединений. Наличие этих групп позволяет разделить типы органических соединений на классы и облегчить их изучение.
Галогенпроизводные углеводородов
R ─ F R ─ Cl R ─ Br R ─ I
фторпроизводные хлорпроизводные бромпроизводные ищдпроизводные
Кислородсодержащие соединения
R ─ОН R ─ O ─ R или R ─ O ─ R′
спирты и фенолы простые эфиры
и другие.
Классы соединений: а) спирты; б) фенолы; в) альдегиды; г) кетоны; д) карбоновые кислоты; е) нитросоединения; ж) первичные амины; з) амиды кислот.
Номенклатура
Номенклатура алканов и их производных.
По номенклатуре ИЮПАК названия предельных углеводородов (алканов) характеризуются суффиксом -ан. Первые четыре углеводорода носят исторически сложившиеся названия; начиная с пятого, в основе названия углеводорода лежит греческое название соответствующего числа углеродных атомов. Углеводороды, в которых все атомы углерода расположены в одну цепь, называются нормальными. Углеводороды с нормальной цепью углеродных атомов имеют следующие названия:
СН4 - метан
С2Н6 - этан
С3Н8 - пропан
С4Н10 - бутан
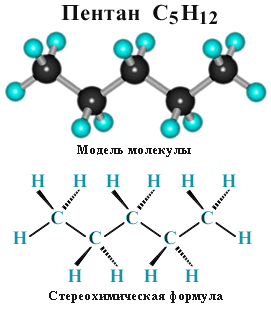
С5Н12 - пентан
С6Н14 - гексан
С7Н16 - гептан
С8Н18 - октан
С9Н20 - нонан
С10Н22 - декан
Названия углеводородов с разветвленными цепями строятся следующим образом:
1. За основу названия данного соединения берут название углеводорода, соответствующее числу углеродных атомов главной цепи:
главной цепью углеродных атомов считают самую длинную;
если в углеводороде можно выделить две или несколько одинаково длинных цепей, то за главную выбирают ту из них, которая имеет наибольшее число разветвлений.
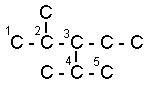
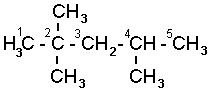
2,2,4-триметилпентан
2. После установления главной цепи необходимо пронумеровать углеродные атомы. Нумерацию начинают с того конца цепи, к которому ближе примыкает любой из алкилов. Если разные алкилы находятся на равном удалении от обоих концов цепи, то нумерацию начинают с того конца, к которому ближе радикал с меньшим числом углеродных атомов (метил, этил, пропил и т. д.).
Если же одинаковые радикалы, определяющие начало нумерации, находятся на равном удалении от обоих концов цепи, но с одной стороны их имеется большее число, чем с другой, то нумерацию начинают с того конца, где число разветвлений больше.
Называя соединение, сначала перечисляют заместители в алфавитном порядке (числительные не принимают во внимание), причем перед названием радикала ставят цифру, соответствующую номеру углеродного атома главной цепи, при котором находится данный радикал. После этого называют углеводород, соответствующей главной цепи углеродных атомов, отделяя слово от цифр дефисом.
Если углеводород содержит несколько одинаковых радикалов, то число их обозначают греческим числительным (ди, три, тетра и т. д.) и ставят перед названием этих радикалов, а их положение указывают, как обычно, цифрами, причем цифры разделяют запятыми, располагая в порядке их возрастания и ставят перед названием данных радикалов, отделяя их от него дефисом. Для простейших углеводородов изостроения сохраняются их несистематические названия (изобутан, изопентан, изопентан, изогексан).
Радикалы называют, заменяя суффикс -ан в названии углеводорода на -ил:
СН4 - метил
С2Н6 - этил
С3Н8 - пропил
С4Н10 - бутил
С5Н12 - пентил
С6Н14 - гексил и т.д.
При построении названия сложных радикалов нумерацию их атомов начинают от углеродного атома со свободной валентностью.
Двухвалентные радикалы называют, добавляя к названию углеводорода суффикс -илен (кроме «метилен»)
Задачи
1. Каковы особенности электронного строения атома углерода? Какие виды гибридизации реализуются при образовании им ковалентных связей?
2. Каковы основные положения теории строения органических веществ А.М. Бутлерова?
3. Составьте структурные формулы всех изомеров состава: а) С5Н12; б) С7Н16. Среди этих изомеров отметьте углеводороды нормального и изостроения. Все изомеры назовите по систематической номенклатуре.
4. Напишите формулы следующих углеводородов: а) 2,3-диэтилпентан; б) 2,2- диметилпропан; в) 2-метил-3-этилпентан.
5. Какие из нижеприведенных соединений являются гомологами метана:
С2Н4; С3Н8; С10Н20; С6Н6; С6Н12; С12Н26?
Лекция 15
Строение и свойства важнейших классов органических соединений
Предельные углеводороды
Строение
. Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы:
метан Н этан Н Н пропан Н Н Н
│ │ │ │ │ │
Н ─ С ─ Н Н─С ─ С─ Н Н─ С ─ С ─ С ─ Н
│ │ │ │ │ │
Н Н Н Н Н Н
. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 - для углерода и 2.1 - для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул:
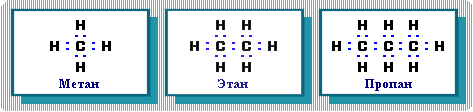
Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации. Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации. В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (s-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя s-связи С-Н или С-С.
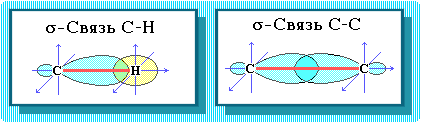
Физические свойства
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Галогенирование:
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть
CH4 + Cl2 → CH3Cl (хлорметан) + HCl
CH3Cl + Cl2 → CH2Cl2 (дихлорметан) + HCl
CH2Cl2 + Cl2 → CHCl3 (трихлорметан) + HCl
CHCl3 + Cl2 → CCl4 (тетрахлорметан) + HCl.
Нитрование (реакция Коновалова)
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.
RH + HNO3 = RNO2 + H2O
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 = CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2= nCO2 + (n+1)H2O
Каталитическое окисление
Могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 (катализатор, кислород, 200 °C) могут образоваться:
· метиловый спирт: СН4 + О2 = СН3ОН
· формальдегид: СН4 + О2 = СН2О + Н2O
· муравьиная кислота: СН4 + О2 = НСООН
Термические превращения алканов
Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH4 = C + 2H2 (t > 1000 °C)
C2H6 = 2C + 3H2
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
Для метана:
CH4 = С + 2H2 -- при 1000 °C
Частичный крекинг:
2CH4 = C2H2 + 3H2 -- при 1500 °C
Дегидрирование
Условия протекания: 400--600 °C, катализаторы -- Pt, Ni, Al2O3, Cr2O3
а)CH3-CH3 = CH2=CH2 + H2 (этан > этен)
б)CH3-CH2-CH3 = CH2=CH-CH3 + H2 (пропан > пропен)
в)CH3-CH2-CH2-CH3 = CH2=CH-CH=CH2 + H2 (бутан > бутадиен-1,3)


г) CH3-CH2-CH2-CH2-CH2-CH3 = +4Н2 (гексан > бензол)
Изомеризация
Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
Конверсия метана
В присутствии никелевого катализатора протекает реакция:
CH4 + H2O = CO + H2
Непредельные углеводороды
Строение
Простейший непредельный углеводород с двойной связью - этилен С2Н4 (СН2=СН2) начинает ряд этиленовых углеводородов (алкены). Состав любого углеводорода этого ряда выражает формула СnH2n (где n - число атомов углерода).
Состав членов гомологического ряда непредельных ацетиленовых (алкины) углеводородов ( стройной связью), родоначальником которых является ацетилен С2Н2 или СН≡СН, выражается общей формулой СnH2n-2.
Общая формула СnH2n-2 выражает также состав углеводородов с двумя двойными связями
С4Н6 - бутадиен (дивинил) СН2= СН ─ СН =СН2
С5Н8 - 2-метилбитадиен (изопрен) СН2=С─СН=СН2
│
СН3
Известны углеводороды с большим числом двойных (полиены) и тройных (полиины) связей.
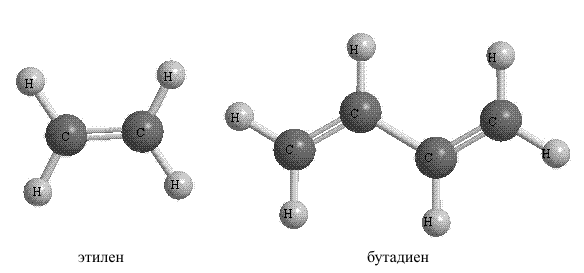
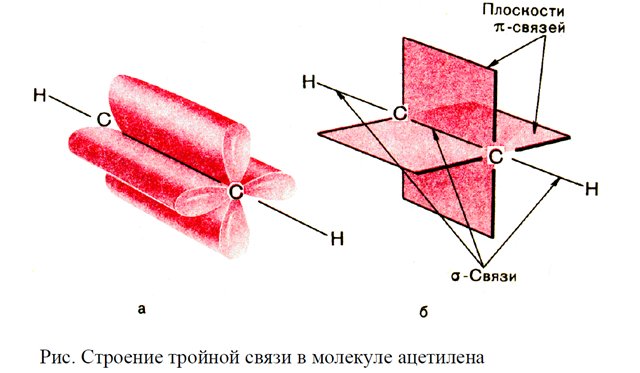
Физические свойства этиленовых и ацетиленовых углеводородов в гомологических рядах изменяются с той же закономерностью, что и у предельных; низшие представители - газы, более сложные - жидкости, а затем - вещества с постепенно возрастающими температурами плавления и кипения, находящимися при обычных условиях в твердом состоянии.
Химические свойства
По химическим свойствам непредельные углеводороды резко отличаются от предельных; они исключительно реакционноспособны и вступают в разнообразные реакции присоединения. Такие реакции происходят путем присоединения атомов или групп атомов к атомам углерода, связанным двойной или тройной связью. При этом кратные связи довольно легко разрываются и превращаются в простые.
Реакции присоединения (гагогенирование, гидрирование, гидрогалогенирование, гидротация, сульфатация)
СН2=СН2 + Br2 → CH2Br ─ CH2Br
этилен дибромэтилен
СH≡CH + Br2 → CHBr = CHBr ++ Br2 →CHBr2─ CHBr2
ацетилен дибромэтилен тетрабромэтилен
Окисление
СН2=СН2 + О2 → 2СО2 + 2Н2О
Окисление перманганатом калия KMnO4 (качественная реакция)
3 СН2=СН2 + KMnO4 (разбавленный р-р) +4Н2О→3 CH2−CH2+ 2MnO2 + 2KOH
│ │
ОН ОН
этиленгликоль
О О
t,0C ║ ║
CH3−CH=CH−CH2−CH3 + KMnO4 (концентр. р-р) + Н2SO4 → CН3−С + С − СН2−СН3 +.......
│ │
ОН ОН
уксусная к-та пропионовая к-та
Реакция полимеризации
Полимеризация вызывается нагреванием, давлением, облучением, действием свободных радикалов или катализаторов. В упрощенном виде такую реакцию на примере этилена можно представить следующим образом:
kat
n СН2=СН2 → (− CH − CH −)n
этилен полиэтилен
Cпирты
Спирты - производные предельных или непредельных углеводородов, в молекулах которых один или несколько атомов водорода заменены гидроксильными группами.
Одноатомные спирты
СН4 - метан СН3 ─ ОН - метанол
СН3 ─СН3 - этан СН3 ─ СН2 ─ ОН - этанол
Многоатомные спирты
СН2 ─СН2 СН2 ─СН ─СН2
│ │ │ │ │
ОН ОН ОН ОН ОН
этиленгликоль глицерин
Подобно молекулам воды, молекулы низших спиртов связываются между собой водородными связями. Поэтому они имеют более высокие температуры кипения, чем углеводороды, производными которых они являются, и чем другие углеводороды с таким же составом и молекулярной массой, но не содержащие гидроксильных групп. Спирты практически не являются электролитами.
Химические свойства
1. Взаимодействие с металлами
2СН3 ─ СН2─ ОН + 2Na → 2СН3 ─ СН2─ ОNa + H2↑
этиловый спирт этилат натрия
Алкоголяты легко гидролизуются
СН3 ─ СН2─ ОNa + H2О → СН3 ─ СН2─ ОН + NaОН
2. Образование эфиров (взаимодействие с кислотами)
СН3 ─ ОН + НО ─ NO2 ↔ СН3 ─ О ─ NO2 + H2О
метиловый азотная метиловый эфир
спирт кислота азотной кислоты
3. Окисление (проходит легче, чем у соответствующих углеводородов)
3СН3 ─ СН2 ─ ОН + K2Cr2O7 + 4H2SO4 →3СН3─С ─Н + Сr2(SO4)3 + K2SO4 +7H2O
этиловый спирт ║
O
уксусный альдегид
5СН3─ СН─СН3 + 2KMnO4 + 3H2SO4→5СН3─ С─СН3 + 2MnSO4 + K2SO4 + 8 H2O
│ ║
OH O
изопропиловый спирт диметилкетон (ацетон)
Альдегиды и кетоны (карбонильные соединения)
В молекулах этих соединений содержится двухвалентная карбонильная группа >С=О.
Н ─С─Н СН3 ─С ─Н
║ ║
О О
муравьиный альдегид уксусный адьдегид
СН3─ С─СН3 СН3 ─СН2─С─СН3
║ ║
O O
диметилкетон метилэтилкетон
Альдегиды, в отличии от кетонов легко окисляются:
2СН3 ─С ─Н + О2 → 2СН3 ─С ─ОН
║ ║
О О
уксусный альдегид уксусная кислота
СН3 ─С ─Н + Ag2O → СН3 ─С ─ОН +2Ag
║ ║
О О
СН3 ─С ─Н + CuO → СН3 ─С ─ОН + Cu2O
║ ║
О О
Муравьиный альдегид (формальдегид) СН2=О - газ с резким запахом, хорошо растворим в воде, 40% водный раствор - формалин применяется для дезинфекции, консервирования препаратов и др., используется для производства формальдегидных смол.
Уксусный альдегид (ацетальальдегид) СН3─СН=О. Легко кипящая бесцветная жидкость (темп.кип. 210С), с характерным запахом прелых яблок, хорошо растворима в воде.
Ацетон, или диметилкетон, СН3─СО─СН3. Бесцветная жидкость с характерным запахом ( темп. кип. 56,2 0С); смешивается с водой во всех соотношениях. Очень хороший растворитель многих органических веществ. Широко применяется в лакокрасочной промышленности, в производстве некоторых видов искусственного волокна, небьющегося органического стекла, кинопленки, бездымного пороха, для растворения ацетилена ( в баллонах).
Углеводы
К углеводам относятся сахара и вещества, превращающиеся в них при гидролизе.
Углеводы подразделяются на моносахариды, дисахариды и полисахариды.
Моносахариды - простейшие углеводы, они не подвергаются гидролизу - не расщепляются водой на более простые углеводы.
Глюкоза, или виноградный сахар, С6Н12О6 - важнейший из моносахаридов; белые кристаллы сладкого вкуса, легко растворяющиеся в воде.
Глюкоза является шестиатомным альдегидоспиртом; строение ее можно представить формулой:
Н Н ОН Н Н
│ │ │ │ │
НОСН2 ─С ─ С ─ С ─ С─С=О
│ │ │ │
ОН ОН Н ОН
Фруктоза, или плодовый сахар, С6Н12О6 - моносахарид, спутник глюкозы во многих плодовых и ягодных соках; значительно слаще глюкозы; в смеси с ней входит в состав меда. Представляет собой шестиатомный кетоноспирт; строение фруктозы отражает формула:
Н Н ОН О
│ │ │ ║
НОСН2 ─С ─ С ─ С ─ С─СН2ОН
│ │ │
ОН ОН Н
Моносахариды существуют и вступают в реакции не только в открытой цепной форме, но еще и в циклических формах. Моносахариды как альдегидо- или кетоноспирты являются соединениями со смешенными функциями, природа их усложнена возможностью внутримолекулярных взаимодействий спиртовых гидроксильных групп с альдегидной или кетонной карбонильной группой. В результате замыкается шестичленное, содержащие атом кислорода кольцо и образуются 2 циклические α- и β-формы глюкозы, отличающиеся пространственным расположением атома Н и группы ОН при 1 -ом С- атоме (для фруктозы также существуют 2 циклические формы).
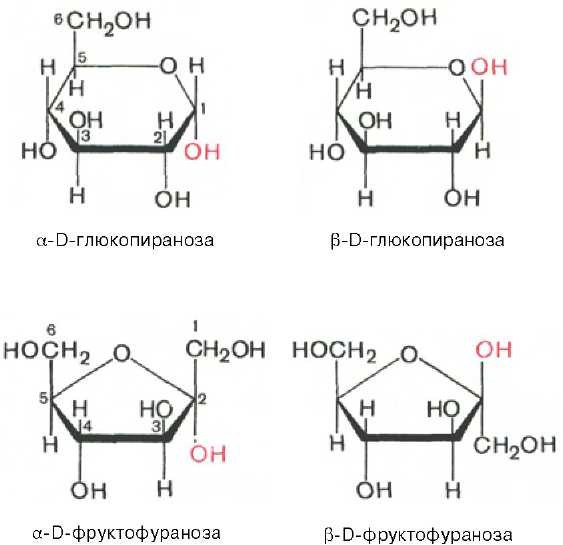
Дисахариды - углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на 2 молекулы моносахаридов.
Сахароза С12Н22О11
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
сахароза глюкоза фруктоза
Полисахариды. Эти углеводы во многом отличаются от моно- и дисахаридов - не имеют сладкого вкуса, в большинстве нерастворимы в воде; они представляют собой сложные высокомолекулярные соединения, которые под каталитическим влиянием кислот или ферментов подвергаются гидролизу с образованием более простых полисахаридов и , в конечном итоге, множества (сотен и тысяч) молекул моносахаридов. Важнейшие представители полисахаридов - крахмал и целлюлоза (клетчатка). Их молекулы построены из звеньев ─С6Н10О5 ─, являющихся остатками шестичленных циклических форм молекул глюкозы, потерявших молекулы воды; поэтому состав и крахмала, и целлюлозы выражается общей формулой (С6Н10О5)х. Различие же в свойствах этих полисахаридов обусловлено пространственной изомерией, образующих их моносахаридных молекул: крахмал построен из α-формы, а целлюлозы - β-формы глюкозы.
Азотсодержащие соединения
Амины. Эти органические соединения являются производными аммиака. Их можно рассматривать как продукты замещения одного, двух или трех атомов водорода в молекуле аммиака углеводородными радикалами:
H H CH3 CH3
│ │ │ │
H ─ N: CH3─ N: CH3─ N: CH3─ N:
│ │ │ │
H H H CH3
аммиак метиламин диметиламин триметиламин
А мины
представляют собой органические
основания. За счет неподеленной пары
электронов у атома азота их молекулы,
подобно молекуле аммиака, могут
присоединять протоны:
мины
представляют собой органические
основания. За счет неподеленной пары
электронов у атома азота их молекулы,
подобно молекуле аммиака, могут
присоединять протоны:
H Н +
│ │
CH3─ N: + Н─О─Н → СН3─ N─Н ОН-
│ │
H Н
гидроксид метиламмония
Аминокислоты и белки
Большое биологическое значение имеют аминокислоты - соединения со смешенными функциями, в которых, как в аминах, содержатся аминогруппы ─ NН2 и одновременно, как в кислотах, - карбоксильные группы ─СООН.
Строение аминокислот выражается общей формулой (где R- углеводородный радикал, который может содержать и различные функциональные группы):
CH3 O
│ ║
Н2N─CH ─ C─OH
O СН3 О
║ │ ║
Н2N─CH2 ─ C─OH Н2N─CH ─ C─OH
глицин аланин
Аминокислоты - амфотерные соединения: они образуют соли с основаниями ( за счет карбоксильной группы) и с кислотами ( за счет аминогруппы).
Ион водорода, отщепляющийся при диссоциации от карбоксила аминокислоты, может переходить к ее аминогруппе с образованием аммониевой группировки. таким образом, аминокислоты существуют и вступают в реакции также в виде биполярных ионов (внутренних солей):
R R
│ │
Н2N─CH ─ COOH ↔ Н3N+─CH ─ COO-
аминокислота биполярный ион
(внутренняя соль)
Этим объясняется, что растворы аминокислот, содержащих одну карбоксильную и одну аминогруппу, имеют нейтральную реакцию.
Из молекул аминокислот строятся молекулы белковых веществ, или белков, которые при полном гидролизе под влиянием минеральных кислот, щелочей или ферментов распадаются, образуя смеси аминокислот.
Белки - природные высокомолекулярные азотсодержащие органические соединения. Они играют первостепенную роль во всех жизненных процессах, являются носителями жизни.
В состав белков входят углерод, водород, кислород, азот и, часто сера, фосфор, железо. Молекулярные массы белков очень велики - от 1500 до нескольких миллионов.
Структуру молекулы белка можно представить следующим образом:
R R′ R R" R"′
│ │ │ │ │
Н2N─CH ─ C─... НN─CH ─ C─.... НN─CH ─ C─... НN─CH ─ C─.... НN─CH ─ C─ОН
║ ║ ║ ║ ║
О О О О О
В молекулах белков многократно повторяются группы атомов ─СО─NH─; их называют амидными, или в химии белков - пептидными группами.
Задачи, контрольные вопросы
1. Сколько м3 оксида углерода (IV) образуется при сжигании: а) 5 м3 этана; б) 5 кг этана (н.у.)?
2. Напишите структурные формулы алкенов нормального строения, содержащих: а) четыре; б) пять; в) шесть атомов углерода.
3. Напишите структурную формулу н-пропанола.
4. Какие соединения относятся к карбонильным? Приведите примеры, напишите структурные формулы и укажите в них карбонильную группу.
5. Что такое углеводы? Приведите примеры.
Лекция 16
