
- •Раздел 1 систематика микроорганизмов
- •Раздел 2
- •Морфология и ультраструктура микроорганизмов
- •Лабораторное занятие №1
- •Микроскопические методы исследования в микробиологии
- •1. Техника безопасности работы в учебной лаборатории
- •Светлопольная микроскопия
- •Люминесцентная микроскопия
- •Электронная микроскопия.
- •Каждый студент отрабатывает технику микроскопии
- •1. Техника безопасности работы в учебной лаборатории
- •Проведение занятия
- •Проведение занятия
- •Проведение занятия
- •Раздел 3 физиология и биохимия микроорганизмов
- •Питательные среды
- •Культивирование микроорганизмов
- •1.Посев штрихом или разливом на твердую среду
- •Проведение занятия
- •Дезинфекция, асептика, антисептика
- •Стерилизация питательных сред
- •Культивирование микроорганизмов в лабораторных условиях
- •Посев инокулята
- •Особенности культивирования облигатно-анаэробных бактерий
- •Физические методы
- •Химические методы
- •Биологические методы
- •Методы выделения чистых культур облигатных анаэробов
- •Питательные среды для идентификации анаэробов
- •Проведение занятия
- •III этап выделения чистой культуры аэробных бактерий
- •I этап выделения чистой культуры анаэробных бактерий
- •Проведение занятия
- •II этап выделения чистой культуры анаэробных бактерий
- •III этап выделения чистой культуры анаэробных бактерий
- •Раздел 4
- •Цель : ознакомление с методами генной инженерии и трансформацией плазмидной днк
- •Трансформация с применением хлористого кальция
- •Записать в тетрадях методику трансформации e.Coli с применением кальция
- •Записать состав среды lb и метод приготовления селективной среды с тетрациклином.
- •Раздел 5 Инфекция и молекулярно-генетические основы вирулентности микробов
- •Применение лабораторных животных для биологических методов исследования
- •Способы заражения
- •Вскрытие животных
- •Раздел 6 распространение микроорганизмов в природе и микрофлора тела человека. Санитарная микробиология
- •Ознакомиться с методами санитарной микробиологии
- •Определить общее микробное число воды и воздуха
- •Раздел 7 Основы химиопрофилактики и химиотерапии
- •Приготовление инокулюма из агаровой культуры
- •Приготовление инокулюма из бульонной культуры
- •Литература
- •Содержание
Проведение занятия
Теоретические вопросы окрашивания микроорганизмов
Демонстрация анимации «Окраска по Граму»
Демонстрация техники приготовления и окрашивания мазков
Самостоятельная работа
Контрольные вопросы
Задание
Каждый студент должен:
Приготовить 2 мазка из бульонной бактериальной культуры
Высушить их, зафиксировать физическим способом
Окрасить один из них простым методом:
Нанести на стекло несколько капель метиленового синего
Выдержать 3-5 мин
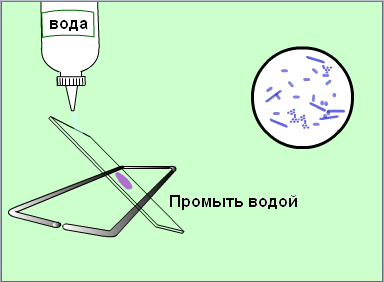
Смыть краску водой
Высушить мазок на воздухе или фильтровальной бумагой
Микроскопировать с иммерсионным объективом и увеличением
900 –1000х
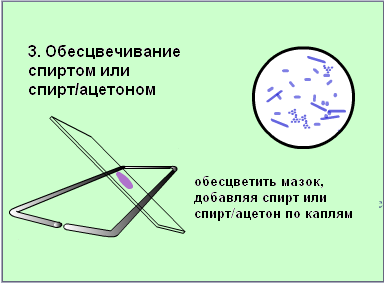
Второй мазок окрасить сложным методом (по Грамму, основной вариант).






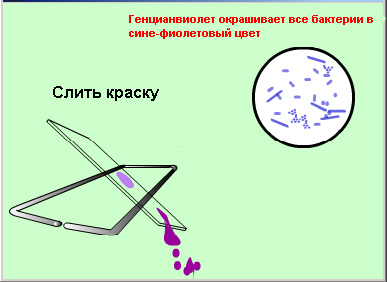
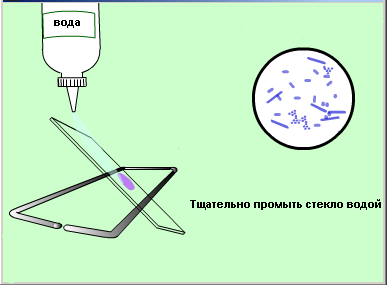
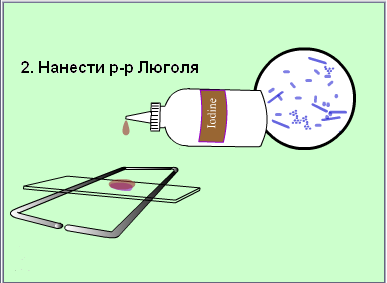

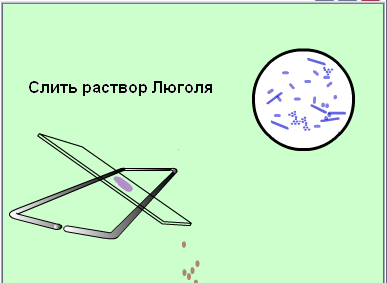

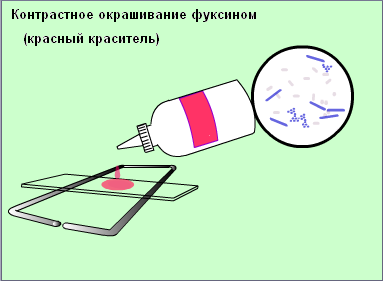




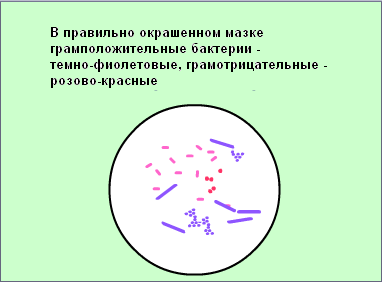
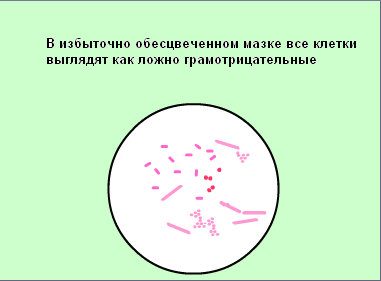

Зарисовать в тетеради микроорганизмы, видимые в поле зрения.
Контрольные вопросы (письменный ответ в тетради):
С какой целью мазки подвергаются фиксации? Способы фиксации.
В каких случаях применяется химический метод фиксации препаратов?
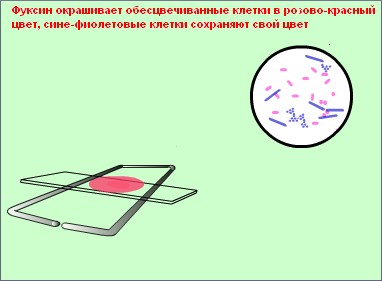
В какой цвет окрашиваются грамположительные и грамотрицательные бактерии?
Каковы причины неудач при окрашивании по Граму?
Лабораторное занятие №3
МИКРОСКОПИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ В МИКРОБИОЛОГИИ (продолжение)
Цель – ознакомление с методами окраски кислотоустойчивых и спорообразующих микроорганизмов.
Материалы и оборудование: бактериологическая петля, предметные стекла, пробирки, ватные пробки, спиртовка или газовая горелка, растворы красителей
Окраска кислотоустойчивых микробов. Кислотоустойчивые микробы имеют в своем составе жироподобные вещества (липоиды), в частности, миколовые кислоты, с трудом окрашиваемые обычными анилиновыми красками. Однако будучи окрашены раствором карболового фуксина, они не теряют окраски при воздействии на них раствором неорганических кислот и спирта и не воспринимают цвет дополнительной контрастной окраски.
Окраска кислотоустойчивых бактерий по методу Циля-Нильсена отражает особенности некоторых микобактерий и нокардий. Эти бактерии не окрашиваются обычными методами, однако если при окрашивании используются фенол, детергенты или нагревание, то окрашенные клетки получить удается. В этом случае окраска клеток сохраняется даже при последующем обесцвечивании в смеси кислота-спирт.
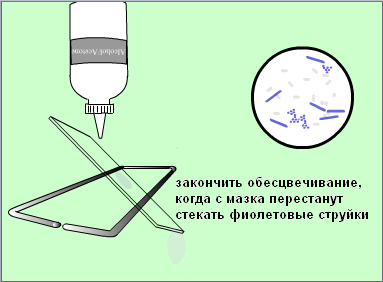
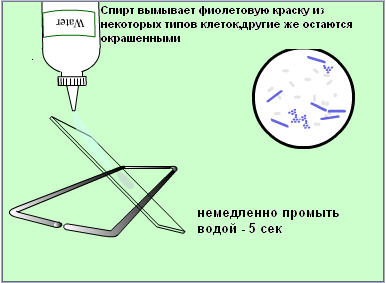
Техника окраски по Циль-Нильсену. На фиксированный пламенем мазок кладут полоску фильтровальной бумаги, наливают на нее карболовой раствор фуксина Циля и подогревают, не доводя до кипения. Краситель по мере испарения периодически добавляют, не давая препарату подсохнуть. При появлении паров нагревание прекращают через 2-3 мин., дав препарату остыть, снимают бумажку и сливают избыток краски. Препорат промывают водой и обесцвечивают, налив на мазок 5-10%-водный раствор серной кислоты на 3-5секунд (до появления желтоватого оттенка мазка). Мазок вновь тщательно промывают водой, споласкивают 960 спиртом, еще раз промывают водой и докрашивают в течении 3-5 минут метиленовой синькой Лёффлера. Обесцвечивание мазка серной кислотой можно заменить воздействием солянокислого алкоголя (960 этилового спирта, содержащего по объему 3% соляной кислоты), доведя оттенок препарата до слабо розоватого, затем промыть мазок водой и докрасить.
Кислотоустойчивые бактерии окрашиваются фуксином в рубиново-красный цвет, некислотоустойчивые приобретают цвет дополнительной окраски, становятся синими.
Эндоспоры бактерий. Спорообразование свойственно бактериям нескольких родов, к числу которых относятся Bacillus, Clostridium, Sporosarcina, Desufotomaculum, etc. Обычно внутри каждой клетки образуется одна спора, которая может размещаться центрально (у бацилл); субтерминально или терминально, превышая диаметр материнской клетки (у клостридий). Это приводит к формированию у кислостридий клеток веретеновидной формы (Clostridium perfringens), разливной ложки (Clostridium diauvoci), ракетки или барабанной палочки (Clostridium tetani). Бактериальные споры устойчивы к высокой температуре, высушиванию, воздействию токсических веществ и других неблагоприятных факторов.
Бактериальные споры могут быть выявлены с использованием как простых, так и сложных методов окраски. Например, с использованием 7% водного раствора нигрозина микроорганизм окрашивается в зеленый цвет, споры – бесцветные, а фон – черный.
Окраска спор у бактерий по методу Циля. Приготовленный мазок высушивают на воздухе, фиксируют на пламени, покрывают полоской фильтровальной бумаги, на которую наносят карболовый раствор фуксина Циля, и подогревают в течении 6-8 минут до образования паров (краску периодически добавляют, не давая мазку подсохнуть). После этого мазок тщательно промывают водой, и на 30-60 секунд наносят на него 1% раствор серной кислоты до приобретения слабо розовой окраски (при этом краситель вымывается из цитоплазмы вегетативных клеток, а споры остаются окрашенными). Обесцвечивание мазка серной кислотой можно заменить воздействием солянокислого алкоголя (960 этилового спирта, содержащего по объему 3% соляной кислоты), доведя оттенок препарата до слабо розоватого, затем промыть мазок водой и докрасить.
После дифференциации мазок немедленно промывают и докрашивают раствором метиленовой синьки Леффлера в течении 5 минут, снова промывают водой, высушивают на воздухе и микроскопируют, пользуясь иммерсионной системой.
Споры окрашиваются фуксином в ярко-красный цвет, а концы клеток-спороносцев и бесспоровые палочки – в синий или голубой цвет метиленовой синьки.
Метод окраски спор по способу Ауески. На приготовленный высушенный на воздухе мазок наливают 1-2% водный раствор соляной кислоты и подогревают на пламени до отхождения паров (3-4 раза).
Затем препарат промывают водой, высушивают, фиксируют на пламени и окрашивают через фильтровальную бумагу карболовым раствором фуксина при нагревании (до появления паров) в течении 3-5 минут. Далее препарат обесцвечивают 5% водным раствором серной кислоты в течении нескольких секунд (до бледно-розовой окраски), промывают водой и дополнительно окрашивают раствором метиленовой синьки Леффлера в течении 2-х минут, промывают водой и высушивают. При микроскопии видны споры (красные) и вегетативные формы (синие).
Материалы и оборудование: культуры споровых форм бактерий, фильтровальные бумажки размером 2X3 см, карболовый фуксин Циля, метиленовый синий, пинцеты.
