- •Раздел 1 систематика микроорганизмов
- •Раздел 2
- •Морфология и ультраструктура микроорганизмов
- •Лабораторное занятие №1
- •Микроскопические методы исследования в микробиологии
- •1. Техника безопасности работы в учебной лаборатории
- •Светлопольная микроскопия
- •Люминесцентная микроскопия
- •Электронная микроскопия.
- •Каждый студент отрабатывает технику микроскопии
- •1. Техника безопасности работы в учебной лаборатории
- •Проведение занятия
- •Проведение занятия
- •Проведение занятия
- •Раздел 3 физиология и биохимия микроорганизмов
- •Питательные среды
- •Культивирование микроорганизмов
- •1.Посев штрихом или разливом на твердую среду
- •Проведение занятия
- •Дезинфекция, асептика, антисептика
- •Стерилизация питательных сред
- •Культивирование микроорганизмов в лабораторных условиях
- •Посев инокулята
- •Особенности культивирования облигатно-анаэробных бактерий
- •Физические методы
- •Химические методы
- •Биологические методы
- •Методы выделения чистых культур облигатных анаэробов
- •Питательные среды для идентификации анаэробов
- •Проведение занятия
- •III этап выделения чистой культуры аэробных бактерий
- •I этап выделения чистой культуры анаэробных бактерий
- •Проведение занятия
- •II этап выделения чистой культуры анаэробных бактерий
- •III этап выделения чистой культуры анаэробных бактерий
- •Раздел 4
- •Цель : ознакомление с методами генной инженерии и трансформацией плазмидной днк
- •Трансформация с применением хлористого кальция
- •Записать в тетрадях методику трансформации e.Coli с применением кальция
- •Записать состав среды lb и метод приготовления селективной среды с тетрациклином.
- •Раздел 5 Инфекция и молекулярно-генетические основы вирулентности микробов
- •Применение лабораторных животных для биологических методов исследования
- •Способы заражения
- •Вскрытие животных
- •Раздел 6 распространение микроорганизмов в природе и микрофлора тела человека. Санитарная микробиология
- •Ознакомиться с методами санитарной микробиологии
- •Определить общее микробное число воды и воздуха
- •Раздел 7 Основы химиопрофилактики и химиотерапии
- •Приготовление инокулюма из агаровой культуры
- •Приготовление инокулюма из бульонной культуры
- •Литература
- •Содержание
Светлопольная микроскопия
Метод светлого поля в проходящем свете применяется при исследовании прозрачных препаратов, у которых различные участки структуры по-разному поглощают свет. Пучок лучей из осветительной системы проходит препарат и объектив и дает равномерно освещенное поле в плоскости изображения. Элементы структуры препарата частично поглощают и отклоняют падающий на них свет, что и обусловливает появление изображения. Метод может быть полезен и при наблюдении непоглащающих объектов, но лишь в том случае, если они рассеивают освещающий пучок настолько сильно, что значительная часть его не попадает в объектив. Метод светлого поля в отраженном свете применяется для наблюдения непрозрачных объектов, к примеру, травленых шлифов металлов, биологических тканей и различных минералов. Освещение препарата производится сверху, через объектив, который одновременно выполняет и роль осветительной системы. Изображение, как и при проходящем свете, создается за счет того, что разные участки препарата неодинаково отклоняют падающий на них свет, а отраженные лучи имеют различную интенсивность.
Устройство биологического микроскопа. Для изучения микроорганизмов пользуются сложными оптически приборами — микроскопами (от греч. mikros — малы, skopeo— смотрю). Микроскопы имеют две основные части: механическую и оптическую.
Механическая часть состоит из штатива, котором различают ножку (или башмак), основание, тубусодержатель, и предметного столика, прикрепляемого к основанию штатива. Предметный столик перемещается в горизонтальной плоскости с помощью винтов. На поверхности сто лика имеются две клеммы для закрепления препарата. Тубусодержатель поднимается и опускается с помощью макрометрического и микрометрического ви н т о в, предназначенных для грубой и точной фокусировки объекта. Поворот макрометрического винта на один оборот поднимает или опускает тубусодержатель на 2 мм, микрометрического — на 0,1 мм. Вверху прямого или наклоного тубуса, на котором крепится револьвер, куда ввинчиваются 2—4 объектива. Замена объективов производится при повороте револьвера вокруг оси.
Оптическая часть микроскопов состоит из осветительного аппарата, объективов и окуляров. Осветительный аппарат (рис. ) расположен под предметным столиком и состоит из зеркала, конденсора и ирис-диафрагмы. Зеркало имеет две поверхности: плоскую и вогнутую; оно отражает световые лучи и направляет их к конденсору. При естественном освещении при больших увеличениях употребляется плоское зеркало, при искусственном, как и при естественном при малых увеличениях (без конденсора),— вогнутое. Конденсор представляет собой систему сильных линз и служит для усиления яркости освещения рассматриваемого объекта. Собирая лучи света, отраженные зеркалом, конденсор концентрирует их в плоскости препарата. Передвигается конденсор в вертикальном направлении при помощи винта. При опускании конденсора - поле зрения микроскопа затемняется, при поднятии — освещается. При слишком сильном освещении для зрения конденсор рекомендуется опустить, а при слабом — поднять.
Ирис-диафрагма, расположенная под конденсором, состоит из тонких металлических сегментов, которые при помощи рычажка можно сдвигать или раздвигать, регулируя этим поступление света в конденсор.
Объективы являются наиболее ценной частью микроскопа. Они ввинчиваются в гнезда револьвера и состоят из системы линз, заключенных в металлическую оправу. Передняя, или фронтальная, линза объектива является самой маленькой и единственной, дающей увеличение. Остальные линзы в объективе только исправляют недостатки полученного изображения и называются коррекционными. В сильных объективах фронтальные линзы имеют наибольшую кривизну при наименьшем диаметре, приближаясь к форме полушара. Все объективы делятся на ахроматы — более простые и апохроматы — более совершенные, наиболее полно устраняющие недостатки оптического изображения.
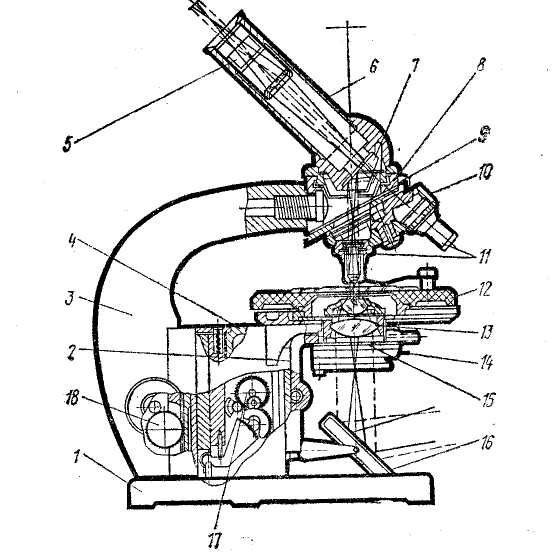
Рис 3. Устройство и оптическая схема микроскопа МБР-1:
1 — башмак микроскопа; 2 — кронштейн конденсора; 3 — тубусодержатель (ручка микроскопа); 4 — коробка с микромеханизмом; 5 — окуляр; 6 — тубус; 7 — призма; 8 — головка тубусодержателя; 9 — винт для фиксации револьвера; 10 — револьвер на салазках; 11 — объектив; 12 — предметный столик; 13 - конденсор; 14 — рукоятка ирис-диафрагмы; 15—диафрагма; 16 — зеркало; 17 — микрометрический винт; 18 — макрометрический винт
Кроме того, объективы делятся на сухие и иммерсионные. Сухими называются объективы, при работе с которыми между фронтальной линзой и рассматриваемым предметом находится слой воздуха. Иммерсионными (от лат. immersio — погружаю) называются объективы, фронтальная линза которых при работе погружается в нанесенную на препарат каплю жидкости с показателем преломления, близким к показателю преломления стекла. Лучшим для этой цели является кедровое масло с коэффициентом преломления 1, 515 (коэффициент преломления стекла 1,53). Световые лучи при переходе из стекла в слой кедрового масла не преломляются и, не отражаясь, попадают в объектив. Таким образом достигается наилучшее освещение рассматриваемого предмета.
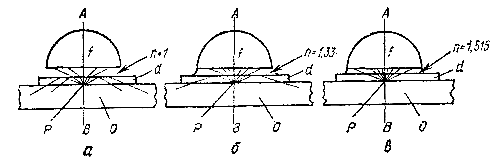
Рис. 4. Ход лучей при наличии между объективом и покровным стеклом воздуха, воды и иммерсионного масла:
О — предметное стекло; d — покровное стекло; Р — препарат; f — передняя линза объектива; n — показатель преломления среды; АВ — оптический разрез; а — сухой объектив; 6 — водная иммерсия; s — масляная иммерсия.
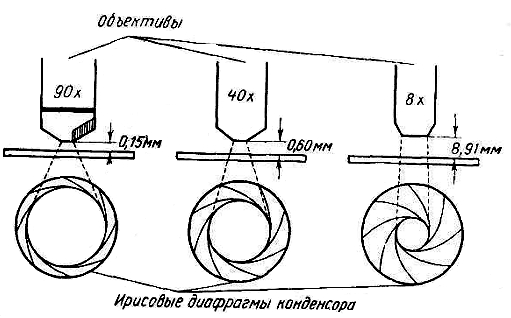
Рис.5. Соотношение между увеличением объектива, рабочим расстоянием объектива и степенью раскрытия ирисовой диафрагмы конденсора
Биологические микроскопы МБР-1 и МБИ-1 обычно имеют 3—4 объектива с цифровыми обозначениями 10 (или 8), 20, 40, 60 и 90Х (иммерсионный), показывающими собственное увеличение этих объективов. Наиболее сильными объективами микроскопов являются объективы 90, 100, 101 и 110Х.
Окуляр (от лат. oculus — глаз) вставляется в верхний конец тубуса. Окуляр представляет собой систему двух плоско-выпуклых линз, обращенных выпуклостью в сторону объектива. Линза, обращенная к глазу, называется глазной, а обращенная к препарату,— собирающей. У окуляров с большим увеличением фокус короче, поэтому меньше и длина окуляра. Между линзами имеется диафрагма, ограничивающая поле зрения и задерживающая кривые лучи света. Окуляры помечаются цифрами, показывающими их собственное увеличение: 5, 7, 10, 15х. При работе с апохроматами применяются более сложные компенсационные окуляры, устраняющие оптические недостатки объективов.
Наиболее четкое изображение предмета получается при сочетании сильных объектов со слабыми и средними окулярами. Для того чтобы определить увеличение данной системы микроскопов, следует умножить показатель увеличения объектива на показатель увеличения окуляра. Например, при окуляре 7х и объективе 90х увеличение микроскопа равно 630.
Действительное изображение предмета дает объектив. Окуляр же только увеличивает изображение, данное объективом и, не прибавляя ничего нового, дает увеличенное обратное и мнимое изображение рассматриваемого объекта.
Осветитель. При микроскопии часто применяется электрический свет. Во многих микроскопах (МБИ-2, МБИ-6) осветительное устройство вмонтировано в основание микроскопа. В микроскопе МБР-1 такое приспособление не предусмотрено и для работы пользуются специальными осветителями ОИ-7, ОИ-19 и др.
Рис.6. Осветитель
ОИ-19 с микроскопом:
1 —
штатив осветителя; 2 —
корпус осветителя; 3 —
патрон с лампой; 4 —
рукоятка ирисовой диафрагмы; 5—светофильтр;
6 —
трансформатор; 7—рукоятка
реостата; 8 —
выключатель; 9 —
соединительная планка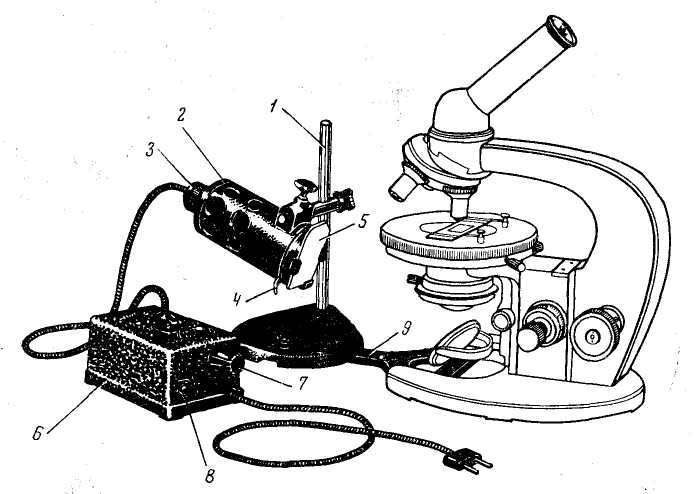
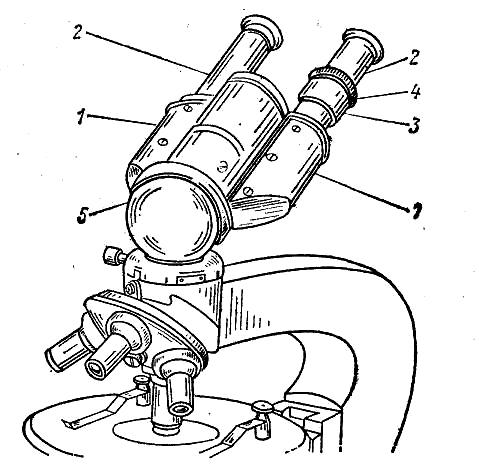
Рис.
7. Бинокулярная насадка АУ-12, установленная
на микроскопе: 1,2 - окулярные трубки; 3
— диоптропный
механизм; 4 — кольцо
диоптропного механизма; 5 —шаровидный
корпус с трубчатой осью и установочным
фланцем
Для изучения колоний микроорганизмов, растущих на плотных питательных средах, и особенно для продолжительного микроскопирования препаратов микробов пользуются бинокулярным микроскопом или бинокулярной насадкой (рис. 8) , позволяющими получать стереоскопическое изображение предмета в трех измерениях не так быстро утомляющими зрение. При этом положение трубок с окулярами регулируют до тех пор, пока изображение не совпадет в одном поле зрения.
Установка света по Кёлеру
Хорошие результаты при работе с микроскопом могут быть получены только при условии правильного освещения объекта. Лучший способ освещения основан на системе Кёлера. Установку света выполняют в такой последовательности.
Предварительная подготовка:
ставят микроскоп и осветитель на крестовину, что обеспечивает необходимое расстояние между источником света и зеркалом микроскопа;
на предметный столик помещают препарат «раздавленная капля» или фиксированный окрашенный препарат;
устанавливают объектив 8х;
поднимают конденсор вверх до упора так, чтобы верхняя линза конденсора находилась в одной плоскости с предметным столиком микроскопа; ,
открывают полностью диафрагму конденсора;
отодвигают матовое стекло;
ставят плоское зеркало;
закрывают почти полностью диафрагму осветителя, оставив только небольшое отверстие.
Включают осветитель и придают его корпусу такое положение, при котором свет падал бы в центр поля зрения.
Кладут на зеркало микроскопа кружок белой бумаги и, передвигая патрон лампы осветителя вдоль корпуса, фокусируют на бумагу изображение витка нити лампы осветителя. Пользуясь реостатом, уменьшают яркость лампы осветителя, чтобы при дальнейшей работе не повредить глаза.
Глядя в окуляр и поворачивая зеркало, находят в поле зрения изображение краев диафрагмы осветителя, которое имеет вид светлого пятна с нечеткими краями. Величина пятна зависит от степени раскрытия диафрагмы осветителя и положения объектива. Чем шире открыта диафрагма и чем выше объектив, тем больше пятно (рис.9).
Если оно занимает значительную часть поля зрения, уменьшают его, несколько опустив объектив или сузив отверстие диафрагмы осветителя, глядя при этом в окуляр. В тех случаях, когда пятно сдвинуто к краю поля зрения, его переводят в центр осторожным поворотом зеркала. По ряду причин (отсутствие точечного источника света, аберрация) под микроскопом чаще всего видно не одно пятно, а несколько четких пятен (рис.10). Установку света осуществляют по центральному пятну.
Используя объектив 8х, фокусируют объект в области светлого пятна.
Глядя в окуляр и слегка опуская конденсор, фокусируют в плоскости препарата изображение краев диафрагмы осветителя, т. е. получают изображение светлого пятна с четко очерченными краями.
С помощью зеркала переводят яркое пятно в центр поля зрения. Если пятно освещено неравномерно, добиваются его равномерного освещения, слегка поворачивая корпус осветителя. При необходимости пятно снова центрируют.
Открывают диафрагму осветителя не более чем на 2/3.
Устанавливают объектив 40х (для препарата «раздавленная капля») или 90х (для фиксированного окрашенного препарата, на который предварительно наносят иммерсионное масло) и фокусируют объект.
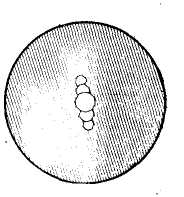
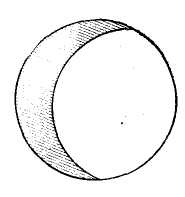
Рис.8.
Не центрированное изображение отверстия
диафрагмы осветителя при высоко
поднятом объективе 8х
Рис.9.
Центрированное изображение отверстия
диафрагмы осветителя при низко
опущенном объективе 8х
Яркость освещения регулируют изменением с помощью реостата накала лампы осветителя или применением светофильтров. Положение зеркала, конденсора и диафрагмы осветителя менять нельзя! Диафрагмой конденсора пользуются только для увеличения контрастности (четкости) изображения, когда работают с объективом 40х. Апертура не иммергированного конденсора близка к 1, а числовая апертура объектива 40х составляет 0,65. Чтобы привести в соответствие апертуру конденсора с апертурой объектива, поступают следующим образом. Установив свет по Кёлеру и сфокусировав препарат с объективом 40х, вынимают окуляр и, глядя в тубус, прикрывают диафрагму конденсора до тех пор, пока края диафрагмы не станут видны у границы равномерно освещенной верхней линзы объектива. При работе с объективом 90х диафрагму конденсора оставляют открытой, поскольку числовая апертура этого объектива 1,25.
Правила работы с иммерсионным объективом
Устанавливают свет по Кёлеру. На сухой фиксированный окрашенный препарат наносят каплю иммерсионного масла. Устанавливают объектив 90х и, глядя сбоку, осторожно опускают макрометрическим винтом тубус микроскопа до погружения объектива в масло. Следят за тем, чтобы фронтальная линза объектива не коснулась предметного стекла. (Фронтальная линза высокоапертурных иммерсионных объективов при грубом обращении может легко сместиться.) Затем, наблюдая в окуляр, макровинтом медленно поднимают тубус и фокусируют объект. Тонкую фокусировку осуществляют с помощью микрометрического винта.
По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной очищенным бензином. Нельзя оставлять масло на поверхности линзы, так как на нем собирается пыль, что может привести к повреждению объектива. Препарат освобождают от масла сначала кусочком фильтровальной бумаги, а затем обрабатывают стекло бензином или ксилолом.
Кедровое масло и очищенный бензин обычно сохраняют в масленках, которые представляют собой два флакона, вставленных один в другой. Во внутренний флакон наливают кедровое масло, в наружный — очищенный бензин. Флакон с маслом закрывают пробкой, в которую вставлена стеклянная палочка. Этой палочкой наносят масло на препарат.
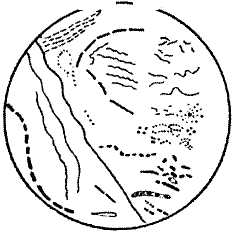
Рис.11.
Микрофлора зубного налета при микроскопии
в светлом поле
МИКРОСКОПИЯ В ТЕМНОМ ПОЛЕ
Темнопольная микроскопия основана на способности микроорганизмов сильно рассеивать свет. Объект освещается косыми боковыми лучами и в объектив микроскопа попадают только лучи, рассеянные частицами, находящимися в препарате. Темнопольная микроскопия основана на эффекте Тиндаля, известным примером которого служит обнаружение пылинок в воздухе при освещении их узким лучом солнечного света. Чтобы в объектив не попадали прямые лучи от осветителя, апертура объектива должна быть меньше, чем апертура конденсора. Для уменьшения апертуры в обычный объектив помещают диафрагму или пользуются специальными объективами, снабженными ирисовой диафрагмой.
При темнопольной микроскопии микроорганизмы выглядят ярко светящимися на черном фоне. При этом способе микроскопии могут быть обнаружены мельчайшие микроорганизмы, размеры которых лежат за пределами разрешающей способности микроскопа. Однако темнопольная микроскопия позволяет увидеть только контуры объекта, но не дает возможности изучить внутреннюю структуру. С помощью темнопольной микроскопии изучают препараты типа раздавленная "капля". Предметные стекла должны быть не толще 1,1-1,2 мм, покровные 0,17 мм, без царапин и загрязнений.
При приготовлении препарата следует избегать наличия пузырьков и крупных частиц (эти дефекты будут видны ярко святящимися и не позволят наблюдать препарат). Для темнопольной применяют более мощные осветители и максимальный накал лампы.
При таком освещении лучи не попадают в объектив и остаются невидимыми для глаза, поэтому поле зрения выглядит совершенно черным. Если препарат содержит какие-то частицы, например микроорганизмы, то косые лучи в определенной степени отражаются от их поверхности, отклоняются от своего первоначального направления и попадают в объектив. В этом случае наблюдатель видит на интенсивно черном фоне ослепительно яркие, светящиеся объекты. Такое освещение препарата достигается применением специального темнопольного конденсора, которым заменяют обычный конденсор микроскопа. Основная особенность темнопольных конденсоров заключается в том, что центральная часть у них затемнена и прямые лучи от осветителя в объектив микроскопа не попадают. (Темнопольный конденсор имеет затемненную среднюю часть, поэтому центральные лучи света, идущие от зеркала, задерживаются, а в плоскость препарата попадают только боковые лучи, отраженные от зеркальных поверхностей, расположенных внутри конденсора). При микроскопировании в темном поле можно увидеть объекты, величина которых измеряется сотыми долями микрометра, т. е. лежит за пределами видимости обычного микроскопа. Однако наблюдение объектов в темном поле позволяет различать только их контуры, но не дает возможности рассмотреть внутреннее строение.
Микробы при этом начинают светиться подобно тому, как невидимые в воздухе мельчайшие частицы пыли становятся видимыми в темном помещении при освещении пучком световых лучей, пропущенным через узкую щель.
Конденсор темного поля (рис. 12) состоит из наружного корпуса, в котором расположена рамка. К рамке прикреплен внутренний патрон с оптической частью, состоящей из линзы (кардиоид), защитного стекла и кольцевой диафрагмы. Рамка с оптической частью перемещается в плоскости, перпендикулярной оси, с помощью двух регулировочных винтов. Для получения отчетливого изображения перед началом работы производят центрировку, т. е. совмещение оптической оси микроскопа с осью конденсора. Правильность центрировки узнают по светлому, интенсивно и равномерно освещенному кольцу, видимому в окуляре, которое должно быть расположено в центре ноля зрения.
Просмотр препарата с конденсором темного поля производится с сухими и иммерсионными системами объективов. Иммерсионное масло без пузырьков воздуха наносят между верхней поверхностью конденсора и предметным стеклом; если объектив иммерсионный, масло наносят на покровное стекло. При работе с иммерсионным объективом 90 применяют специальную диафрагму, которая прилагается к конденсору темного поля. Толщина предметных стекол не должна превышать 0,8—1,2 мм, покровных—0,2 мм. Стекла должны быть безукоризненно чистыми и прозрачными, без царапин.
Работу проводят при прямом солнечном или электрическом освещении. В последнем случае используется специальная осветительная установка с лампой в 100— 150 Вт.
Рис.12. Конденсор
темного поля ОИ-13
Рис. 13. Ход лучей
в темном поле зрения:
О —
объектив, П —
препарат, ВИ —
водная иммерсия, ЛК
— линза конденсора,
ДТ —
диафрагма темного поля, ПС
— предметное
стекло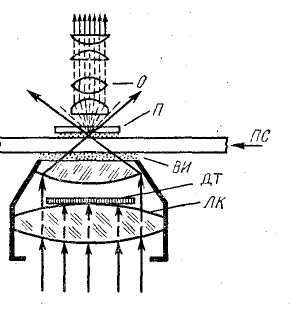
Техника микроскопии. Устанавливают и центрируют освещение по светлому полю. Заменяют конденсор со светлым полем на темнопольный конденсор. Для той же цели можно переделать обычный конденсор. Для этого необходимо отвинтить верхнюю линзу конденсора, положить на центральную часть нижней линзы кружок из черной бумаги (закрыть примерно 2/з линзы), привинтить верхнюю линзу. Ставят конденсор в держатель и закрепляют винтом. Открывают полностью диафрагму осветителя, обеспечивая максимальную силу света выключением реостата. На верхнюю линзу приспу щенного конденсора наносят каплю иммерсионной жидкости (кедровое масло, смесь вазелинового масла и бромнафтали-на, дистиллированной воды, что проще и доступнее). Жидкость не должна содержать пузырьков воздуха. Для исследования в темном поле препарат готовят по методу раздавленной капли. Небольшую каплю исследуемого материала наносят на предметное стекло. Каплю накрывают тонким (не более 0,17 мм) покровным стеклом так, чтобы под ним не оказалось пузырьков воздуха. Толщина предметного стекла должна быть не более 1,1 мм, так как в противном случае фокус конденсора (точка пересечения высокоапертурных лучей) будет находиться в толще стекла, а не в плоскости препарата и исследователь не получит эффекта темного поля.
Помещают препарат на предметный столик микроскопа. Приподнимают конденсор до тех пор, пока иммерсионная жидкость распространится по нижней поверхности предметного стекла. Револьвером устанавливают малое увеличение и фокусируют микроскоп на препарат. При правильной центрировке конденсора к оптической оси объектива в поле зрения должно быть светлое пятно или светлое пятно с темным центром и светящиеся подвижные точки бактерий или других частичек, содержащихся в препарате. Регулировочным винтом конденсора центрируют светлое пятно на середину поля зрения, а интенсивность его видимости регулируют подъемом или опусканием конденсора. После этого револьвером устанавливают объектив с нужным увеличением (обычно Х40), дополнительно центрируют конденсор и зеркало.
Микроскопия в темном поле зрения применяется для наблюдения за подвижностью микробов, обнаружения возбудителей некоторых болезней (лептоспир) и изучения таких микробов, величина которых находится на грани разрешающей способности светлопольной микроскопии. В темном поле зрения можно изучить влияние различных воздействий на клетку, наблюдать за изменением степени дисперсности коллоидов протопласта и их коагуляцией. В неповрежденной живой клетке протоплазма бывает гомогенной. В результате гибели или повреждения клетки ее содержимое начинает ярко светиться. Однако в темном поле зрения нельзя хорошо изучить форму и тем более внутреннее строение микробов.
Порядок работы с темнопольным конденсором
Препарат «раздавленная капля», приготовленный на тонком и тщательно очищенном предметном стекле, помещают на столик микроскопа и фокусируют с объективом 8Х. После этого положение тубуса не меняют до фокусировки препарата с объективом 40Х.
Вынимают светлопольный конденсор, окуляр и вывинчивают один из объективов. Если револьвер микроскопа имеет одно свободное от объектива отверстие, закрытое специальной заглушкой, можно воспользоваться этим отверстием, вывинтив заглушку. Устанавливают свободное от объектива отверстие над препаратом.
Закрыв диафрагму осветителя почти до предела, фокусируют изображение нити лампы на зеркале, прикрытом кружком белой бумаги (как при установке света по Кёлеру). Уменьшают яркость света с помощью реостата.
Открывают диафрагму осветителя. Прикрыв верхний конецтубуса микроскопа матовым стеклом и слегка поворачивая зеркало, добиваются равномерного освещения поля. После этого зеркало перемещать нельзя!
Вставляют окуляр, устанавливают объектив 8Х и осторожно, не задевая зеркала,устанавливают темнопольный конденсор.
Последний вставляют так, чтобы белый винт был обращен в сторону штатива микроскопа, а два регулировочных винта — в сторону осветителя. Надевают на регулировочные винты ключи. Если при установке темнопольного конденсора произошло хотя бы небольшое изменение положения зеркала, вынимают конденсор и вновь регулируют освещение.
Препарат сдвигают в сторону, на верхнюю линзу конденсора наносят иммерсионное масло и, несколько опустив конденсор, снова устанавливают препарат, закрепив его клеммами.
Поднимают конденсор вверх до упора. Масло должно равномерно заполнить пространство между линзой конденсора ипредметным стеклом и не содержать пузырьков воздуха. В противном случае операцию следует повторить, увеличив масляную каплю.
Отключают реостат осветителя, т. е. получают максимальное освещение.
Глядя в окуляр, центрируют конденсор. Для этого с помощью регулировочных винтов приводят точно в центр поля зрения изображение светлого кольца с темным пятном в середине или только светлого пятна. Кольцо или пятно отличаются от ярких, четко очерченных пузырьков воздуха белесоватым оттенком и «размытостью» — отсутствием четких границ.
Если при центрировке обнаружено светлое кольцо, то, наблюдая в окуляр и слегка поднимая или опуская конденсор, устанавливают последний в таком положении, чтобы в поле зрения исчезло темное пятно и вместо кольца осталось только замкнутое светлое пятно. Если при центрировке выявлено светлое пятно, конденсор не перемещают.
Ставят объектив 40Х и фокусируют препарат.
Для получения лучшего эффекта применяют зеленый фильтр. При смене препарата или объектива тщательно проверяют центрировку кольцевой диафрагмы с фазовой пластинки. Фазово-контрастный конденсор можно оставлять на штативе, так как для перехода к наблюдению в светлом поле нужно лишь перевести револьвер конденсора в нулевое положение.

Рис.14 Лептоспира
в темном поле (микрофотография)

Рис.15. Бактерии
из зубного налета в темном поле
зрения
Фазово-контрастная микроскопия
Фазово-контрастная микроскопия позволяет получать контрастные изображения неокрашенных, неконтрастных объектов, в которых темные и светлые места соответствуют различной толщине и оптической плотности препарата.
Известно, что контрастность изображения находится в прямой зависимости от степени поглощения света различными структурными элементами объекта. Если в объекте чередуются места, сильно и слабо адсорбирующие свет, то последний, проходя через объект, изменяет свою амплитуду. Интенсивность световых лучей, прошедших через различные участки такого объекта, будет различной. Такие препараты называются амплитудными. Наряду с амплитудными существуют совершенно прозрачные объекты. Пройдя через такие объекты, свет или совсем не ослабляется, или ослабляется чрезвычайно мало. Однако в зависимости от различных показателей преломления отдельными участками объекта или его неравномерной толщины по выходе из объекта смещается фаза светового колебания. Сдвиг фазы происходит из-за неодинаковой скорости распространения света в средах с различной оптической плотностью. В местах большей оптической плотности свет как бы замедляет свою скорость, изменяется по фазе. Такие объекты называются фазовыми. К ним относится большинство живых клеток и микроорганизмов. Глаз человека и фотопластинка фазовые колебания света не выявляют. Для их обнаружения служит метод фазовых контрастов, предложенный в 1934 г. голландцем Цернике.
Метод фазовых контрастов основан на использовании теории Аббе о дифракционном построении изображения в микроскопе/
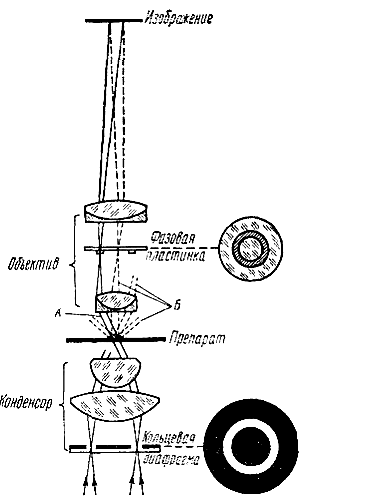
Сущность метода сводится к тому, что обычный конденсор микроскопа заменяют на специальный конденсор с кольцевой диафрагмой, а в револьвер ввинчивают специальный объектив. На полевую линзу этого объектива нанесена фазовая пластинка в виде кольца, состоящая из тонкого слоя специального состава. Кольцо света, проходя через кольцевую диафрагму конденсора и объект, фокусируется на фазовой пластинке объектива. Фазовая пластинка значительно ослабляет силу света нулевого максимума и смещает фазы проходящих через него прямых световых волн на 90°.
Луч света, падающий на прозрачный объект, расщепляется на два луча — прямой и дифрагированный. Прямой луч (рис. , А) идет из кольцевой диафрагмы, проходит через частицу объекта и фокусируется на кольце фазовой пластинки. Дифрагированный луч, (рис. , Б), проходя через объект, не попадает на фазовую пластинку. Оптические пути этих двух лучей оказываются различными. Между ними создается разность фаз, и невооруженным глазом нельзя уловить это смещение фаз. Однако фазовой пластинкой эти фазовые изменения преобразуются в амплитудные, воспринимаемые глазом изменения. Прозрачные в светлом поле зрения препараты становятся резко контрастными на светлом фоне (положительный фазовый контраст) или блестящими на темном фоне (отрицательный фазовый контраст).
Рис.16. Ход лучей
в фазово-контрастном микроскопе:
А —
прямой и В — дифрагированный лучи
Фазово-контрастное устройство может быть установлено на любом световом микроскопе и состоит из: 1) набора объективов-ахроматов. В каждом объективе имеется фазовая пластинка в виде темного кольца, нанесенного на внутреннюю линзу. Назначение пластинки состоит в изменении фазы нулевого максимума на 90° и уменьшении его интенсивности; 2) фазово-контрастного конденсора и револьвера с набором кольцевых диафрагм, которые устанавливают применительно к каждому объективу. Для наблюдения обычным способом в конденсоре имеется ирис-диафрагма, а в диске револьвера — отверстие для пропуска световых лучей. Смена кольцевых диафрагм перед объективом производится поворотом револьвера до фиксации. Для центрировки кольцевой диафрагмы относительно фазовой пластинки объектива служат два боковых винта; 3) вспомогательного микроскопа, вставляемого в тубус вместо окуляра и служащего для наблюдения при центрировке кольцевой диафрагмы по отношению к фазовой пластинке.
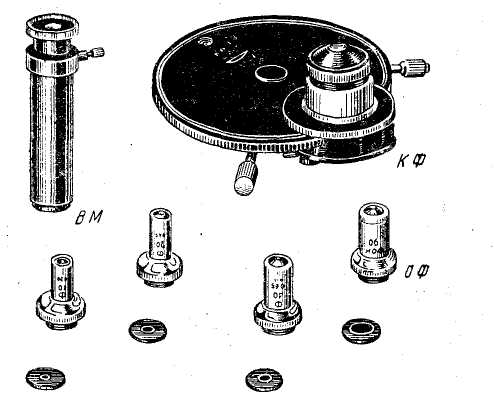
Рис.17.
Приспособление для фазово-контрастной
микроскопии:
ВМ
— вспомогательный
микроскоп, КФ — конденсор фазовый,
ОФ —
объективы фазовые
Настройку микроскопа с фазово-контрастной приставкой производят следующим образом:
Заменяют объективы и обычный конденсор в микроскопе на фазовые.
2. Поворотом диска конденсора устанавливают нулевую диафрагму (в окошечке должна появиться цифра 0).
Помещают препарат на столик микроскопа, при объективе ХЮ устанавливают освещение и производят фокусировку. Диафрагму конденсора открывают полностью.
Заменяют нулевую диафрагму конденсора на диафрагму, соответствующую увеличению используемого фазового объектива. Так, при рассматривании препарата с объективом ХЮ повернуть револьвер конденсора до появления в окошечке цифры 10.
Заменяют окуляр микроскопа на вспомогательный микроскоп. Ослабив винт, осторожно поднимают выдвижную трубу вспомогательного микроскопа до появления отчетливого изображения кольцевой диафрагмы конденсора и фазовой пластинки объектива.
Фиксируют выдвижную трубу вспомогательного микроскопа винтом.
Вращением центрировочных винтов конденсора совмещают кольцевую диафрагму конденсора с фазовым кольцом объектива.
Вынимают вспомогательный микроскоп из тубуса, вставляют нужный окуляр, устанавливают фокус и изучают объект.
При каждой смене объективов необходимо повторить все операции, указанные в пунктах 4, 5, 6, 7, 8.
Рис.18.Фазово-контрастная
микроскопия Bacillus cereus на плотной
питательной среде (в камере М. А. Пешкова)
Фазово-контрастная микроскопия не увеличивает разрешающей способности оптической системы микроскопа. Однако она позволяет видеть тонкие детали структуры живых микробов, изучить стадии их развития и процесс деления, выявить влияние химических веществ, антибиотиков и других факторов на микробную клетку, измерить ее прижизненную величину. Благодаря применению этого способа микроскопии контраст живых неокрашенных микроорганизмов резко увеличивается и они выглядят темными на светлом фоне (позитивный фазовый контраст) или светлыми на темном фоне (негативный фазовый контраст).
ДИК (дифференциально-интерференционный контраст) - является прекрасным механизмом для создания контраста в прозрачных препаратах. Микроскопия с ДИК представляет собой интерференционную систему с расщеплением пучка света, при которой контрольный пучок отклоняется на небольшое расстояние, обычно меньшее, чем диаметр дифракционного кружка. С помощью данного метода получается монохроматическое оттененное изображение, которое отображает градиент оптических путей как высоко-, так и низкопространственных частот, присутствующих в препарате. Те участки препарата, при прохождении через которые оптические пути удлиняются по отношению к контрольному пучку, выглядят ярче или темнее, тогда как участки, между которыми различия меньше, обладают противоположным контрастом. Чем круче становится градиент оптических пучков, тем резче контраст изображения.
Хоффмановский контраст (ХК) представляет собой метод косого освещения, повышающий контраст в окрашенных и неокрашенных препаратах за счет образования градиента оптических фаз. ХК пoзвoляeт нaблюдaть тpexмepнoe изoбpaжeниe живыx oбpaзцoв в плacтикoвыx чaшкax c выcoкoй чeткocтью. За счет использования бoльшиих paбoчих paccтoяний и выcoких чиcлoвых aпepтуp метод позволяет тoчнo oтcлeживaть движeние в пoлe зpeния, нaпpимep, пpи проведении микроманипуляций.
ХК мoжeт быть пpимeнeн нa микpocкoпe c флуopecцeнтным ocвeтитeлeм. Изучeниe мopфoлoгии c пpимeнeниeм флуopecцeнции или бeз тaкoвoй вoзмoжнo бeз cмeны oбъeктивoв и oбpaзцa. Стоит отметить преимущество Хоффмановского контраста по сравнению с Фазовым контрастом. Известно, что Фaзoвoму кoнтpacту пpиcущ эффeкт Гaлo - появление светящегося ореола по контуру изображения объекта. B peзультaтe Bы мoжeтe пoтepять вaжную инфopмaцию. XК нe дaeт Гaлo, чтo пoзвoляeт лeгкo oпpeдeлять cвoйcтвa кpaeвыx cтpуктуp, нaпpимep, тoчнo зaмepять углы или расстояния.
Рис.19.Хоффмановский
контраст