
ТЕМА ЗАНЯТТЯ: "Типові хімічні властивості, біологічна
роль і застосування біогенних S-елементів у медицині" -2 г.
1. АКТУАЛЬНІСТЬ ТЕМИ.
Тема необхідна для вивчення хімічних реакцій, які протікають у живій клітці при участі неорганічних іонів, а також для вивчення наступних тим, зокрема , координаційних сполук, тому що іони металів з лигандами в біологічних системах існують у вигляді координаційних сполук
У медичній практиці відоме застосування сполук S -елементів, наприклад, солі літію - при лікуванні подагри, сполук стронцію - безпосередньо ставиться до карієсу зубів.
Знання теми необхідно для значення наступних дисциплін - біохімії, фармакологія й інших.
2.ЦІЛЬ ЗАНЯТТЯ.
Вивчити положення S - елементів у періодичній системі елементів Д.І. Менделєєва, особливості будови S - елементів, ступеня їхнього окислювання, зміна ступеня окислювання, зміна властивостей S - елементів у підгрупах, їхня біологічна роль і реакції відкриття. Зрівняти властивості S - елементів ІА і ІІА груп періодичної системи Д.І. Менделєєва.
3.НАВЧАЛЬНІ ЦІЛІ.
Навчитися виконувати якісні реакції на S - елементи, записувати рівняння реакцій, робити висновки по виконаних реакціях.
СТУДЕНТ ПОВИНЕН ЗНАТИ:
1. Електронна будова S - елементів, ступінь їхнього окислювання.
2 .Властивості S - елементів і зміна їх у підгрупах.
3. Положення S - елементів у ряді напруг, відношення їх до води, кислотам.
4. Солі S - елементів ІA і ПА груп, їхня розчинність.
5. Які з S - елементів є біогенними.
6.Біологічна роль S- елементів і застосування їхніх сполук у медицині.
УМІТИ:
1. Характеризувати фізичні й хімічні властивості S - елементів і записувати електронні конфігурації їхніх атомів;
2. Записувати рівняння реакцій, які характеризують властивості S - елементів;
3. З рівняння реакцій, виконаних на практиці й робити висновки.
САМОСТІЙНА РАБОТА: Робота з методичними посібниками й навчальною літературою. Складання конспекту. По лабораторній роботі студентам необхідно виконати досвіди, передбачені методикою виконання роботи.
4. КОНТРОЛЬНІ ПИТАННЯ ДЛЯ САМОПІДГОТОВКИ:
1. Електронна будова атомів S - елементів.
2. Форми сполук S - елементів.
3. Хімічні властивості S - елементів.
4. Розчинність. Добуток розчинності.
5. Аналітичні реакції відкриття S - елементів (К+,
Mg2+, Ва2+, Са2+).
6. Топографія S - елементів в організмі людини.
7. Застосування сполук S - елементів у медицині.
8. Біологічна роль S - елементів.
5. Логико - дидактична схема навчального матеріал



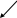 S-елементи
S-елементи




Положення в ПСУ Будова атома Поширення в природі Фізичні властивості





 Хімічні властивості
Особливості будови
Біологічна
роль
Хімічні властивості
Особливості будови
Біологічна
роль



 Зіставлення
властивостей S-елементів І й
Форми
сполук
Зіставлення
властивостей S-елементів І й
Форми
сполук
 ІІ
груп сполук
ІІ
груп сполук


Гидролизуемостъ Термостійкість

Застосування в медицині


Положення S-елементів у ряді напруг Хелатные комплекси S-елементи
ІІ групи
6. ПЛАН І ОРГАНІЗАЦІЙНА СТРУКТУРА ЗАНЯТТЯ
№ |
Основні етапи заняття, його функції й зміст |
Засоби навчання й контролю |
Матеріали методичного забезпечення заняття й контролю знань
|
|
І |
Підготовчий етап
|
|||
|
Організація заняття Постановка навчальних цілей і мотивація Контроль вихідного рівня знань, умінь і навичок по темі: "Типові хімічні властивості, біологічна роль і застосування біогенних S-елементів у медицині" . Зміст заняття: а) будова атомів S - елементів на підставі положення в ПСЕ; б) типи зв'язків у молекулах. Валентність. Ступінь окислювання; в) фізичні й хімічні властивості простих речовин з'єднань S - елементів; г) найважливіші сполуки й поширеність у природі S -елементів. |
|
Журнал обліку відвідування |
|
|
Логіко- дидактичні схеми
|
|||
Індивідуальне опитування |
Таблиці, питання
|
|||
ІІ |
Основний етап
|
|||
|
Формування професійних умінь і навичок: а)записувати форми сполук S -елементів; б) оцінювати розчинність і добуток розчинності; в) проводити аналітичні реакцій відкриття S – елементів; г) знати топографію S - елементів в організмі людини, застосування S - |
Рішення типових завдань, лабораторна робота |
Таблиці, завдання |
|
Лабораторна робота |
Ориентировоч- ная карта лабораторної роботи |
|||
|
елементів у медицині і іхня біологічна роль; д) робити висновки до явищ всіх аналітичних реакцій; е) опанувати технікою лабораторної роботи " Аналітичними реакціями відкриття S-елементів"; ж) оформити протоколи. |
|
|
ІІІ |
Заключний етап
|
||
|
Контроль, закріплення, корекція професійних навичок і вмінь |
Рішення ситуаційних завдань |
Таблиці, завдання
|
|
Підведення підсумків |
|
|
|
Теоретичного рівня |
|
|
|
Практичних навичок |
|
|
|
Домашні завдання |
|
|
|
Основна й додаткова література |
|
Ориентировочна я карта до роботи з літературою |
|
Контрольні питання для самостійної роботи |
|
Методична вказівка до наступної теми |
7. МАТЕРІАЛИ МЕТОДИЧНОГО ЗАБЕЗПЕЧЕННЯ ЗАНЯТТЯ.
ТЕОРЕТИЧНІ ОСНОВИ
БІОГЕННІ ЕЛЕМЕНТИ S-БЛОКУ
S - ЕЛЕМЕНТИ Й ГРУПИ
У періодичній системі хімічних елементів Д.І. Менделєєва біогенні S -елементи входять у головні підгрупи І і ІІ груп. Вони розташовані на початку періодів і є типовими металами.
S - елементи характеризуються малими значеннями потенціалів іонізації при досить більших значеннях радіусів атомів і іонів. S - елементи І групи, як правило, утворять сполуки з іонним типом зв'язку, S - елементи ІІ групи щодо цього трохи уступають ім. Зазначені властивості роблять їх фізіологічно активними, а такі елементи як К, Na, Ca, Mg - життєво необхідного й проявляють в організмі унікальні властивості. Більшість біогенних S - елементів є макроелементами. Їхня висока концентрація в організмі пов'язана з утворенням сполук, які легко розчиняються в біологічних рідинах (S - елементи ІA групи), і важко розчинних солей, що беруть участь у процесах формування кісткової тканини (S - елементи ІІ групи). Біогенні елементи ІІ групи необхідні для нормальної життєдіяльності живого організму. У першу чергу, це макроелементи - водень, калій і натрій (табл. 1.).
ТАБЛИЦЯ 1. ФІЗИКО-ХІМІЧНІ ХАРАКТЕРИСТИКИ
S - ЕЛЕМЕНТІВ І ГРУПИ.
Елемент |
Ступінь окислювання в живому організмі |
Радіус нона, 1 *10-10(м) |
Енергія іонізації кдж/ кДж/моль |
Н |
+ 1 |
10-5 |
1312,1 |
Lі |
+1 |
0,68 |
520,2 |
Na |
+1 |
0,98 |
495,8 |
К |
+ 1 |
1,33 |
418,8 |
Атом водню має найпростішу конфігурацію 1s11 . Енергія іонізації його атома велика, тому сполуки його навіть із найбільше електронегативними атомами є переважно ковалентними.
Функції іона водню в живому організмі більш близькі до іонів лужних металів, чим до галогенів. Тому властивості водню розглядаються із властивостями елементів ІA групи. Завдяки близькості значень электронегативностей водню й вуглецю в численних сполуках з останнім водень утворить ковалентні зв'язки. В організмі людини в ковалентнозв’язаном стані він утримується також у сполуках з азотом, сіркою, киснем і т.д. Незначна частина водню перебуває у вигляді іона гидроксонія (Н3 О+), що відіграє важливу роль у підтримці кислотно-лужної рівноваги, необхідного для протікання біохімічних реакцій.
Іони гидроксонія в значній кількості знаходяться в шлунковому соку й виконують найважливіші функції: убивають мікробів, що попадають у шлунок з їжею, і беруть участь у гидролитических реакціях як каталізатори. Сполуки водню, у молекулах яких атоми водню ковалентно пов'язані з атомами елементів другого періоду - N, О, F - можуть утворювати водневі зв'язки. Вони встановлюються як між різними молекулами, так і усередині молекул, якщо в цій молекулі є групи з донорною і акцепторною здатностями. Виникнення водневого зв'язку між молекулами може привести до об'єднання молекул в асоціати. Водневий зв'язок установлюється, наприклад, між молекулами води, спирту та ін.
Внутрімолекулярні зв'язки відіграють основну роль у стабілізації α-спіралі й β-складчастої структури поліпептидного ланцюга, забезпечують комплементарность взаємодії пуринових і пиримидиновых підстав у ДНК.
Літій по своїх властивостях трохи відрізняється від інших лужних металів. Малий розмір іона й найбільша поляризуюча здатність серед інших лужних металів приводять до високої сольватації іона й тому сполуки літію характеризуються більшого іонного складового зв'язку. У живому організмі літій здатний заміщати натрій і навпаки. На цьому засноване лікування солями натрію при отруєнні літієм. Літій постійно втримується в крові, органах і тканинах людини. Має яскраво виражену біологічну активність (А.И. Войнар). Подібність у хімічних властивостях літію й натрію визначає їхній однаковий вплив на протікання ферментативних процесів. Здатність літію заміщати іони натрію в солях сечової кислоти, образуя при цьому розчинні солі, використається при лікуванні подагри. Літій характеризується десенсибилизирующим дією, у малих концентраціях володіє ингибирующим впливом на фактори згортання крові. Тому його сполуки можуть знайти застосування в комплексній профілактиці й терапії тромбозів.
Макроелементи калій і натрій розподілені по всьому організмі. За даними А. Уэбба, у всіх органах, крім нирок, зміст калію більше, ніж натрію. По хімічних властивостях калій помітно відрізняється від натрію й особливо від літію. Це в значній мірі обумовлено наявністю калію і його аналогів вільних d -орбиталей, що мають енергію близьку з енергією ns -підроівневий. Розходження у властивостях можливо визначає й різне поводження їх у живих організмах. Головна відмінність полягає в тім, що іони літію й натрію входять до складу міжклітинних рідин, а іони калію -внутрішньоклітинних; катіони натрію пригнічують активність функції м'язів і тому необхідні для їхнього скорочення, катіони калію сприяють розслабленню серцевих м'язів між скороченнями (табл.2).
ТАБЛИЦЯ 2. ЗМІСТ ІОНІВ НАТРІЮ Й КАЛІЮ В ДЕЯКИХ ОРГАНАХ І БІОЛОГІЧНИХ РІДИНАХ.
Іони Na+ |
Зміст, мг% |
Іони К+ |
Зміст, мг% |
Головний мозок |
300 |
Кісткова тканина |
15 |
Спинний мозок |
325 |
Зубна тканина |
17 |
Лімфа |
290 |
М'яза |
100 |
Сироватка крові |
335 |
Легені |
38 |
Легені |
245 |
Печінка |
55 |
|
|
Еритроцити |
115 |
Різна концентрація катіонів калію й натрію усередині й поза нервовою кліткою і її аксоном і більшою легкістю проходження через мембрану іонів К+ і Сl- чим Na+ приводить до виникнення в тілі клітки різниці потенціалів порядку 60-90 мВ, при цьому внутрішня поверхня клітинної мембрани заряджається негативно стосовно зовнішнього. Утвориться своєрідний - Na+ - К+ - насос. При порушенні протікають біохімічні процеси, які приводять до зміни проникності клітинної мембрани. Унаслідок іони натрію проникають усередину клітки, викликаючи локальне гасіння негативного заряду й зміна його на позитивний. Виникає так званий потенціал дії. Відновлення первісного потенціалу відбувається не внаслідок зворотного пересування іонів натрію, а внаслідок виходу із клітки еквівалентної кількості іонів калію. Причина зміни проникності мембрани й транспорту іонів проти градієнта концентрацій до кінця не з'ясована, але прямо залежить від клітинного метаболізму. Висловлюється точка зору, що активну роль у переносі іонів через мембрану грає тетрамерна структура калій-натрієвої атефази (К-, Na-атф-ази): почергова зміна конформації субъединиц зі зміною спорідненості до даного іона організує як би естафетну передачу іона з однієї сторони мембрани на іншу.
Катіони натрію й калію в основному утворять сполуки, добре диссоциирующие на іони. Але, за даними Л. Уэбба, установлена можливість утворення в живих організмах комплексних сполук з м'язовим білком міозином.
Моновалентні катіони можуть брати участь в утворенні містка між ферментом і субстратом. Їхня роль зводиться до утворення комплексних сполук типу фермент - катіон -субстрат, у якому катіони одновалентного металу певним чином орієнтують функціональні групи субстрату щодо активних центрів ферменту. Крім того, вони можуть, зв'язуючись із ферментом, створювати й стабілізувати певну конфігурацію, необхідну для прояв лише каталітичної активності.
Підтвердженням цього служить взаємодія К+ і Na+ з моделлю антибіотика - валиномицином, що являє собою макроциклічний поліпептид, називаний іонофором (переносить іони). Унікальні властивості валиномицина пов'язані з винятково високої калій - натрієвою вибірковістю, причому константа стійкості комплексу з катіоном калію на 3-4 порядку перевищує константу стійкості комплексу з іоном натрію. Валиномицин відрізняється універсальністю дії на мембрану. Був установлено (Ю.А. Овчинников, Т.А. Іванов, 1976), що іони калію зв'язуються за рахунок атомів кисню карбонільної групи валиномицина на зовнішній поверхні мембрани, а потім переходять до другої молекули іонофора, розташованої усередині мембрани. Є дані, що в певних умовах валиномицин може давати "сандвичевий" комплекс, що, мабуть, і бере участь у переносі іонів калію через мембрани.
S – ЕЛЕМЕНТИ ІІА ГРУПИ.
До біогенних S - елементам ІІА групи відносять макроелементи магній і кальцій, які по класифікації А.І. Венчикова входять у групу біотиків, що грають роль пластичного матеріалу, а фізико-хімічні умови, що також створюють, для протікання фізіологічних процесів, і мікроелементи бериллій і стронцій; роль інших мікро- і ультрамікроелементів (барію й радію) в організмі з'ясовані недостатньо.
Магній і кальцій є життєво - важливими елементами. Кальцій - основний структурний елемент живих організмів, магній входить до складу великої кількості ферментів і є активатором багатьох біохімічних процесів. Кальцій має більший радіус іона й відповідно меншу енергію іонізації в порівнянні з магнієм, що визначає характер зв'язків у його сполуках (табл. 3.).
ТАБЛИЦЯ. 3. ФІЗИКО-ХІМІЧНІ ХАРАКТЕРИСТИКИ БІОГЕННИХ S - ЕЛЕМЕНТІВ ІІ ГРУПИ.
Елемент |
Ступінь окислювання в живому організмі |
Радіус іона, 1*10 -10м |
Енергія іонізації, кДж / моль |
Be |
+2 |
0,31 |
899,5 |
Mg |
+2 |
0.65 |
737,7 |
Са |
+2 |
0,99 |
589,8 |
Sr |
+2 |
1.13 |
549,4 |
Ва |
+2 |
1.35 |
502,8 |
Атом кальцію більше по розмірі, чим атом магнію, тому його здатність до утворення гідратів, а також розчинність його карбонатів і фосфатів у воді в порівнянні із сполуками магнію значно менше. Карбонати й фосфати кальцію є основним матеріалом, що формує кісткову й зубну тканини.
Кількісною характеристикою розчинності сполук є добуток розчинності (ДР). Його зміст стає ясним, якщо розглянути рівноважні процеси, що мають місце в гетерогенних системах. У таких системах - насичених розчинах важко розчинної речовини - тверда фаза перебуває в рівновазі з гидратированными іонами, що перебувають у розчині. У загальному виді
K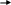
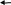 mAn
mKn+
+ nAm-
mAn
mKn+
+ nAm-
Осад розчин
Такий стан характеризується константою рівноваги, що одержують \ використовуючи закон діючих мас, і називають добутком розчинності:
ДР = [Kp n+]m * [Ap m-]n (1.1)
Таким чином, у насиченому розчині важко розчинного сполучення добуток концентрацій його іонів у ступенях стехиометрических коефіцієнтів при даній температурі є величина постійна, (табл. 4).
ТАБЛИЦЯ 4. ДОБУТОК РОЗЧИННОСТІ ДЕЯКИХ МАЛОРОЗЧИННИХ ЕЛЕКТРОЛІТІВ У ВОДІ, Т = 25°С.
Сполуки |
ДР |
рПр = -lgДР |
СаСОз |
4,8 х 10 -9 |
8,32 |
Са3 (Р04)2 |
2,0x10 -29 |
28,70 |
CaF2 |
4,0x10 -11 |
10,40 |
Mg(OH)2 |
5,5 х 10 -12 |
11,26 |
BaSO4 |
1,8x10 -'° |
9,75 |
Імовірно, елементи, що беруть участь у формуванні кісткової тканини, повинні задовольняти основним вимогам: бути макроелементами, мати високу енергію утворення хімічних зв'язків, утворювати малорозчинні сполуки; легко засвоюватися живим організмом. Цим вимогам відповідають фосфат і карбонат кальцію. Кальцій, фосфор, вуглець і кисень є макроелементами; енергія зв'язку кисню з фосфором і вуглецем, через який кальцій зв'язується з ними, досить висока; фосфат і карбонат кальцію малорозчинні сполуки; всі ці елементи легко засвоюються організмом, тому що в природі вони існують у легко доступні для засвоєння формах. Магній, що також є макроелементом, утворить малорозчинні фосфати й основні карбонати, але вони більше розчинні, чим кальцієві. Щелочноземельные метали нерідко конкурують між собою. Наприклад, іони Са2+ придушують активність ферментів, активируемих іонами Mg2+ (магній є активатором більш ніж 15 ферментів). Mg2+ у свою чергу гальмує дія аденозинтрифосфатази міозину, що активують іони Са2+. Іони Mg2+ необхідні для передачі нервових імпульсів, скорочення м'язів і метаболізму вуглеводів. Разом з іонами кальцію іони магнію входять до складу багатьох клітинних структур. Магній є більшою мірою внутрішньоклітинним іоном, кальцію ж у середині клітки значно менше, ніж поза нею. На підстав цього можна чекати наявність магній - кальцієвого насоса між у середині- і міжклітинною рідиною. Причому у всіх клітках поділ Са2+, Mg2+, Na+. К+ строго контролюється.
Такі захворювання, як дистрофія й катаракта, є наслідком перерозподілу цих іонів. Іони Mg2+ визивають антисептичну й судинорозширювальну дію, знижують артеріальний тиск і підсилюють процеси гальмування в корі головного мозку.
Оскільки основна маса кальцію перебуває в організмі в кістках у вигляді нерозчинних сполук, у тканинах концентрація його дуже мала. Припускають, що в рідкому середовищі організму (кров, лімфа) кальцій перебуває в трьох станах: іонізованому; розчинному, але не іонізованому; у сполуках з білками, вуглеводами й ін. Всі ці форми перебувають у стані оборотної рівноваги. Кальцій є необхідним елементом для нормальної життєдіяльності, але в більших кількостях може стати токсичним. При деяких патологічних процесах при порушеннях обміну кальцію й у процесі старіння організму може відбуватися відкладення його солей на стінках кровеносних судин та ін. У цих випадках виникає глаукома, атеросклероз, мочекам’яна хвороба, подагра й т.д.
9. ПИТАННЯ Й ЗАВДАННЯ КОНТРОЛЮ ВИХІДНОГО РІВНЯ
ЗНАНЬ
Завдання 1.
1)Які елементи ПСЕ відносяться до S-блоку? Дати їхню
характеристику.
Алгоритм відповіді:
До S-блоку відносяться елементи І А та ІІ А груп ПСЕ. У них іде заповнення електронами S - підрівня останнього енергетичного рівня, тому вони називаються S-елементами. Вони розміщені на початку періоду, є типовими металами й мають ступеня окислювання +1 і +2 (по номері групи).
S-елементи характеризуються малими значеннями потенціалів іонізації досить більшими значеннями радіусів атомів і іонів. S - елементи ІA групи, як правило, утворять сполуки з іонним типом зв'язку, S - елементи ПА групи щодо цього трохи уступають ім. Зазначені властивості роблять їх фізіологічно активними.
Завдання 2.
2)Які з S - елементів є біогенними? Їхня роль в
організмі.
Алгоритм відповіді:
Серед S - елементів біогенними (біотиками) є Н, К, Na. Са, Mg, Вони є життєво необхідними й проявляють в організмі унікальні властивості, це макроелементи. Їхня висока концентрація в організмі пов'язана з утворенням у біологічних рідина легкорозчинних сполук (S - елементи ІA групи) і з утворенням труднорозчинних солей, які беруть участь у процесах формування кісткової тканини (S - елементи І А групи). За класифікацією А.І. Венчикова Mg, Са відіграють роль пластичного матеріалу, a Na, К створюють физико - хімічні умови для протікання физиологичных процесів.
Завдання 3.
3) Дати характеристику атома водню по ПСЕ. Функції в живому організмі.
Алгоритм відповідей
Атом водню має найпростішу електронну структуру 1S1. Енергія іонізації його атома більша, тому зв'язки його сполук навіть із найбільш електронегативними атомами є в більшості випадків ковалентними. Функції іону водню в живому організмі більш близькі функціям іонів лужних металів, ніж галогенів. Завдяки близькості величин электронегативності з атомом вуглецю в багатьох сполуках з ним водень утворить ковалентні зв'язки. В організмі людини в ковалентно зв'язаному стані він входить до складу сполук із вуглецем, азотом, сіркою й ін. Незначна частина водню перебуває у вигляді іона гидроксония НзО+, що відіграє важливу роль у підтримці необхідної кислотно-лужної рівноваги для ходу біохімічних реакцій. Іони гидроксония в значній кількості виконують найважливіші функції: убивають мікробів, які попадають у шлунок з їжею, і беруть участь у гидролитичних реакціях як каталізатори.
Сполуки водню з полярним зв'язком беруть участь в утворенні водневих зв'язків. Останні встановлюються в молекулах води, між амідними групами в авльфа-спіралях і інших постійних структурах білків, беруть участь у підтримці надмолекулярних структур білків і нуклеіновых кислот, забезпечують комплементарність взаємодії пуринових і пиримідинових основ у молекулі ДНК і ін.
