
- •Идеальный газ, определение и его свойства
- •Термодинамическая система, термодинамический процесс, параметры идеального газа.
- •4Внутренняя энергия идеального газа. Параметры состояния
- •5.Работа газа. Параметр процесса.
- •6.Теплоемкость газа
- •7.Газовые смеси
- •Выражение 1-ого закона термодинамики для различных процессов.
- •Круговые циклы. Термодин. И холодильный коэф.
- •11.Цикл Карно. Теорема Карно.
- •12. Реальный газ. Парообразование в координатах pv.Теплота парообразования. Степень сухости пара.
- •13.Влажный воздух. Его св-ва.
- •15. Температурного поле тела. Температурный градиент.
- •16. Теплопроводность. Закон Фурье.
- •17.Теплопроводность плоской стенки. Основное ур-ние теплопроводности.
- •18.Конвективный теплообмен.Ур-ние Ньютона-Рихмана. Коэф.Теплоотдачи.
- •19. Определение коэф. Теплоотдачи с использованием критериальных ур-ний.
- •20.Лучистый теплообмен. Ур-ние Стефана-Больцмана.
- •21. Закон Кирхгофа, Ламберта
- •22. Теплопередача. Уравнение и коэффициент теплопередачи для плоской стенки
- •24. Микроклимат помещений
- •23. Теплообменные аппараты. Определение поверхности нагрева рекуперативных теплообменников
- •25.Сопротивление теплопередачи.
- •26. Теплоустойчивость ограждений. Коэффициент теплоусвоения s. Величина тепловой инерции d.
- •27.Воздухопроницаемость ограждений. Сопротивление воздухопроницаемости
- •29. Определение тепловых потерь здания по укрупненным измерителям.
- •30. Системы отопления
- •28.Определение тепловых потерь чз ограждения
- •31.Системы водяного отопления.
- •32.Гравитационное давление.
- •33. Опред. Циркуляционное давление в однотрубной системе водяного отопления.
- •34.Трубопроводы систем центрального отопления, их соединения.
- •35.Расширительный бак.
- •36.Воздухоудаление.
- •37. Свойство пара как теплоносителя:
- •38.Нагревательные приборы системцентр. Отопления.
- •39.Размещение от-ых приборов.
- •40. Выбор типа нагревательных приборов и определение их поверхности нагрева.
- •42.Регулировка теплоотдачи нагр. Приборов.
- •43. Топливо.
- •44. Горение топлива
- •45. Способы сжигания топлива. Виды топочных устр., их характер.
- •46. Котельная установка.
- •47. Централизованное теплоснабжение. Схема тэц.Тепловые сети.
- •48.Присоединение местных сист. Отопления к тепл. Сетям
- •49. Расчет и подбор водоструйного элеватора.
- •50. Назначение и классификация систем вентиляции, воздухообмен, способы его определения.
- •56. Вентиляторы.
7.Газовые смеси
В теплотехнике гораздо чаще приходится иметь дело не с однородным газом, а со смесью нескольких газов (например, с воздухом, природным газом, продуктами сгорания топлива и др.).
Смесь
идеальных газов - механическая смесь
отдельных компонентов, химически между
собой нереагирующих, каждый из которых
занимает объем газовой смеси и имеет
общую с ней температуру и оказывает
свое собственное давление. Смесь идеал.
газов тоже подчиняется всем законам,
относящимся к идеальным газам. Для
удобства решения практических задач
со смесями газов введено понятие о
кажущейся
молекулярной массе смеси газов. Это
средняя масса из действительных
молекулярных масс отдельных компонентов,
составляющих смесь. Уравнение состояния
смеси газов выводится на основании
ур-ний состояния отдельных компонентов
смеси и имеет вид:

Газовую
постоянную смеси, Дж/(кг·К),можно найти
также по формуле
8.1-ый з-н термодинамики, его математическое выражение.
1-ый закон термодинамики является частным случаем всеобщего закона сохранения и превращения энергии. Этот закон устанавливает основные положения взаимопревращения теплоты и механической работы, а также эквивалентность этих превращений.
1ый закон термодинамики: в неизолированной термодинамической системе изменение внутренней энергии ΔU = разности полученного кол-ва теплоты и совершаемой системой работы. Т.е. подводимое к рабочему тело тепло расходуется на изменение внутренней энергии и на совершение работы.
Пусть в цилиндре с подвижным поршнем находится 1 кг рабочего тела. Если к этому рабочему телу подвести q Дж теплоты, то состояние его изменится, поршень перейдет в другое положение и рабочее тело при этом совершит L Дж работы. Разница между кол-вом теплоты, подведенной к рабочему телу, и совершенной им работой выражает изменение внутр. энергии тела
q-L=U2-U1; q=(U2-U1)+L
Для бесконечно малого изменения состояния рабочего тела (газа) имеем dq = du + dl,
где dq — бесконечно малое количество теплоты, Дж/кг; du — бесконечно малое изменение внутренней энергии рабочего тела, Дж/кг; dl — бесконечно малое количество совершаемой работы, Дж/кг.
Полученные уравнения являются математическим выражением 1ого закона термодинамики. Если в термодинамическом процессе находится не один, a G кг рабочего тела, то кол-во участвующей в процессе теплоты Q будет Q = Gg
-количество совершаемой работы L = Gl,
-изменение внутренней энергии U2-U1=G(u2-u1)
Выражение 1-ого закона термодинамики для различных процессов.
И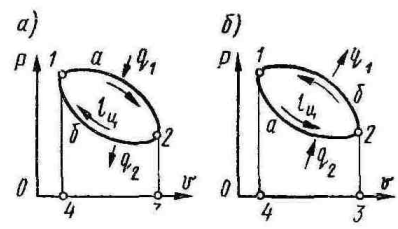 зохорный
процесс
(v=const)
совершается
в герметично закрытом сосуде при
нагревании
или охлаждении газа. В
изохорном процессе
давление газа изменяется прямо
пропорционально его абсолютной
t
и вся
подведенная теплота идет на увеличение
внутр. энергии. qv=Cvm(T2-T1)
зохорный
процесс
(v=const)
совершается
в герметично закрытом сосуде при
нагревании
или охлаждении газа. В
изохорном процессе
давление газа изменяется прямо
пропорционально его абсолютной
t
и вся
подведенная теплота идет на увеличение
внутр. энергии. qv=Cvm(T2-T1)
Изобарный процесс (р=const) - подогрев воздуха в топках и нагревания воздуха в помещении практически могут рассматриваться как изобарные. В изобарном процессе объем изменяется прямо пропорционально его абсолютной t. Сообщенное тепло идёт на изменение внутренней энергии и совершение системой работы
qp=Cpm(T2-T1).
Изотермический процесс (T=const). В координатах р-v этот процесс изображается равнобочной гиперболой. Отношение абсолютных давлений обратно пропорцианально отношению обьёмов.
Вся теплота, сообщенная телу, расходуется на совершение внешней мех. работы.

Адиабатный процесс. Необходимым и определяющим условием адиабатного процесса является аналитическое выражение dq=0 означающее полное отсутствие теплообмена. Работа при адиабатном расширении происходит вследствии изменения внутр. энергии рабочего тела.

