
- •А.Н. Пырко сборник задач и контрольные задания по аналитической химии
- •Введение
- •1. Классификация методов анализа
- •2. Метрологические характеристики методов анализа
- •3. Закон эквивалентов
- •4. Свойства растворов
- •4.1 Способы выражения концентрации растворов
- •4.2 Связь различных способов выражения концентрации растворов
- •4.3 Ионная сила и рН растворов
- •4.4 Расчет рН растворов разных электролитов
- •4.5 Решение типовых задач
- •4.6 Задачи для самостоятельного решения
- •5. Гравиметрический (весовой) метод анализа
- •5.1 Основные этапы гравиметрического анализа
- •5.2 Основные требования к осаждаемой и гравиметрической форме
- •5.3 Основные требования к осаждению кристаллических осадков
- •5.4 Общая характеристика метода
- •5.5 Решение типовых задач
- •5.6 Задачи для самостоятельного решения
- •6. Титриметрический (объемный) метод анализа
- •6.1 Общая характеристика метода
- •6.2 Растворы в титриметрическом анализе
- •6.3 Решение типовых задач
- •6.4 Задачи для самостоятельного решения
- •6.5 Реакции в титриметрическом анализе
- •6.6 Процесс и способы титрования
- •6.7 Общие сведения о кривых титрования
- •6.8 Расчет концентрации веществ на различных участках кривых титрования
- •7. Кислотно-основное титрование (метод нейтрализации) 7.1 Общая характеристика метода
- •7.2 Индикаторы кислотно-основного титрования
- •7.3 Логарифмические кривые кислотно-основного титрования
- •7.4 Титрование слабой кислоты сильным основанием
- •7.5 Титрование смеси кислот (оснований)
- •7.6 Расчет рН раствора в различные моменты титрования
- •7.7 Выбор индикатора титрования
- •7.8 Решение типовых задач
- •7.9 Задачи для самостоятельного решения
- •8. Методы окислительно-восстановительного титрования
- •8.1 Расчет фактора и числа эквивалентности веществ, участвующих в овр
- •8.2 Кривые окислительно-восстановительного титрования
- •8.3 Способы фиксирования конечной точки титрования (к. Т. Т.)
- •8.4 Перманганатометрия
- •8.5 Аналитические возможности метода перманганатометрии
- •8.6 Иодометрия
- •8.7 Приготовление и стандартизация рабочих растворов i2 и Na2s2o3
- •8.8 Условия проведения и аналитические возможности метода
- •8.9 Решение типовых задач
- •8.10 Задачи для самостоятельного решения
- •9. Комплексонометрия
- •9.1 Общая характеристика метода
- •9.3 Кривые комплексонометрии и способы установления конечной точки титрования (к. Т. Т.)
- •9.4 Условия проведения комплексонометрического титрования
- •9.5 Решение типовых задач
- •9.6 Задачи для самостоятельного решения
- •10. Электрохимические методы анализа
- •10.1 Классификация электрохимических методов
- •10.2 Основные электрохимические методы
- •10.3 Решение типовых задач
- •10.4 Задачи для самостоятельного решения
- •11. Хроматографические методы
- •11.1 Механизмы хроматографического разделения
- •12. Спектроскопия
- •12.1 Поглощение в уф- и видимой областях
- •12.2 Люминесценция
- •12.3 Инфракрасная (ик) спектроскопия
- •12.4 Ядерный магнитный резонанс (ямр)
- •12.5 Масс-спектрометрия (мс)
- •Химические сенсоры
- •12.6 Решение типовых задач
- •12.7 Задачи для самостоятельного решения
- •13. Аналитическая проба
- •Отбор проб веществ разного агрегатного состояния
- •Получение лабораторной пробы
- •Разложение пробы
- •Дополнение
- •Аналитическая химия (Вопросы к сдаче зачета)
- •Варианты контрольных работ
- •Содержание
12.1 Поглощение в уф- и видимой областях
Спектры поглощения в УФ- и видимой областях содержат как качественную, так и количественную информацию о поглощающем веществе. Последнее и позволяет использовать их в аналитической химии. Поглощение света подчиняется закону Бугера - Ламберта – Бера
I = I0.10-Cl; T =I/I0; D =lg1/T = -lgT =lgI0/I = .C.l
где D – оптическая плотность, I0 и I – интенсивности падающего и прошедшего через образец света, T – пропускание, – молярный коэффициент поглощения (экстинкции), l – длина оптического пути (толщина поглощающего слоя) в см, c – молярная концентрация. Измерив оптическую плотность D, из соотношения D = cl можно найти концентрацию поглощающего вещества.
Образцы, используемые в абсорбционной спектроскопии в УФ- и видимой областях, – это, как правило, разбавленные растворы. Диапазон концентраций, которые можно определить, зависит от молярного коэффициента экстинкции исследуемого вещества, максимальное значение которого составляет ~ 105 (отметим, что измерения следует проводить при длине волны, соответствующей максимуму в спектре поглощения). Для получения достоверных результатов измеряемая оптическая плотность должна находиться в диапазоне 0,01–2. При толщине поглощающего слоя в 1 см это соответствует концентрации 10–8 М, что в 1000 раз ниже, чем при титровании. Обычно в рабочей области (области линейности) измерений концентрация может изменяться по меньшей мере в 100 раз. Селективно подбирая длину волны, отвечающую максимуму поглощения вещества, можно исключить влияние матрицы (растворителя). Измерения оптической плотности непродолжительны, что позволяет определять с их помощью скорости реакций. Если исследуется смесь нескольких поглощающих веществ, то концентрацию каждого из них определяют, проводя измерения при длинах волн, отвечающих максимумам поглощения этих веществ.
12.2 Люминесценция
Поглотив квант
энергии электромагнитного излучения
частица вещества переходит из основного,
самого нижнего по энергии (S0)
электронного состояния, в более высокое
по энергии возбужденное (S1,
S2….Si…S![]() )
состояние, в котором частица может
находиться ~ 10-8
– 10-13
сек. Совокупность процессов преобразования
энергии в молекуле называется
фотофизическими
процессами.
Для молекулы органического соединения
основное состояние обычно синглетное
(S0),
которое означает, что количество
электронов в молекуле с противоположными
спинами одинаково и их суммарный спин
равен нулю (на каждой молекулярной
орбитали находится по два электрона с
противоположно направленными спинами
)
состояние, в котором частица может
находиться ~ 10-8
– 10-13
сек. Совокупность процессов преобразования
энергии в молекуле называется
фотофизическими
процессами.
Для молекулы органического соединения
основное состояние обычно синглетное
(S0),
которое означает, что количество
электронов в молекуле с противоположными
спинами одинаково и их суммарный спин
равен нулю (на каждой молекулярной
орбитали находится по два электрона с
противоположно направленными спинами
![]() .
Из возбужденного
квантового состояния
(обычно синглетного Si,
.
Из возбужденного
квантового состояния
(обычно синглетного Si,![]() )
происходит либо излучение (люминесценция),
либо безызлучательное перераспределение
энергии среди всех частиц системы в
тепловую (безызлучательная релаксация).
Система приходит в состояние равновесия,
характеризуемого определенной
температурой (Рис.8). Можно выделить два
этапа этого процесса. Вначале протекает
изоэнергетический (без потери молекулой
энергии) «горизонтальный» из одного
квантового состояния в другое. Эти
безызлучательные переходы бывают двух
типов: без изменения спина электрона –
внутренняя
конверсия (
ВК,
Sn
)
происходит либо излучение (люминесценция),
либо безызлучательное перераспределение
энергии среди всех частиц системы в
тепловую (безызлучательная релаксация).
Система приходит в состояние равновесия,
характеризуемого определенной
температурой (Рис.8). Можно выделить два
этапа этого процесса. Вначале протекает
изоэнергетический (без потери молекулой
энергии) «горизонтальный» из одного
квантового состояния в другое. Эти
безызлучательные переходы бывают двух
типов: без изменения спина электрона –
внутренняя
конверсия (
ВК,
Sn![]() Si
, Tn
Ti
) и с обращением спина – интеркомбинационная
конверсия
(ИК,
Sn
Ti
и Tn
Si ).
Символом Ti
обозначается триплетное
состояние (обычно возбужденное), которое
означает, что на двух высших по энергии
занятых орбиталях молекулы находится
по одному электрону с одинаково
направленными спинами (
Si
, Tn
Ti
) и с обращением спина – интеркомбинационная
конверсия
(ИК,
Sn
Ti
и Tn
Si ).
Символом Ti
обозначается триплетное
состояние (обычно возбужденное), которое
означает, что на двух высших по энергии
занятых орбиталях молекулы находится
по одному электрону с одинаково
направленными спинами (![]() )
и суммарный спин электронов отличен от
нуля (равен единице). У Ti
триплетного состояния уровень энергии
ниже энергии одинакового с ним по
орбитальной природе и отличающегося
только спином синглетного Si
состояния. Второй этап – это либо
безызлучательный быстрый «вертикальный»
переход с высокого колебательного
уровня нового электронного состояния
на более низкие колебательные с передачей
избытка колебательной энергии другим
молекулам системы (колебательная
релаксация), либо излучательный.
Люминесценция также бывает двух типов:
переходы без изменения спина электрона
- флуоресценция
(Sn
)
и суммарный спин электронов отличен от
нуля (равен единице). У Ti
триплетного состояния уровень энергии
ниже энергии одинакового с ним по
орбитальной природе и отличающегося
только спином синглетного Si
состояния. Второй этап – это либо
безызлучательный быстрый «вертикальный»
переход с высокого колебательного
уровня нового электронного состояния
на более низкие колебательные с передачей
избытка колебательной энергии другим
молекулам системы (колебательная
релаксация), либо излучательный.
Люминесценция также бывает двух типов:
переходы без изменения спина электрона
- флуоресценция
(Sn![]() Si
и Tn
Ti)
и с изменением - фосфоресценция
(Tn
Si
и Si
Tк).
На практике обычно наблюдаются не все
из указанных фотофизических процессов,
так как вероятность их реализации
разная и отличается иногда на много
порядков. Так, у нежестких органических
молекул наблюдается безызлучательная
релаксация энергии электронного
возбуждения и отсутствие флуоресценции
и фосфоресценции. Весьма незначительна
вероятность не указанных на схеме (Рис.
8) излучательных переходов Tn
Ti
и
Si
Tк,
а также со второго и более высоких
возбужденных состояний молекул в
основное. Наблюдаются обычно указанные
на схеме более вероятные излучательные
переходы из первого возбужденного
синглетного (S1
S0,
флуоресценция) и первого возбужденного
триплетного (T1
S0,
фосфоресценция) состояния в основное.
Путь, по которому молекула переходит
из возбужденного в основное состояния,
определяется типом перехода, структурой
молекулы и средой, в которой она находится.
Так, переходы с изменением спина электрона
менее вероятны, чем без изменения (запрет
по спину).
Si
и Tn
Ti)
и с изменением - фосфоресценция
(Tn
Si
и Si
Tк).
На практике обычно наблюдаются не все
из указанных фотофизических процессов,
так как вероятность их реализации
разная и отличается иногда на много
порядков. Так, у нежестких органических
молекул наблюдается безызлучательная
релаксация энергии электронного
возбуждения и отсутствие флуоресценции
и фосфоресценции. Весьма незначительна
вероятность не указанных на схеме (Рис.
8) излучательных переходов Tn
Ti
и
Si
Tк,
а также со второго и более высоких
возбужденных состояний молекул в
основное. Наблюдаются обычно указанные
на схеме более вероятные излучательные
переходы из первого возбужденного
синглетного (S1
S0,
флуоресценция) и первого возбужденного
триплетного (T1
S0,
фосфоресценция) состояния в основное.
Путь, по которому молекула переходит
из возбужденного в основное состояния,
определяется типом перехода, структурой
молекулы и средой, в которой она находится.
Так, переходы с изменением спина электрона
менее вероятны, чем без изменения (запрет
по спину).
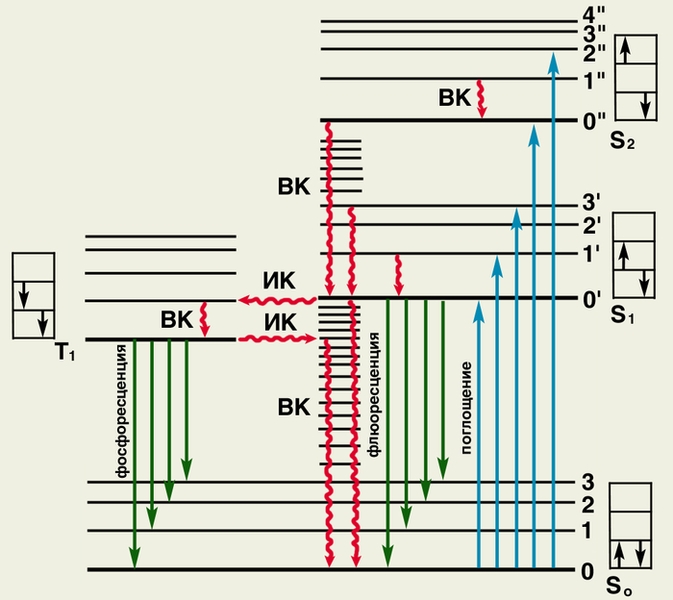
Рис.
8. Схематическое изображение физического
механизма люминесценции:
жирными черными горизонтальными линиями
обозначены энергетические состояния
молекулы люминесцирующего вещества;
S0 —
основное (невозбужденное) состояние;
S2,
S2 и
Т1 —
возбужденные состояния; тонкими
горизонтальными линиями обозначены
колебательные уровни (0,
1, 2.,.
или 0|
, 1|,
2|
и т.д.); в прямоугольниках стрелками
показано направление спина возбужденного
электрона (слева) по отношению к спину
оставшегося электрона; ВК — внутренняя
конверсия (переходы электрона без
обращения спина); ИК — интеркомбинационная
конверсия (переходы электрона с обращением
спина). При поглощении энергии молекула
переходит в возбужденное состояние
S1 или
S2 (обозначено
синими вертикальными стрелками
![]() ).
Часть поглощенной энергии преобразуется
в тепло (обозначено волнистыми стрелками
),
при этом молекула переходит из состояний
(S2,
1||),
(S2,
2||)
вначале на (S2,0||),
а затем по колебательным уровням (S0,
n,
n-1…
и т.д.) «спускается» на нижний колебательный
уровень состояния (S1,
0|)
или
трансформируется в состояние Т1.
Возвращение молекулы из состояния
S1 или
Т1 на
исходный энергетический уровень S0
может
сопровождаться излучением света —
флюоресценцией или фосфоресценцией
(обозначены зелеными стрелками
).
).
Часть поглощенной энергии преобразуется
в тепло (обозначено волнистыми стрелками
),
при этом молекула переходит из состояний
(S2,
1||),
(S2,
2||)
вначале на (S2,0||),
а затем по колебательным уровням (S0,
n,
n-1…
и т.д.) «спускается» на нижний колебательный
уровень состояния (S1,
0|)
или
трансформируется в состояние Т1.
Возвращение молекулы из состояния
S1 или
Т1 на
исходный энергетический уровень S0
может
сопровождаться излучением света —
флюоресценцией или фосфоресценцией
(обозначены зелеными стрелками
).
Разность в энергии уровней Sn - Sn-1 или Тn - Тn-1 уменьшается с ростом номера уровня n (для атомов - главного квантового числа) и после второго возбужденного они по существу сливаются.
В люминесцентной спектроскопии измеряется интенсивность излучения, испускаемого атомами или молекулами вещества при их переходе из возбужденного состояния в основное. Способность системы люминесцировать характеризуется квантовым выходом люминесценции φ, который равен отношению числа излученных фотонов Nизлученных к числу поглощенных Nпоглощенных возбуждающего люминесценцию электромагнитного излучения:
![]() . Очевидно, что 0
< φ < 1
. Очевидно, что 0
< φ < 1
и энергия излученного фотона Еизлученного = hνиз= hc/λиз меньше энергии поглощенного Епоглощенного = hνпо = hc/λпо, а длина волны излучения больше длины волны поглощения (λиз > λпо).
Люминесценция бывает двух типов: флуоресценция и фосфоресценция. При флуоресценции атом или молекула переходит в основное состояние из короткоживущего возбужденного состояния. Она наблюдается почти сразу после поглощения, быстро спадает и исчезает в результате столкновений излучающей молекулы с другими молекулами в растворе (тушение флуоресценции). Фосфоресценция наблюдается при переходе молекулы в основное состояние из относительно долгоживущего возбужденного состояния, так что между поглощением света и испусканием может пройти относительно много времени. Для фосфоресценции характерны бóльшая длина волны излучения, меньшая высота пиков и большее влияние матрицы. Флуоресцентные измерения более избирательны, чем спектрофотометрические, поскольку зависят сразу от двух длин волн: поглощаемого и испускаемого света.
Интенсивность флуоресценции связана с интенсивностью поглощенного света следующим соотношением: Iисп = kIпогл. Это соотношение линейно относительно концентрации только при малых ее значениях: Iисп = kўIпоглC. Здесь k и kў – константы, характеризующие свойства молекулы, связанные с поглощением и испусканием излучения, а C – концентрация определяемого вещества. Флуоресцентный анализ позволяет измерять в 1000 раз меньшие концентрации, чем спектрофотометрический. Это связано с характером сигнала, определяемого в том и другом случаях: во флуоресцентных измерениях нужно зарегистрировать небольшую разницу между двумя слабыми сигналами, а при измерениях поглощения – между сильными, что гораздо сложнее.
Если свет испускается в результате химической реакции, то процесс называют хемилюминесценцией. Интенсивность излучения зависит от скорости химической реакции, а последняя, в свою очередь, от концентрации. Таким образом, измеряя интенсивность хемилюминесценции, можно определить концентрацию соответствующего реагента. В качестве примера люминесцентного определения приведем реакцию с участием люминола. При окислении пероксидом водорода в присутствии комплексов переходных металлов это вещество люминесцирует, что позволяет проводить количественное определение следовых количеств ионов металлов (или некоторых комплексов), а также пероксида водорода.
