
- •А.Н. Пырко сборник задач и контрольные задания по аналитической химии
- •Введение
- •1. Классификация методов анализа
- •2. Метрологические характеристики методов анализа
- •3. Закон эквивалентов
- •4. Свойства растворов
- •4.1 Способы выражения концентрации растворов
- •4.2 Связь различных способов выражения концентрации растворов
- •4.3 Ионная сила и рН растворов
- •4.4 Расчет рН растворов разных электролитов
- •4.5 Решение типовых задач
- •4.6 Задачи для самостоятельного решения
- •5. Гравиметрический (весовой) метод анализа
- •5.1 Основные этапы гравиметрического анализа
- •5.2 Основные требования к осаждаемой и гравиметрической форме
- •5.3 Основные требования к осаждению кристаллических осадков
- •5.4 Общая характеристика метода
- •5.5 Решение типовых задач
- •5.6 Задачи для самостоятельного решения
- •6. Титриметрический (объемный) метод анализа
- •6.1 Общая характеристика метода
- •6.2 Растворы в титриметрическом анализе
- •6.3 Решение типовых задач
- •6.4 Задачи для самостоятельного решения
- •6.5 Реакции в титриметрическом анализе
- •6.6 Процесс и способы титрования
- •6.7 Общие сведения о кривых титрования
- •6.8 Расчет концентрации веществ на различных участках кривых титрования
- •7. Кислотно-основное титрование (метод нейтрализации) 7.1 Общая характеристика метода
- •7.2 Индикаторы кислотно-основного титрования
- •7.3 Логарифмические кривые кислотно-основного титрования
- •7.4 Титрование слабой кислоты сильным основанием
- •7.5 Титрование смеси кислот (оснований)
- •7.6 Расчет рН раствора в различные моменты титрования
- •7.7 Выбор индикатора титрования
- •7.8 Решение типовых задач
- •7.9 Задачи для самостоятельного решения
- •8. Методы окислительно-восстановительного титрования
- •8.1 Расчет фактора и числа эквивалентности веществ, участвующих в овр
- •8.2 Кривые окислительно-восстановительного титрования
- •8.3 Способы фиксирования конечной точки титрования (к. Т. Т.)
- •8.4 Перманганатометрия
- •8.5 Аналитические возможности метода перманганатометрии
- •8.6 Иодометрия
- •8.7 Приготовление и стандартизация рабочих растворов i2 и Na2s2o3
- •8.8 Условия проведения и аналитические возможности метода
- •8.9 Решение типовых задач
- •8.10 Задачи для самостоятельного решения
- •9. Комплексонометрия
- •9.1 Общая характеристика метода
- •9.3 Кривые комплексонометрии и способы установления конечной точки титрования (к. Т. Т.)
- •9.4 Условия проведения комплексонометрического титрования
- •9.5 Решение типовых задач
- •9.6 Задачи для самостоятельного решения
- •10. Электрохимические методы анализа
- •10.1 Классификация электрохимических методов
- •10.2 Основные электрохимические методы
- •10.3 Решение типовых задач
- •10.4 Задачи для самостоятельного решения
- •11. Хроматографические методы
- •11.1 Механизмы хроматографического разделения
- •12. Спектроскопия
- •12.1 Поглощение в уф- и видимой областях
- •12.2 Люминесценция
- •12.3 Инфракрасная (ик) спектроскопия
- •12.4 Ядерный магнитный резонанс (ямр)
- •12.5 Масс-спектрометрия (мс)
- •Химические сенсоры
- •12.6 Решение типовых задач
- •12.7 Задачи для самостоятельного решения
- •13. Аналитическая проба
- •Отбор проб веществ разного агрегатного состояния
- •Получение лабораторной пробы
- •Разложение пробы
- •Дополнение
- •Аналитическая химия (Вопросы к сдаче зачета)
- •Варианты контрольных работ
- •Содержание
6.7 Общие сведения о кривых титрования
Кривая титрования - это графическая зависимость измеряемого параметра титруемого раствора, зависящего от концентрации титруемого вещества, от объема прибавленного титранта или степени оттитрованности раствора.
Степень оттитрованности раствора – это отношение объема раствора титранта Vт, добавленного к данному моменту к объему титранта Vт.э, необходимого для завершения реакции титрования (эквивалентному объему): F = Vт / Vт.э или выраженная в процентах: F(%) = Vт . 100%/Vт.э
Бывают линейные и логарифмические кривые титрования. Линейные кривые возникают в том случае, когда величина измеряемого параметра пропорциональна концентрации определяемого вещества, титранта или продукта реакции титрования в титруемом растворе (спектрофотометрическое, амперометрическое титрование).
Графическое изображение линейных кривых титрования представлено на рисунках 1 – 3.
На оси ординат откладываются значения величины измеряемого параметра (плотность поглощения, сила тока) пропорционального концентрации определяемого вещества, т.е.
Y = k . c , где Y – измеряемый параметр, c – концентрация определяемого вещества или титранта k – константа, связывающая эти величины, на оси абсцисс – объем раствора прибавленного титранта, от которого линейным образом зависит концентрация определяемого вещества и титранта.
На рис.1 изображена кривая, соответствующая зависимости величины параметра от концентрации определяемого вещества, на рис.2 – от концентрации титранта, на рис.3 – от концентрации как определяемого вещества, так и титранта.
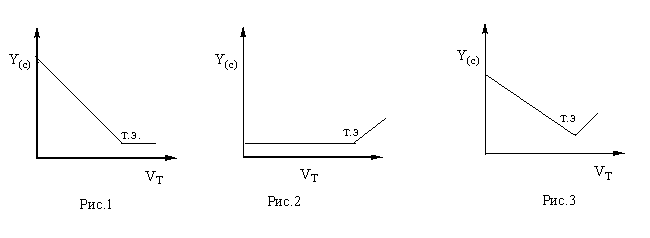
Линейные кривые титрования зависимости величины параметра от концентрации определяемого вещества (Рис.1) , от концентрации титранта (Рис.2), от концентрации как определяемого вещества, так и титранта (Рис.3)
Логарифмические кривые строят в том случае когда величина измеряемого параметра пропорциональна логарифму концентрации определяемого вещества, титранта или продукта реакции титрования (кислотно-основное, окислительно-восстановительное и комплексометрическое титрование). Построение кривых титрования позволяет: а) выбрать индикатор; б) оценить погрешность титрования; в) наглядно проследить за ходом титрования. Характерной особенностью кривой титрования является скачкообразное изменение концентрации X при равномерном прибавлении титранта. Максимальное изменение концентрации X происходит вблизи точки эквивалентности. Точка эквивалентности (т. э.) — это момент титрования, когда к определяемому веществу добавлено эквивалентное количество титранта. Конечная точка титрования (к. т. т.) - это момент титрования, когда на практике от одной последней капли титранта изменяется цвет индикатора и титрование прекращают. Точка начала скачка (т. н. с.) - это момент титрования, когда добавлено 99,9% от количества титранта, необходимою для достижения т.э. (т, е. определяемое вещество недотитровано на 0.1%). Точка конца скачка (т. к. с.) это момент титрования, когда добавлено 100,1% от количества титранта, необходимого для достижения т. э. (т. е. определяемое вещество перетитровано на 0,1%).
Скачок титрования – это отрезок кривой титрования, ограниченный двумя точками, соответствующеми 99,9% и 100,1% оттитрованности определяемого раствора. Скачок титрования - это область кривой титрования вблизи т. э., в которой происходит резкое изменение значения измеряемого параметра раствора(рН, электродного потенциала (Е), рМе) при небольшом изменении объема добавленного титранта. Факторы, влияющие на величину скачка титрования: а) концентрации титруемого вещества X и реагента R; б) природа реагирующих веществ X и R (Kдис., Kуст., Е°, ПР);
в) температура.
