- •4 Билет
- •5 Билет
- •1Химическое равновесие.
- •6 Билет
- •7 Билет
- •2Электролиз
- •1Изомерия. Виды изомерии, структурная и пространственная изомерия
- •10 Билет
- •11Билет
- •12Билет
- •Вопрос 1.
- •1. Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением элементов в периодической системе д.И.Менделеева.
- •13Билет
- •14Билет
- •15Билет
- •16Билет
- •Химические свойства
- •17Билет
- •18Билет
- •19Билет
- •1. Алюминий: положение элемента в периодической системе, строение атома, физические и химические свойства, его роль в современной технике. Где этот металл применяется в вашей профессии.
- •Номенклатура
- •Получение многоатомных спиртов
- •I. Получение двухатомных спиртов в промышленности
- •1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
- •II. Получение трёхатомных спиртов (глицерина)
- •20Билет
- •Волокна растений
18Билет
11. Железо: положение элемента в периодической системе, строение атома, физические и химические свойства, его роль в современной технике.
Химический элемент железо Fe в периодической таблице находится в VIIIB-группе 4 периода и относится к d-элементам. Железо относится к d-элементам, т.е. к тем, у которых идет заполнение d-орбиталей предыдущего энергетического уровня. Его электронная формула
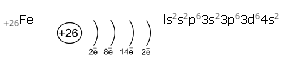
Особенности d-элементов заключаются в том, что в качестве валентных электронов у них могут выступать не только электроны последнего энергетического уровня, но и некоторое число электронов с d-орбиталей предыдущего электронного слоя. Так, для атома железа характерны степени окисления +2 и +3.
Железо – ковкий металл, серебристо-белого цвета. Чистое железо мягче золота и серебра. К особенностям железа относится его способность намагничиваться под действием внешнего магнитного поля.в виде тонкого порошка железо – пирофорно, т.е. способно самовозгораться на воздухе.
Химические свойства.
Железо реагирует с неметаллами:
2Fe + О2 =2FeО
4Fe + 3О2 =2Fe2О3
Fe + S = FeS
При нагревании до 200-250 градусов цельсия реагирует с хлором
Fe+Cl2=FeCl3
Железо реагирует с кислотами.
Fe+H2SO4=FeSO4+H2
В концентрированных азотной и серной кислотах железо не растворяется, так как происходит пассивация металла.
Fe + HCl = FeCl2 + H2
Реагирует с растворами солей металла согласно электрохимическому ряду напряжений металлов.
Fe + CuSO4 = Fe SO4 + Cu
Железо как в прошлом, так и в настоящем играет важнейшую роль в жизни человечества. Оно известно людям уже несколько тысяч лет. Большинство металлических изделий, используемых человеком (машины, станки, вооружение, различные металлоконструкции и др.) изготовлены из сплавов, основным компонентом которых является железо. Этот металл широко распространен на Земле (2 место среди металлов после алюминия).
Железо принадлежит к металлам средней активности. Поэтому под влиянием внешних воздействий (кислорода и влаги воздуха) постепенно окисляется, т.е. подвергается коррозии (около 20% всего выплавляемого железа разрушается от этого процесса). По этой причине изделия из железных сплавов различными способами защищают от воздействия веществ окружающей среды, например покрывают красками или тонкими пленками других более коррозионностойких металлов (никелем или хромом).
В промышленности железо выплавляют из руд путем восстановления железа из руд путем восстановления коксом при высоких температурах. При этом получается чугун. Чугун используют в автомобилестроении, производстве станков.
Выжигая из чугуна примеси, получают сталь.
Сталь — сплав железа, содержащий 0,1-2% углерода и примеси Si, Mn, P, S.
Легированные стали — железные сплавы, содержащие в различных сочетаниях и количествах добавки металлов Cr, Ni, Mo, Co, W, V, Мо, которые придают этим материалам улучшенные свойства (твердость, коррозионную стойкость, пластичность и др.).
2


19Билет
1
БИЛЕТ 19.
1. Алюминий: положение элемента в периодической системе, строение атома, физические и химические свойства, его роль в современной технике. Где этот металл применяется в вашей профессии.
Алюминий является самым распространенным в природе металлом. Содержание его в земной коре составляет 8,05 %. Важнейшие природные соединения алюминия — алюмосиликаты, бокситы, корунды.
Химический элемент алюминий Al в периодической таблице находится в IIIA-группе 3 периода. Его электронная формула
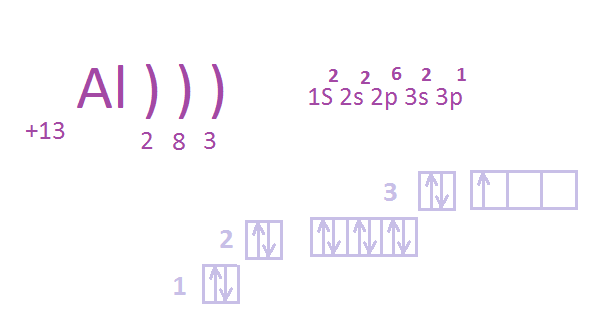
Физические свойства. Алюминий — серебристо-белый легкий металл, плавящийся при 660°С. Очень пластичный, легко вытягивается в проволоку и раскатывается в листы: из него можно изготовить фольгу толщиной менее 0,01 мм. Алюминий обладает очень большой тепло- и электропроводностью. Его сплавы с различными металлами прочны и легки.
Химические свойства. Алюминий — очень активный металл. В ряду напряжений он стоит после щелочных и щелочноземельных металлов. Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей металл от контакта с воздухом.
4 Аl + 3 O2 = 2 Аl2О3 (проявляет амфотерные свойства)
Порошкообразный алюминий при нагревании легко взаимодействует с галогенами и всеми неметаллами.
2 Аl + 3 Вr2 = 2 АlВr3 (бромид алюминия)
2 Аl + N2 = 2 АlN (нитрид алюминия)
4 Аl + 3 С = Аl4С3 (карбид алюминия)
Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:
2 Аl + 6 НСl = 2 AlСl3 + 3 Н2
2 Аl + 3 Н2SO4 = Аl2(SO4)3 +3 Н2
Разбавленная азотная кислота на холоду пассивирует алюминий, концентрированная азотная кислота также пассивирует алюминий.
Алюминий легко отнимает кислород и галогены у оксидов и солей других металлов. Реакция сопровождается выделением большого количества теплоты:
8 Al + 3 Fе3О4 = 9 Fе + 4 Аl2O3
Процесс восстановления металлов из их оксидов алюминием называется алюмотермией. Алюмотермией пользуются при получении некоторых редких металлов, которые образуют прочную связь с кислородом (ниобий, тантал, молибден, вольфрам и др.), а также для сваривания рельсов.
Получение.
В настоящее время его получают электролизом расплавленных солей в электролитических ваннах.
Применение. Алюминий используется очень широко. Из него изготовляют фольгу, применяемую в радиотехнике и для упаковки пищевых продуктов. Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000 °С в смеси алюминиевого порошка (49 %), оксида алюминия (49 %) и хлорида алюминия (2 %). Этот процесс называется алитированием.
2 Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом
Гликоли (диолы)
CH2-CH2
│ │
OH OH
Этиленгликоль
(1,2-этандиол)
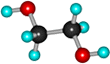
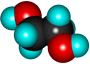
Этиленгликоль (этандиол) |
||
Формула |
Модели молекулы |
|
шаростержневая |
полусферическая |
|
HO-CH2CH2-OH |
|
|
Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру замерзания воды (60%-ый раствор замерзает при -49 ˚С) –это используется в системах охлаждения двигателей – антифризы.
Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки.
Триолы
CH2-OH
│
CH –OH
│
CH2-OH
Глицерин
(1,2,3 – пропантриол)
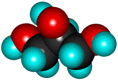
Глицерин (пропантриол-1,2,3) |
||
Формула |
Модели молекулы |
|
шаростержневая |
полусферическая |
|
HOCH2-СH(OH)-CH2OH |
|
|
Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.